梯度洗脱HPLC法同时测定4种驱虫药物的含量
2019-08-27吴昊刘红云张莉吴蕾明文庆蔡一杰
吴昊 刘红云 张莉 吴蕾 明文庆 蔡一杰
摘要 [目的]建立梯度洗脱HPLC法同时测定4种驱虫类药物的含量方法。[方法]采用十八烷基硅烷键合硅胶色谱柱(4.6 mm×250 mm,5 μm),以乙腈-0.2%磷酸溶液为流动相,梯度洗脱;流速1.0 mL/min,柱温为30 ℃,检测波长254 nm。通过液相保留时间、峰纯度检查和光谱相似度检查。[结果]该色谱条件下阿苯达唑、三氯苯达唑、盐酸左旋咪唑、地克珠利分离良好。阿苯达唑、三氯苯达唑、盐酸左旋咪唑和地克珠利均在10~200 μg/mL线性良好,平均回收率分别为98.6%、99.5%、100.3%、99.1%,RSD分别为1.2%、1.0%、1.4%、0.8%。[结论]该研究开发的方法简便、準确、可靠,可用于同时测定以上4种驱虫药物的含量测定。
关键词 阿苯达唑;三氯苯达唑;盐酸左旋咪唑;地克珠利;含量测定;梯度洗脱HPLC法
中图分类号 S859文献标识码 A
文章编号 0517-6611(2019)14-0210-03
doi:10.3969/j.issn.0517-6611.2019.14.062
开放科学(资源服务)标识码(OSID):
Abstract [Objective]The research aimed to establish a method for simultaneous determination of four anthelmintic drugs by gradient elution HPLC.[Method]Analysis was performed on a C18 column ( 4.6 mm×250 mm,5 μm) with acetonitrile and 0.2% phosphoric acid solution as mobile phase under gradient elution at a flow rate of 1.0 mL/min in 30 ℃ condition.The determination wave length was 254 nm.Retention time,peak purity test and spectrum similar test were used.[Result]Under the chromatographic conditions,albendazole,triclabendazole,levamisole hydrochloride and diclazuril were well separated.Albendazole,triclabendazole,levamisole hydrochloride and diclazuril had good linearity at 10-200 μg/mL,the average recoveries were 98.6%,99.5%,100.3%,and 99.1%,respectively,and RSD were 1.2%,1.0%,1.4%,0.8%,respectively.[Conclusion]The method developed by the research is simple,accurate and reliable,and can be used for simultaneously determining the content of the above four anthelmintic drugs.
Key words Albendazole;Trichlorobenzole;Levamisole hydrochloride;Diclazuril;Content determination;Gradient elution HPLC
作者简介 吴昊(1970—),男,安徽宿州人,高级兽医师,硕士,从事兽药、饲料、畜产品安全检测工作。*通信作者,高级兽医师,硕士,从事兽药检测技术研究。
收稿日期 2019-04-11
阿苯达唑是一种咪唑衍生物类广谱驱肠虫药物,作为高效低毒的广谱驱虫药,临床可用于驱蛔虫、蛲虫、绦虫、鞭虫、钩虫、粪圆线虫等。三氯苯达唑为新型咪唑类驱虫药,对各种日龄的肝片形吸虫均有明显驱杀效果,对牛、绵羊、山羊等反刍动物肝片吸虫,牛大片形吸虫、鹿肝片吸虫、鹿大片形吸虫、马肝片吸虫等均有效。盐酸左旋咪唑为四咪唑的左旋体,且药物对虫体的微管结构可能有抑制作用。盐酸左旋咪唑还有免疫调节和免疫兴奋功能,对蛔虫、钩虫、蛲虫和粪类圆线虫病有较好疗效。地克珠利属三嗪苯乙腈化合物,为新型、高效、低毒抗球虫药,广泛用于鸡球虫病[1-5]。
由于集约化养殖业的发展,由寄生虫引起的畜禽疾病时常发生,不仅影响猪、羊、牛、鸡等畜禽的健康成长,也影响养殖效益。为有效防治寄生虫病,定期驱虫、杀虫便成了养殖者的重要管理工作之一。目前,阿苯达唑、盐酸左旋咪唑采用高氯酸滴定法,三氯苯达唑采用紫外分光光度法,地克珠利采用高效液相色谱法[6-10]。实验室环境因素对高氯酸滴定结果影响较大,紫外分光光度法的定性效果不好。但对阿苯达唑等4种驱虫类药物的同时测定的研究鲜见报道。笔者对4种驱虫类药物的含量测定的液相方法进行研究,并对该试验方法进行验证。
1 材料与方法
1.1 材料
1.1.1 试材。阿苯达唑片(规格0.1 g)、三氯苯达唑片(规格0.1 g)、盐酸左旋咪唑片(规格50 mg)、地克珠利预混剂(规格0.5%),上述样品均由安徽省某企业提供。
1.1.2 试剂。乙腈为色谱纯,Merck KGaA公司;其余试剂均为分析纯;试验用水为milli-Q超纯水。阿苯达唑对照品,来源于中国食品药品检定研究院,批号100373-201103,含量99.9%;三氯苯达唑对照品,来源于中国兽医药品监察所,批号H0421108,含量99.8%;盐酸左旋咪唑对照品,来源于中国食品药品检定研究院,批号100167-201203,含量99.8%;地克珠利对照品,来源于中国兽医药品监察所,批号H0131605,含量99.8%。
1.1.3 仪器。U3000戴安高效液相色谱仪,配戴安二极管阵列检测器,美国热电公司;BT-125D 电子天平,赛多利斯;KQ-500E型超声波清洗器,昆山市超声仪器有限公司。
1.2 方法
1.2.1 色谱条件。色谱柱:Waters XSelect CSH C18(4.6 mm×250 mm,5 μm);流动相A为乙腈,流动相B为0.2%磷酸溶液,按表1程序进行梯度洗脱;流速1.0 mL/min;柱温30 ℃;扫描波长190~400 nm,记录254 nm的色谱图;进样量10 μL。
1.2.2 对照品储备液的制备。精密称取阿苯达唑对照品25 mg,置50 mL容量瓶中,加2 mL冰醋酸溶液溶解,用流动相定容至刻度,作为对照品储备液;精密称取三氯苯达唑、盐酸左旋咪唑对照品50 mg,置50 mL容量瓶中,用流动相溶解定容至刻度,分别作为三氯苯达唑、盐酸左旋咪唑对照品储备液。精密称取地克珠利对照品100 mg,置50 mL容量瓶中,用N-N二甲基甲酰胺溶解定容至刻度,作为地克珠利对照品储备液。
1.2.3 混合对照品溶液及系统适应性溶液的制备。分别精密量取阿苯达唑、三氯苯达唑、盐酸左旋咪唑、地克珠利对照品储备液各5 mL置50 mL容量瓶中,用流动相稀释定容至刻度,即得。
1.2.4 供试品溶液的制备。
1.2.4.1 阿苯达唑片供试品溶液的制备。取本品20片,精密称定,研细,精密称取适量(约相当于阿苯达唑25 mg),置 50 mL容量瓶中,加冰醋酸溶液10 mL,超声使溶解,放冷,用流动相稀释并定容至刻度,摇匀,滤过,精密量取续滤液5 mL置50 mL容量瓶中,用流动相稀释至刻度,摇匀,即得阿苯达唑片供试品溶液。
1.2.4.2 三氯苯达唑片供试品溶液的制备。取本品20片,精密称定,研细,精密称取适量(约相当于三氯苯达唑25 mg),置50 mL容量瓶中,用流动相溶解稀释并定容至刻度,摇匀,滤过,精密量取续滤液5 mL置 50 mL容量瓶中,用流动相稀释至刻度,摇匀,即得三氯苯达唑片供试品溶液。
1.2.4.3 盐酸左旋咪唑片供试品溶液的制备。取本品20片,精密称定,研细,精密称取适量(约相当于盐酸左旋咪唑50 mg),置 50 mL容量瓶中,用流动相溶解稀释并定容至刻度,摇匀,滤过,精密量取续滤液5 mL置50 mL容量瓶中,用流动相稀释至刻度,摇匀,即得盐酸左旋咪唑片供试品溶液。
1.2.4.4 地克珠利预混剂供试品溶液的制备。取本品适量,精密称定,加N-N二甲基甲酰胺溶解并定量稀释成每1 mL中约含0.1 mg溶液,即得地克珠利预混剂供试品溶液。
1.2.5 方法学考察。
1.2.5.1 线性范围。精密量取“1.2.2”的对照品储备液适量,置于同一50 mL容量瓶中,用流动相配制含阿苯达唑质量浓度分别为10、20、50、100、200 μg/mL,三氯苯达唑质量浓度分别为10、20、50、100、200 μg/mL,盐酸左旋咪唑质量浓度分别为10、20、50、100、200 μg/mL,地克珠利质量浓度分别为10、20、50、100、200 μg/mL。分别精密吸取上述系列溶液进样10 μL,记录色谱图,测定峰面积;以对照品浓度(X,μg/mL)为横坐标、色谱峰峰面积(Y)为纵坐标绘制标准曲线,计算回归方程。
1.2.5.2 精密度试验。精密吸取混合对照品溶液10 μL,按“1.2.1”色谱条件,连续重复进样6次,记录峰面积,并计算RSD。
1.2.5.3 稳定性试验。取阿苯达唑片供试品溶液、三氯苯达唑片供试品溶液、盐酸左旋咪唑片供试品溶液、地克珠利预混剂供试品溶液,分别在0、2、4、8、12、24 h进样10 μL,记录色谱峰面积,并计算RSD。
1.2.5.4 重复性试验。取阿苯达唑片、三氯苯达唑片、盐酸左旋咪唑片、地克珠利4种驱虫类药物,按照“1.2.4”方法制备供试品溶液各6份,按“1.2.1”色谱分析条件,进样量为10 μL,测定峰面积,计算RSD。
1.2.5.5 加样回收率试验。精密称取已知含量的阿苯达唑片(规格0.1 g,含量为标示量的105.4%)约相当于阿苯达唑20 mg,共9份,置50 mL容量瓶中;精密称取已知含量的三氯苯达唑片(规格0.1 g,含量为标示量的100.4%)约相当于三氯苯达唑20 mg,共9份,置50 mL容量瓶中;精密称取已知含量的盐酸左旋咪唑片(規格0.1 g,含量为标示量的98.9%)约相当于盐酸左旋咪唑20 mg,共9份,置50 mL容量瓶中;精密称取已知含量的地克珠利预混剂(规格0.5%,含量为标示量的101.5%)约相当于地克珠利80 mg,共9份,置50 mL容量瓶中。按高(120%)、中(100%)和低(80%)3个浓度水平分别添加阿苯达唑、三氯苯达唑、盐酸左旋咪唑、地克珠利对照品,每个浓度水平的添加样品分别制备3份,按照“1.2.4”方法制备供试品溶液,再按“1.2.1”色谱条件测定,进样量为10 μL,测定峰面积,计算平均回收率和RSD。
1.2.6 样品含量测定。取阿苯达唑片、三氯苯达唑片、盐酸左旋咪唑片、地克珠利预混剂各4批,一式2份,按“1.2.4”方法制备供试品溶液,按“1.2.1”色谱条件进行测定,计算样品中阿苯达唑、三氯苯达唑、盐酸左旋咪唑、地克珠利的含量。
2 结果与分析
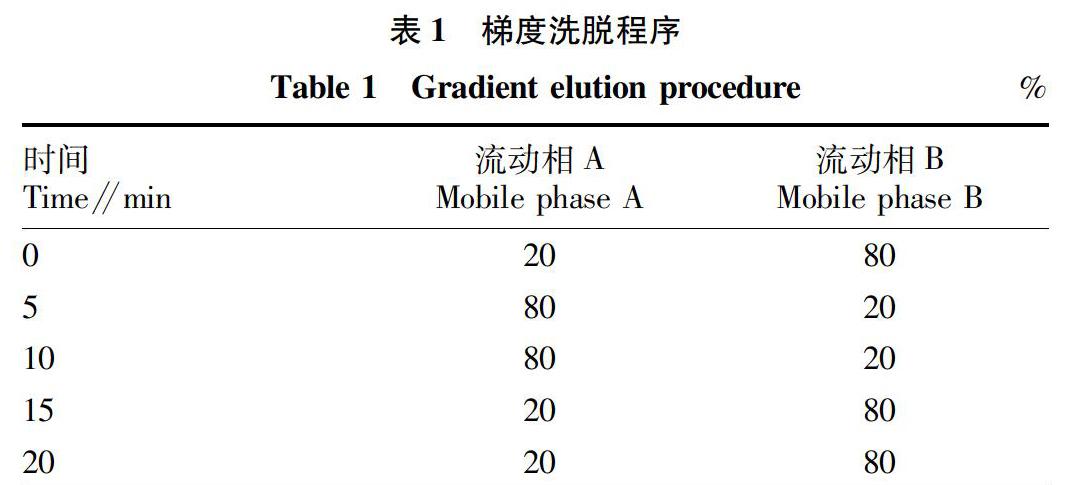
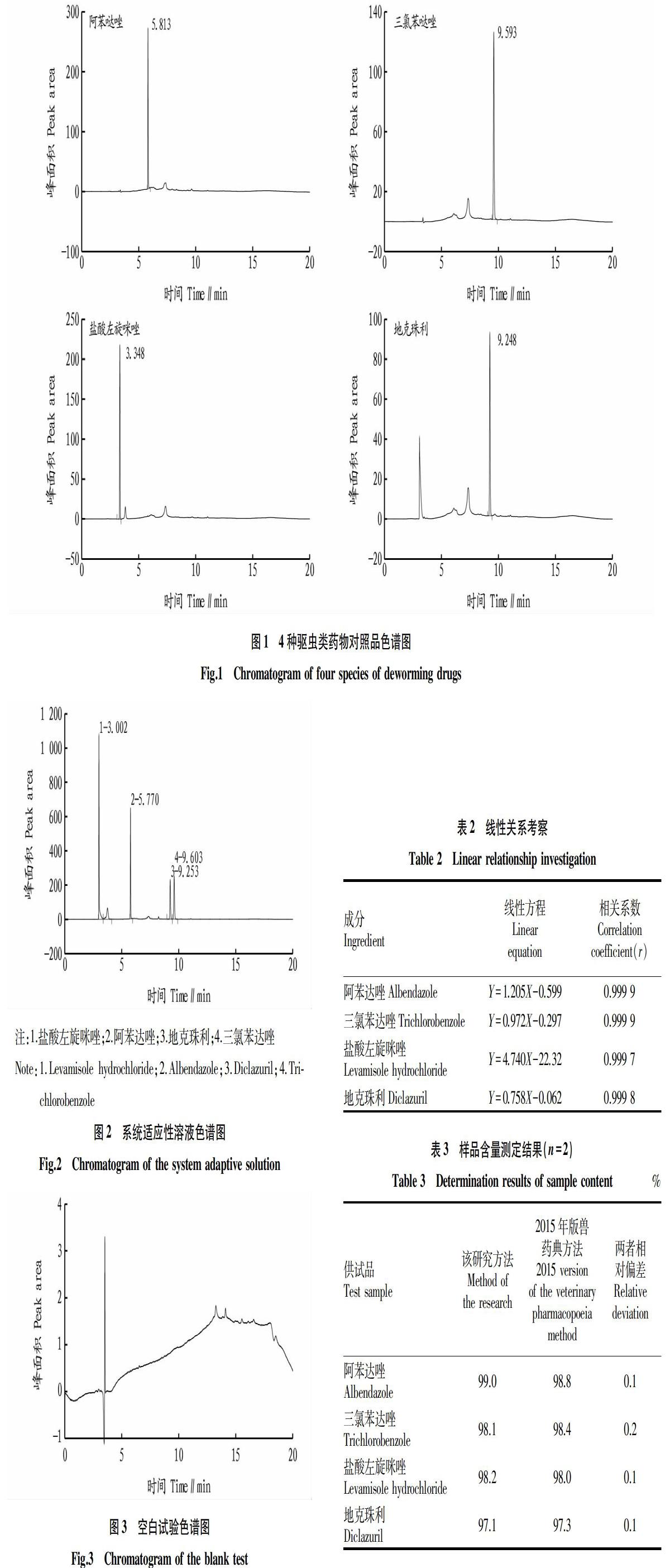
2.1 系统适用性试验 4种驱虫类药物在“1.2.1”色谱条件下完全分离,分离度均大于2.1,各化合物的色谱峰理论塔板数均大于7 000,方法专属性良好。相应对照品色谱图、系统适应性溶液色谱图及空白试验色谱图见图1~3。
2.2 线性范围 按照“1.2.5.1”方法操作,从表2可以看出,阿苯达唑、三氯苯达唑、盐酸左旋咪唑、地克珠利浓度均在10~200 μg/mL与峰面积呈良好的线性关系。
2.3 精密度试验 按照“1.2.5.2”方法操作,计算得出阿苯达唑、三氯苯达唑、盐酸左旋咪唑、地克珠利的峰面积的RSD均为0.1%,表明仪器精密度良好。
2.4 稳定性试验 按照“1.2.5.3”方法操作,计算得出阿苯达唑、三氯苯达唑、盐酸左旋咪唑、地克珠利的峰面积的RSD分别为0.5%、0.3%、0.4%、0.3%,表明上述4种驱虫类药物的供试品溶液在室温下放置24 h稳定。
2.5 重复性试验 按照“1.2.5.4”方法操作,测得阿苯达唑的含量均值为标示量的105.4%,RSD为0.6%(n=6);三氯苯达唑的含量均值为标示量的100.4%,RSD为0.7%(n=6);盐酸左旋咪唑的含量均值为占标示量的98.9%,RSD为0.8%(n=6);地克珠利的含量均值为标示量的101.5%,RSD为0.3%(n=6),表明方法重复性良好。
2.6 加样回收率试验 按照“1.2.5.5”方法操作,结果发现阿苯达唑、三氯苯达唑、吡喹酮、地克珠利平均回收率(n=9)分别为98.6%、99.5%、100.3%、99.1%,RSD分别为1.2%、1.0%、1.4%、0.8%,表明方法的准确度较好。
3 讨论与结论
分别考察了甲醇-0.2%磷酸溶液、甲醇-0.1%甲酸水、乙腈-0.2%磷酸水和乙腈-0.1%甲酸水4种流动相体系,结果表明,乙腈-0.2%磷酸水流动相体系分离效果最佳。因此该研究采用乙腈-0.2%磷酸水作为流动相进行梯度洗脱(0~5 min,20%乙腈→80%乙腈;5~10 min,80%乙腈;10~15 min,80%乙腈→20%乙腈)。
在波长选择上,采用DAD检测器对阿苯达唑、三氯苯达唑、盐酸左旋咪唑、地克珠利4种驱虫类药物进行光谱扫描,结果显示,在254 nm的波长下,这4种驱虫类药物均有良好的响应值。因此采用254 nm作为该方法的检测波长。
该研究建立的梯度洗脱同时测定阿苯达唑、三氯苯达唑、盐酸左旋咪唑、地克珠利的含量的分析方法,结果表明该方法稳定性好、专属性强、准确度高,提高了工作效率,降低了试验误差。
参考文献
[1] 王新,李艳华.兽医药理学[M].北京:中国农业科学技术出版社,2006:137.
[2] 角田清.鸡球虫病学[M].上海:上海科技出版社,1986:87-91.
[3] 黄兵,董辉,沈杰,等.中国家畜家禽球虫种类概述[J].中国预防兽医学报,2004,26(4):313-316.
[4] 常晓辉,薛飞群,张丽芳.鸡球虫病药物防治的研究现状[J].中国动物传染病学报,2011,19(5):71-75.
[5] 高明燕,劉爱玲,刘桂兰,等.抗球虫病药物的研究进展[J].安徽农业科学,2013,41(4):6308-6311.
[6] 中国兽药典委员会.兽药质量标准(2017年版):化学药品卷[S].北京:中国农业出版社,2017.
[7] 中国兽药典委员会.兽药质量标准(2017年版):中药卷[S].北京:中国农业出版社,2017.
[8] 中国兽药典委员会.中华人民共和国兽药典(2015年版一部)[S].北京:中国农业出版社,2017.
[9] 邵超.HPLC法测定阿苯达唑颗粒的含量[J].黑龙江医药,2011,24(3):341-342.
[10] 赵英,张平,唐文标,等.高效液相色谱法测定兽用阿苯达唑片的含量[J].中国兽药杂志,2004,38(5):33-34,37.
