高效体积排阻色谱法定量检测口蹄疫疫苗中146S的疫苗预处理方法
2019-08-27宋艳民杨延丽苏志国刘丽丽朱元源徐嫄邹兴启赵启祖张松平
宋艳民,杨延丽,苏志国,刘丽丽,朱元源,徐嫄,邹兴启,赵启祖,张松平
高效体积排阻色谱法定量检测口蹄疫疫苗中146S的疫苗预处理方法
宋艳民1,2,杨延丽1,苏志国1,刘丽丽1,朱元源3,徐嫄3,邹兴启3,赵启祖3,张松平1
1 中国科学院过程工程研究所 生化工程国家重点实验室,北京 100190 2 中国科学院大学 化学工程学院,北京 100049 3 中国兽医药品监察所,北京 100081
旨在建立一种口蹄疫灭活病毒疫苗的处理方法,去除尺寸排阻色谱法(HPSEC)检测146S抗原过程中的杂质干扰,获得最佳的检测信号并实现146S抗原含量的准确测定。分别考察了超速离心法、PEG沉淀法、核酸酶消化法对两批疫苗样品中的HPSEC检测干扰杂质的去除效果。在优化条件下,超速离心法处理后146S检测结果分别为7.1、7.6 μg/mL,PEG沉淀法为9.7、10.4 μg/mL;酶消化法处理后的检测值最高,分别为10.5、10.4 μg/mL,且杂质去除完全、处理速度快、操作条件温和。通过响应面法确定最优酶消化处理条件如下:200 μL水相中添加终浓度421 U/mL的Benzonase,25.1 ℃下反应1.29 h。在该最优条件下,对4家企业各3种不同血清型共12批疫苗样品进行146S含量检测,结果表明建立的方法对不同疫苗均有良好适用性,且重复性好(<5.3%,=3)。通过该处理方法,解决了杂质对146S定量检测的干扰,扩大了HPSEC检测技术的应用范围,进一步确保了检测结果的准确可靠。
尺寸排阻色谱,口蹄疫疫苗,146S,定量,酶消化
口蹄疫(Foot-and-mouth disease,FMD) 是由口蹄疫病毒(Foot-and-mouth disease virus,FMDV) 引起的一种急性、热性、高度接触性传染病。由于其强感染性及存在多种血清型和亚型,FMD往往难以控制[1-2]。目前,在流行区对口蹄疫的防控主要采取灭活病毒疫苗定期免疫,使用的灭活疫苗为双相油乳剂疫苗[2-3]。随着对疫苗安全性、纯度和整体质量要求的日益严格,疫苗的质量控制在疫苗开发和生产中的重要性与日俱增[4-5]。评价口蹄疫灭活疫苗质量的重要指标之一是疫苗中活性成分即完整病毒粒子146S的含量[6],因此146S含量检测技术的研究成为近几年关注的重点。检测146S抗原含量的传统方法为蔗糖密度梯度离心法[7-8],该方法存在操作复杂、检测速度慢、样品损耗大、结果重复性差等问题[9-12]。酶联免疫吸附法(ELISA) 也有报道[13-14],但存在难以区分完整抗原146S与裂解产物12S的缺点,且准确性差。高效液相尺寸排阻色谱技术(High performance size exclusion chromatography,HPSEC) 因其灵敏度高、快速、重复性好、自动化程度高等优点,近年来广泛应用于疫苗的分析检测[9,15-16]。该技术的原理是利用不同分子水力学大小上的差异,在色谱柱中的停留时间不同,从而实现对疫苗中不同组分的分离、检测[17]。近年来,HPSEC法在口蹄疫疫苗抗原检测上的应用逐渐受到关注。杨延丽等利用HPSEC法对口蹄疫病毒溶液中的146S进行了定量分析和稳定性检测,并结合差示扫描量热技术筛选出对146S具有保护效果的稳定剂[9,18]。徐嫄等通过优化口蹄疫成品疫苗的破乳条件,建立了油乳剂疫苗产品中146S的HPSEC定量检测方法,对该方法的精密度、准确度、专属性、耐受性等进行了验证,并应用到了不同血清型的灭活口蹄疫疫苗的市场抽检[19-20],认为HPSEC法简便、高效、准确度较高,有望在口蹄疫灭活疫苗的质量控制中发挥重要作用。
然而HPSEC在口蹄疫疫苗质量控制的应用中也存在一些挑战。由于各口蹄疫疫苗生产企业的制备工艺差别较大,疫苗中可能存在与146S抗原具有相近尺寸大小的蛋白质、宿主核酸等杂质,干扰146S的紫外特征吸收峰,极大地影响146S的准确定量,从而限制了该方法的广泛应用。本研究旨在建立一种口蹄疫灭活病毒疫苗的前处理方法,去除对HPSEC中146S特征吸收峰产生干扰的主要物质,从而实现146S的准确定量。经过验证,该方法适用于市面上不同厂家、不同血清型的口蹄疫疫苗产品的处理及后续准确测定。
1 材料与方法
1.1 主要仪器
Agilent 1100高效液相色谱仪(Agilent,USA),Neofuge 23R台式高速冷冻离心机(上海力申科学仪器有限公司),Sartorius BS 110S 型万分之一电子天平(Sartorius,Germany),Sorvall WX Ultra Series离心机(Thermo Scientific,USA)及Surespin 630水平转子。
1.2 主要试剂及测试样品
Benzonase (Sigma公司,USA),RNase A (Sigma公司,USA)。所用其他化学试剂均为国产分析纯。供试疫苗样品16批,由国内4家口蹄疫灭活疫苗生产企业生产,由中国兽医药品监察所提供。含O型146S的细胞培养液由兰州兽医研究所提供。146S纯品是根据文献报道的层析纯化方法,对146S细胞培养液进行纯化制备获得[21]。
1.3 口蹄疫疫苗破乳
使用正戊醇作为破乳剂,按疫苗与正戊醇体积比9︰1充分振荡混匀,4 ℃静置30 min后,3 000 r/min、4 ℃离心5 min,取下层抗原水相进行后续处理或检测。
1.4 高效液相尺寸排阻色谱定量检测方法
色谱检测采用TSK G4000 SWXL(7.8 mm× 300 mm)色谱柱(TOSOH);流动相为50 mmol/L pH 7.5磷酸缓冲液,含0.1 mmol/L硫酸钠;进样体积为100 μL;流速为0.6 mL/min;检测波长259 nm。首先建立用于146S定量分析的标准曲线。用上述配置的流动相对146S纯品进行梯度稀释,至最低检测浓度为1 μg/mL。根据上述色谱条件对各浓度的146S纯品进行检测,以仪器积分的峰面积为横坐标,146S浓度为纵坐标,绘制峰面积与浓度的线性回归方程,得到方程=0.016 5(2=0.998,=6)。随后采用上述色谱条件对破乳后得到的水相抗原进行检测,将146S的积分峰面积代入所得回归方程中,即可计算得到146S在破乳水相中的浓度。
1.5 超速离心法处理
取10 mL疫苗破乳后收集的水相抗原加至10 mL超速离心管中,分别于Sorvall WX Ultra Series离心机中20 000 r/min离心5 h、30 000 r/min离心4 h、40 000 r/min离心2 h。弃去上清液后,用200 mmol/L 磷酸钠缓冲液(PBS) (pH 8.0)复溶至10 mL,进行后续HPSEC检测。每个样品及离心条件重复3次实验。
1.6 PEG沉淀法处理
取1 mL水相抗原,分别加入终浓度6%–10% (/) 的聚乙二醇2 000、6 000、10 000,以及终浓度0–1 mol/L 的氯化钠。混匀后于4 ℃静置 10 h充分沉淀146S,8 000 r/min离心20 min,弃去上清后用等体积的PBS (pH 8.0)复溶并采用HPSEC检测。
1.7 核酸酶消化处理
将Benzonase和RNase A分别预先用 50 mol/L Tris-HCl (pH 8.0)、20 mmol/L NaCl、 2 mmol/L MgCl2缓冲液稀释至一定浓度。取疫苗破乳水相抗原200 μL,分别加入1 μL稀释后的酶液至终浓度为50–500 U/mL。混匀后于20–37 ℃下反应0.5–3.0 h后采用HPSEC测定。
1.8 透射电子显微镜检测
146S的形貌通过FEI Tecnai 20 透射电子显微镜检测(TEM,Royal Philips Electronics,Amsterdam)。将少量样品滴至400-网眼铜载网,1%乙酸双氧铀染色,自然干燥后测定。
2 结果与分析
2.1 无处理的疫苗的HPSEC检测
随机挑选4批不同血清型的口蹄疫疫苗(表1),按照文献报道的方法[20],经破乳后直接进行HPSEC法定量检测。除非特别说明,本文中的146S含量均为疫苗破乳后水相中的浓度。
根据图1中的色谱图,样品2、4的色谱图与报道中的一致[9],能够很好地检测到146S在13.4 min左右出现的特征吸收峰,而1、3样品的色谱图中存在大量的杂质覆盖了146S的吸收峰,无法积分计算含量。因此,这部分口蹄疫疫苗样品,难以直接使用HPSEC进行准确定量,从而限制了在口蹄疫疫苗质量控制的应用。为了解决这一问题,去除杂质对146S特征峰的干扰,对1、3样品分别采用超速离心法、PEG沉淀法、核酸酶消化法进行处理,优化去除干扰的最佳方法及条件。
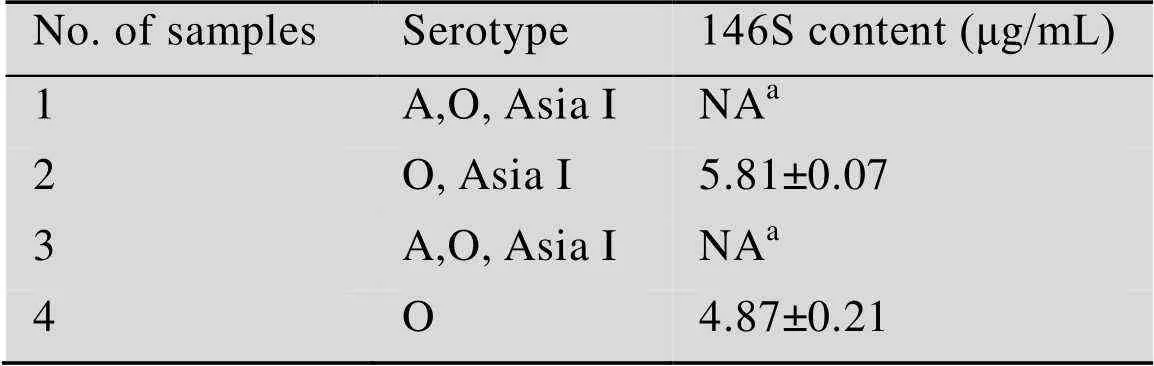
表1 不经预处理疫苗样品的测定结果
aNA represents the 146S concentration was not acquired due to disturbance from impurities.

图1 四种口蹄疫疫苗不经预处理的HPSEC测定色谱图
2.2 超速离心法处理
超速离心的时间和转速都将影响146S的沉淀完全与否。转速越高、沉淀时间越长,146S沉淀的越完全,但过高的离心速度同样会导致杂质的沉淀而降低除杂效果。三种离心条件下处理后样品1、3的HPSEC检测色谱图如图2所示。相比未经处理时,经超速离心收集后的样品其146S特征峰附近的干扰杂质大大减少,能逐渐看到146S特征吸收峰。然而146S损失大,尤其是在30 000 r/min离心4 h时,未能观测到显著的146S特征峰。此外,3种条件均无法去除9–14 min出现的尺寸比146S大的杂质。这可能是由于这些杂质具有比146S更大的沉降系数,当146S被沉降收集时,这些杂质也被一同收集。经过对146S峰面积计算,最佳条件为40 000 r/min 离心2 h,测得样品1浓度为7.1 μg/mL,样品3浓度为 7.6 μg/mL。作为对比,将7.5 μg/mL的146S纯品按照相同操作进行40 000 r/min离心2 h沉淀并重悬,测得浓度为5.8 μg/mL,表明该方法可能会产生抗原损失。
<1),且各件产品是否为不合格品相互独立.
2.3 PEG沉淀处理
首先以样品3为考察对象,对PEG沉淀过程中添加的PEG分子量、PEG浓度及氯化钠浓度的影响设计了Box-Behnken响应面试验,结果见表2。经过PEG沉淀后,对146S特征吸收峰有干扰的物质都被不同程度地去除,并能检测到146S特征峰。PEG沉淀的条件不仅影响到干扰杂质的去除效果,同样也会影响146S抗原经过沉淀复溶后的收率。根据Design-Expert 8.0拟合结果,向水相抗原中加入质量体积比为10%的PEG 6 000,NaCl浓度为0 mol/L时进行沉淀复溶的结果最佳,HPSEC检测具有最高值。在该条件下对样品1和3的水相抗原进行处理后进行HPSEC检测的结果见图3。该最佳条件下测得样品1浓度为9.7 μg/mL,样品3浓度为10.4 μg/mL。作为对比,将7.5 μg/mL的146S纯品按照相同操作进行PEG沉淀及复溶,测得浓度为7.1 μg/mL,与原浓度相近,但经过处理后结果略低。
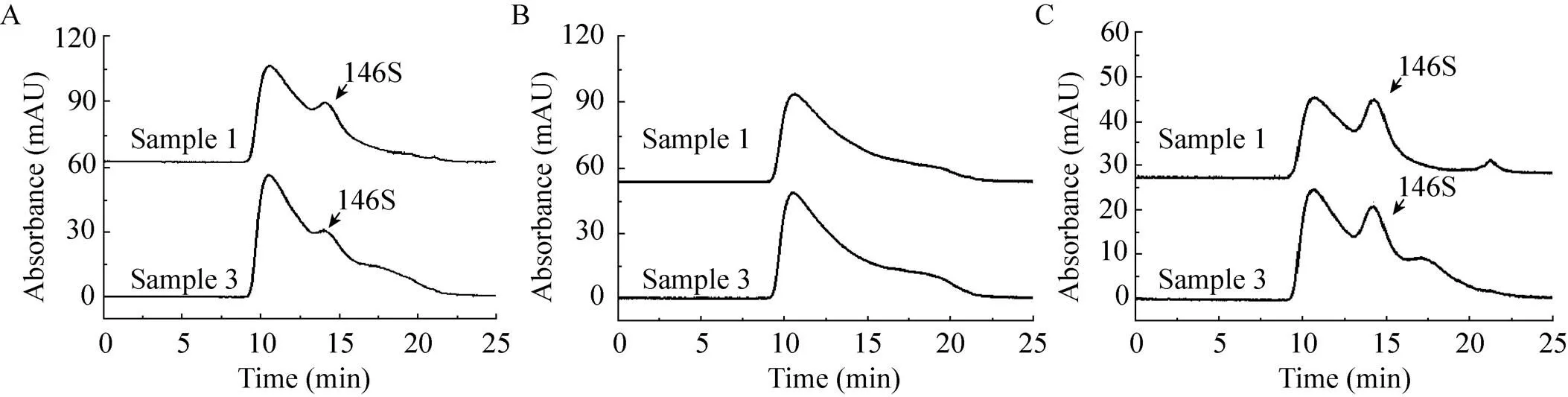
图2 1号和3号疫苗抗原相超速离心预处理后色谱图
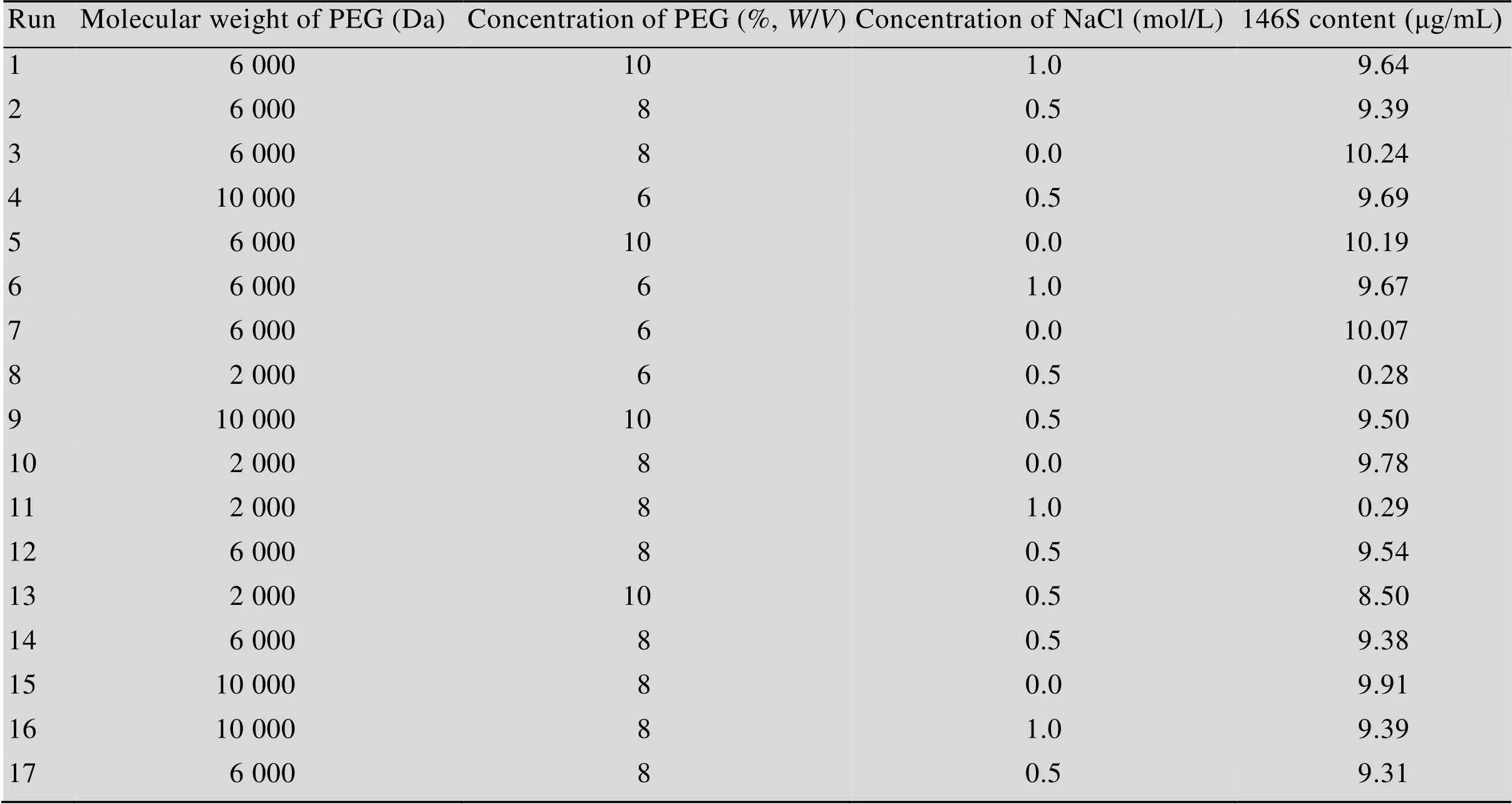
表2 PEG沉淀试验的Box-Behnken设计方案及响应值结果
2.4 核酸酶消化法试验
口蹄疫疫苗生产所得细胞培养液中可能包含大量的宿主核酸或病毒核酸未被纯化除去而存在于最终制备的疫苗中。为了去除这部分杂质的影响,首先向200 μL样品3的抗原水相中分别加入终浓度为500 U/mL的Benzonase或RNase A,于25 ℃下反应1 h后进行HPSEC检测,结果见图4A。经过核酸酶消化后,干扰物的紫外吸收均有大幅度减少,但Benzonase消化后能够检测到完整的146S特征峰,而RNase A未能完全去除干扰物,仍存在极少量干扰峰对146S的积分产生影响。RNase A为内切核糖核酸酶,具有高度专一性,可催化RNA链的断裂[22]。Benzonase则为多功能非限制性核酸内切酶,可将不同的DNA或RNA链完全水解成小片段,且无蛋白水解活性[23],可在不破坏病毒蛋白衣壳的同时,将外部核酸杂质完全水解。因此Benzonase的处理效果更理想,且以上结果也证实对HPSEC检测146S抗原产生干扰的主要物质应为核酸。收集图4B中经Benzonase处理后的样品1的146S特征峰,经TEM验证为完整的146S颗粒。
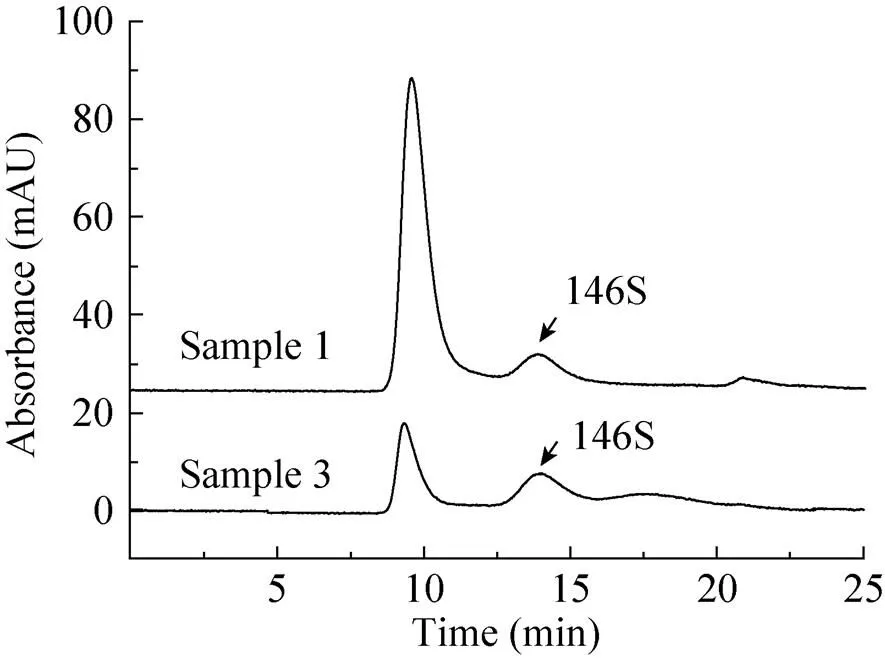
图3 FMDV疫苗抗原相PEG沉淀预处理后的色谱图

图4 FMDV疫苗抗原相核酸酶消化预处理后色谱图
进一步优化Benzonase处理条件。提高温度可以提高酶活、减少处理时间,但由于FMDV极不稳定[24-26],提高温度可能会造成146S的裂解。对酶消化的时间、温度、酶浓度三种因素设计了响应面实验,结果见表3。对影响146S检测浓度的各因素之间的交互作用进行分析,并绘制响应面曲线图(图5)。各变量因素对146S检测浓度影响程度的大小顺序依次为:酶活浓度>温度>时间。利用Design-Expert 8.0软件对表3数据进行统计分析,并建立二次回归方程,得2=0.953 9,表明拟合结果较好。经过响应面实验,确定的最佳操作条件为200 μL水相添加终浓度为421 U/mL的酶溶液,25.1 ℃环境中反应1.29 h。将该最优条件用于样品1、3处理,色谱图如图4B所示。经充分酶消化反应后,大量干扰紫外吸收峰消失,而20 min左右的紫外吸收峰显著增大,表明干扰杂质被降解为分子量更小的杂质。随着干扰杂质的去除,能够检测到完整的146S特征吸收峰。经积分计算,测得样品1浓度为10.5 μg/mL,样品3浓度为10.4 μg/mL。
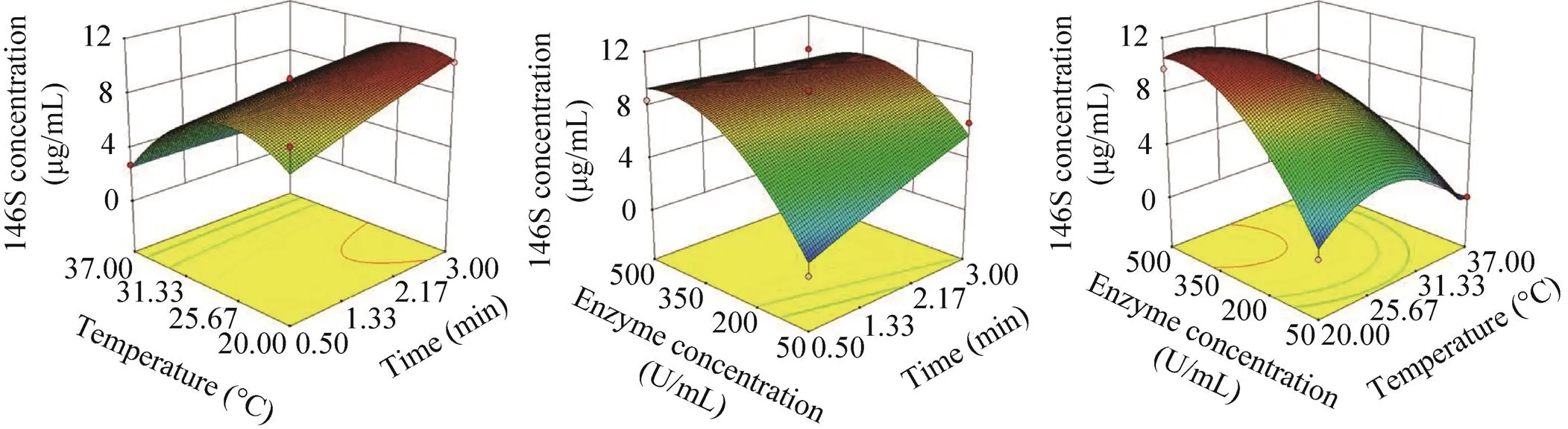
图5 时间、温度和酶浓度对146S测定结果的交互影响
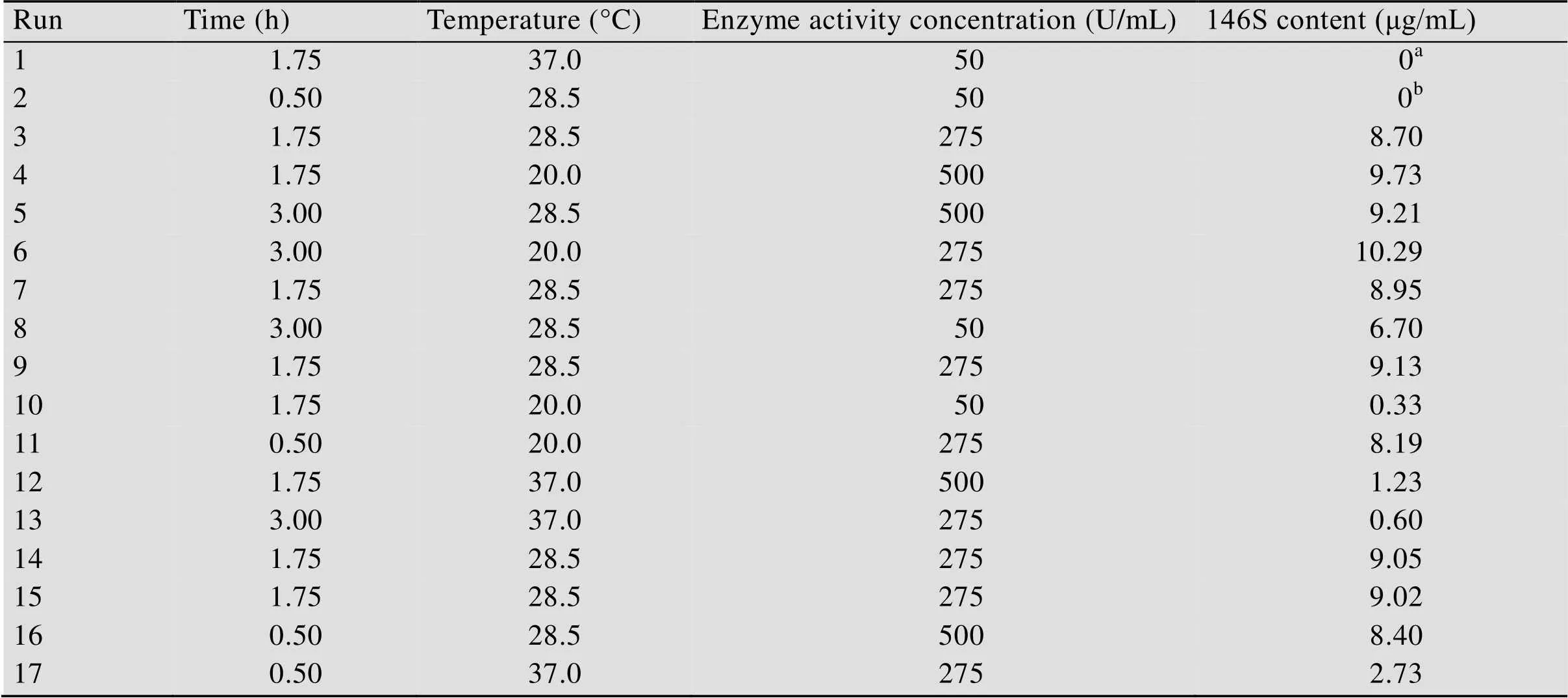
表3 核酸酶处理响应面设计方案及响应值结果
adisturbance was removed after digestion but no 146S was detected, which was probably due to 146S dissociation at 37 °C.
b146S concentration was not acquired due to disturbance from impurities, no evident 146S peak was observed.
为进一步验证核酸酶是否会对146S的颗粒结构或内部的核酸产生影响,以及该处理温度、时间条件下是否会导致146S的损失,在7.5 μg/mL 146S纯品中分别加入终浓度为421 U/mL的Benzonase或RNase A,于25.1 ℃环境中反应1.29 h,并与加酶孵育前的146S进行HPSEC色谱图和透射电子显微镜观测比较。如图6所示,146S的特征吸收峰的位置、峰面积以及TEM形貌,在加入核酸酶反应前后均未发生明显改变。该结果表明,在优化的酶处理的温度、时间条件下,两种核酸酶处理对146S的含量和结构均无影响。并且由于146S在259 nm处特征峰的大小没有变化,也进一步证实由于病毒衣壳蛋白间的空隙较小,核酸酶难以进入病毒内部,从而不会作用于病毒内部的RNA,否则由于RNA的降解,其紫外吸收将会发生变化。
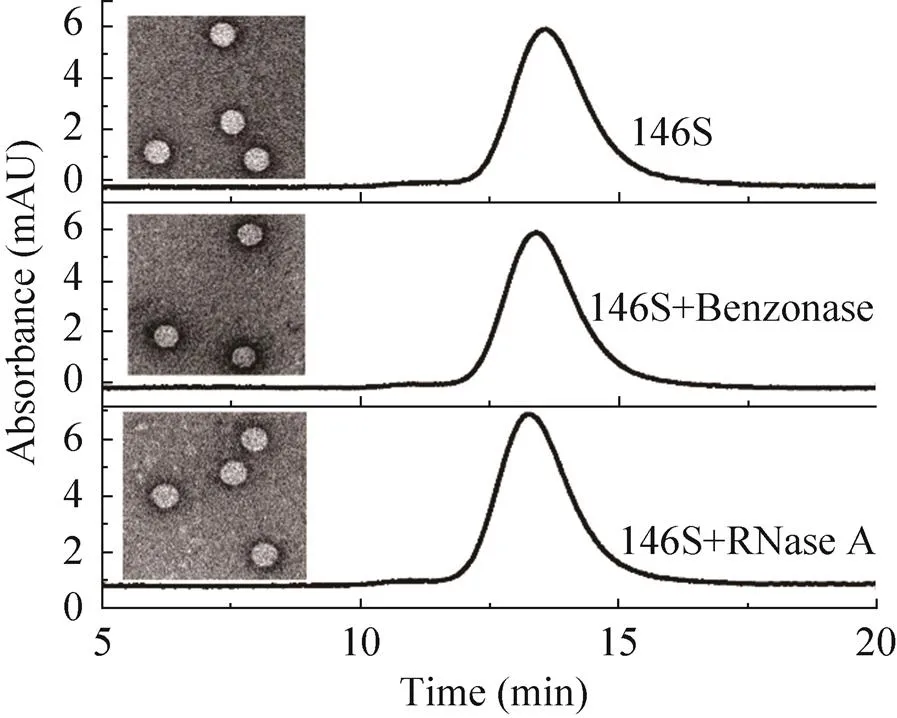
图6 146S分别加入两种核酸酶处理前后色谱图对比
2.5 三种处理方法比较
对以上3种水相抗原的处理方法的比较汇总于表4。对比3种方法的146S检测结果,PEG沉淀与酶消化法均高于超速离心法,且根据HPSEC色谱图可知这两种方法能够完全去除干扰物对特征峰的干扰,得到的结果更准确,而超速离心法不仅难以完全去除干扰杂质,还产生较大的抗原损失。但PEG沉淀操作可能会产生部分146S抗原的损失,使得部分样品的测定结果略低于酶消化法,且PEG沉淀法的缺点是处理时间长,需要静置过夜。此外,超速离心法还受限于仪器的处理量,难以应用于大量样品的处理。而Benzonase酶消化法不仅处理速度快,操作条件温和,且处理量不限,为3种方法中的最优方法。
2.6 疫苗样品的测定
对建立的酶消化法的适用性、检测结果重复性及准确性进行了考察。测定了4家企业各3种不同血清型共12批疫苗样品破乳水相中的抗原含量,图7分别对比酶处理及未经酶处理的HPSEC检测的谱图,计算得到的146S含量结果汇总于表5。
可以看出,由于各企业生产工艺不同,疫苗中 146S和干扰杂质含量不同,对 146S 检测产生了不同程度的影响。HPSEC图谱显示12 批样品的色谱结果存在差异,有些样品干扰杂质含量较高,掩盖了146S特征峰,有些无杂质干扰。存在干扰峰的样品经酶处理后均能检测到完整的146S特征峰,如图7 A2、B1、C2、D2所示,表明酶消化法对不同企业不同血清型的样品均有良好的适用性;无干扰峰的样品经酶处理后的检测结果与酶消化前的图谱一致,如图7 A1、B2、C1所示,表明酶消化法不会造成146S的损失。经3次重复操作的均小于5.3%,表明处理重复性良好。对比无干扰样品加酶前后的检测结果,均小于5%。

表4 三种处理方法比较

图7 12个批次疫苗样品抗原相经过Benzonase在优化条件下预处理前后进行HPSEC检测的色谱图
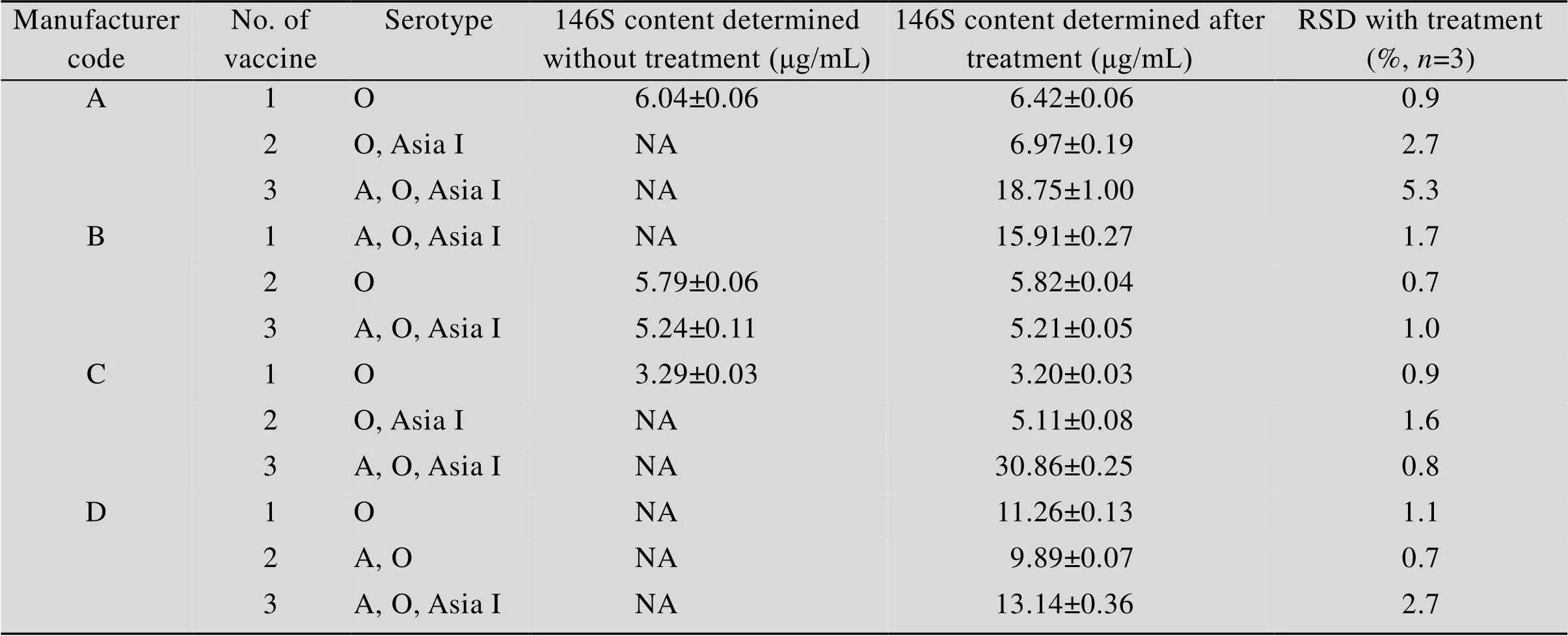
表5 疫苗样品测定结果
3 讨论
HPSEC作为一种疫苗抗原质量评价的新方法,具有快速、高效、成本低等优点。146S特征峰与杂质的有效分离是保证其含量准确检测的基础。在应用HPSEC分析检测口蹄疫灭活疫苗中的146S抗原含量时,因不同企业生产工艺的不同会遇到与杂质的分离度不理想或146S吸收峰不明显的情况。文中针对这一问题,综合考察比较了3种不同原理的去除杂质干扰的样品处理方法。对处理方法的要求在于,首先要能够完全去除干扰物质对146S特征峰的影响,同时要保证处理过程不会造成146S的损失。在本研究考察的3种方法中,超速离心法利用病毒146S具有高的沉降系数从而与杂质分离,但实际去除干扰杂质效果一般,且操作费时费力,设备昂贵;PEG沉淀法利用146S具有较大尺寸,在较低浓度的PEG条件下能被沉淀从而与杂质分离,分离效果较好,但耗时长;核酸酶消化法将长链的残留核酸消化降解为小的片段,从而能在HPSEC检测中后出峰,不影响146S的特征峰,处理速度快且操作简单、条件温和、无抗原损失。最终对确定的最优酶处理条件的适用性、准确性及重复性进行了验证。通过建立的口蹄疫疫苗样品的处理方法,解决了部分口蹄疫灭活病毒疫苗中杂质含量高、难以定量分析的问题,提高了HPSEC检测方法的适用性,保证了HPSEC法在口蹄疫疫苗质量控制、降低生物安全风险、提高环保效益等方面的应用前景。
[1] Li ZY, Liu JX. The current state of vaccines used in the field for foot and mouth disease virus in China. Expert Rev Vaccines, 2011, 10(1): 13–15.
[2] Paprocka G. Foot-and-mouth disease vaccines. Med Weter, 2013, 69(11): 643–648.
[3] Cao YM. Adjuvants for foot-and-mouth disease virus vaccines: recent progress. Expert Rev Vaccines, 2014, 13(11): 1377–1385.
[4] Garcia-Cañas V, Lorbetskie B, Girard M. Rapid and selective characterization of influenza virus constituents in monovalent and multivalent preparations using non-porous reversed-phase high performance liquid chromatography columns. J Chromatogr A, 2006, 1123(2): 225–232.
[5] Metz B, van den Dobbelsteen G, van Els C, et al. Quality-control issues and approaches in vaccine development. Expert Rev Vaccines, 2009, 8(2): 227–238.
[6] Dong JJ, Wang F, Chen MM, et al. Overview of detection methods of 146S content in foot-and-mouth disease inactivated vaccine. Shandong J Anim Sci Vet Med, 2017, 38(10): 78–79 (in Chinese). 董金杰, 王凡, 陈苗苗, 等. 口蹄疫灭活疫苗146S含量检测方法概述. 山东畜牧兽医, 2017, 38(10): 78–79.
[7] Barteling SJ, Meloen RH. A simple method for the quantification of 140 s particles of foot-and-mouth disease virus (FMDV). Arch Gesamte Virusforsch, 1974, 45(4): 362–364.
[8] Spitteler MA, Fernández I, Schabes E, et al. Foot and mouth disease (FMD) virus: quantification of whole virus particles during the vaccine manufacturing process by size exclusion chromatography. Vaccine, 2011, 29(41): 7182–7187.
[9] Yang YL, Li H, Li ZJ, et al. Size-exclusion HPLC provides a simple, rapid, and versatile alternative method for quality control of vaccines by characterizing the assembly of antigens. Vaccine, 2015, 33(9): 1143–1150.
[10] Steppert P, Burgstaller D, Klausberger M, et al. Purification of HIV-1 gag virus-like particles and separation of other extracellular particles. J Chromatogr A, 2016, 1455: 93–101.
[11] Michel PO, Mäkelä AR, Korhonen E, et al. Purification and analysis of polyhistidine-tagged human parvovirus B19 VP1 and VP2 expressed in insect cells. J Virol Methods, 2008, 152(1/2): 1–5.
[12] Yap WB, Tey BT, Ng MYT, et al. N-terminally His-tagged hepatitis B core antigens: construction, expression, purification and antigenicity. J Virol Methods, 2009, 160(1/2): 125–131.
[13] Harmsen MM, Fijten HPD, Westra DF, et al. Effect of thiomersal on dissociation of intact (146S) foot-and-mouth disease virions into 12S particles as assessed by novel ELISAs specific for either 146S or 12S particles. Vaccine, 2011, 29(15): 2682–2690.
[14] Harmsen MM, Fijten HPD, Westra DF, et al. Stabilizing effects of excipients on dissociation of intact (146S) foot-and-mouth disease virions into 12S particles during storage as oil-emulsion vaccine. Vaccine, 2015, 33(21): 2477–2484.
[15] Vajda J, Weber D, Brekel D, et al. Size distribution analysis of influenza virus particles using size exclusion chromatography. J Chromatogr A, 2016, 1465: 117–125.
[16] Effio CL, Oelmeier SA, Hubbuch J. High-throughput characterization of virus-like particles by interlaced size-exclusion chromatography. Vaccine, 2016, 34(10): 1259–1267.
[17] Tassi M, De Vos J, Chatterjee S, et al. Advances in native high-performance liquid chromatography and intact mass spectrometry for the characterization of biopharmaceutical products. J Sep Sci, 2018, 41(1): 125–144.
[18] Yang YL, Zhao QZ, Li ZJ, et al. Stabilization study of inactivated foot and mouth disease virus vaccine by size-exclusion HPLC and differential scanning calorimetry. Vaccine, 2017, 35(18): 2413–2419.
[19] Xu Y, Zou XQ, Li C, et al. Using size-exclusion chromatography to quantify the 146S antigen in inactivated foot-and-mouth disease vaccine. Chin J Biotech, 2018, 34(5): 676–684 (in Chinese). 徐嫄, 邹兴启, 李翠, 等. 应用体积排阻色谱法测定口蹄疫灭活疫苗中的146S抗原含量. 生物工程学报, 2018, 34(5): 676–684.
[20] Xu Y, Zou XQ, Liu XD, et al. Using high performance size exclusion chromatography to determine antigen (146S) content in foot-and-mouth disease inactivated vaccine of quality supervision. Chin J Vet Drug, 2018, 52(1): 7–12 (in Chinese). 徐嫄, 邹兴启, 刘晓东, 等. 应用高效体积排阻色谱法测定市场抽检口蹄疫灭活疫苗中的抗原(146S)含量. 中国兽药杂志, 2018, 52(1): 7–12.
[21] Li H, Yang YL, Zhang Y, et al. A hydrophobic interaction chromatography strategy for purification of inactivated foot-and-mouth disease virus. Protein Expr Purif, 2015, 113: 23–29.
[22] Raines RT. Ribonuclease A. Chem Rev, 1998, 98(3): 1045–1066.
[23] Xu GF, Geng XL, Song SH, et al. Optimization of condition for removal of Vero cell DNA in influenza H5N1 vaccine with Benzonase nuclease. Chin J Biol, 2017, 30(5): 540–545 (in Chinese). 徐国峰, 耿兴良, 宋绍辉, 等. Benzonase酶去除流感疫苗中Vero细胞DNA条件的优化. 中国生物制品学杂志, 2017, 30(5): 540–545.
[24] Doel TR, Baccarini PJ. Thermal stability of foot-and-mouth disease virus. Arch Virol, 1981, 70(1): 21–32.
[25] Brown F, Cartwright B. Dissociation of foot-and- mouth disease virus into its nucleic acid and protein components. Nature, 1961, 192(4808): 1163–1164.
[26] Doel TR, Chong WKT. Comparative immunogenicity of 146S, 75S and 12S particles of foot-and-mouth disease virus. Arch Virol, 1982, 73(2): 185–191.
Vaccine pretreatment for quantification of 146S antigen in foot-and-mouth disease vaccines by high performance size exclusion chromatography
Yanmin Song1,2, Yanli Yang1, Zhiguo Su1, Lili Liu1, Yuanyuan Zhu3, Yuan Xu3, Xingqi Zou3, Qizu Zhao3, and Songping Zhang1
1 State Key Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China 2 School of Chemical Engineering, University of Chinese Academy of Sciences, Beijing 100049, China 3 China Institute of Veterinary Drug Control, Beijing 100081, China
We developed a pre-treatment method to remove interfering substances during quantification of 146S antigens in foot-and-mouth disease (FMD) vaccines by high performance size exclusion chromatography (HPSEC). Three methods, including ultracentrifugation, PEG precipitation and nuclease digestion, were optimized and compared for removal efficiency of the interfering impurities in FMD vaccines. Under optimized conditions, the 146S contents in two batches of FMD vaccines were determined to be 7.1 and 7.6 μg/mL by ultracentrifugation, 9.7 and 10.4 μg/mL by PEG precipitation, and 10.5 and 10.4 μg/mL by nuclease digestion. The optimal condition for nuclease digestion using Benzonase determined by response surface method was as follows: appending Benzonase into 200 μL of antigen phase to a final concentration of 421 U/mL and incubating at 25.1 °C for 1.29 h. This method has advantages including efficient removal of the interfering impurities, fast processing speed, and mild operating conditions. Then 12 bathes of FMD vaccines with different serotypes produced by 4 manufacturers were tested to verify the established treatment method. Results showed the method was applicable to various FMD vaccines with good reproducibility (<5.3%,=3). The developed method removed interference from impurities during quantification of 146S, and therefore would broaden the application of HPSEC in vaccine quality control and ensure the accuracy and reliability.
size exclusion chromatography, foot-and-mouth disease vaccine, 146S, quantification, enzymatic digestion
January 24, 2019;
March 11, 2019
Supported by: National Natural Science Foundation of China (Nos. 21808226, 21821005).
Songping Zhang. Tel/Fax: +86-10-82544958; E-mail: spzhang@ipe.ac.cn
国家自然科学基金 (Nos. 21808226,21821005) 资助。

宋艳民, 杨延丽, 苏志国, 等. 高效体积排阻色谱法定量检测口蹄疫疫苗中146S的疫苗预处理方法. 生物工程学报, 2019, 35(8): 1441–1452.Song YM, Yang YL, Su ZG, et al. Vaccine pretreatment for quantification of 146S antigen in foot-and-mouth disease vaccines by high performance size exclusion chromatography. Chin J Biotech, 2019, 35(8): 1441–1452.
(本文责编 陈宏宇)
