外源性cAMP对糙皮侧耳原基形成的影响
2019-08-27张梦珂戚元成邱立友申进文
张梦珂 戚元成 文 晴 邱立友 申进文
(河南农业大学生命科学学院,河南郑州450002)
糙皮侧耳(Pleurotus ostreatus),又称平菇,广泛分布于世界各地,其肉质肥厚、味道鲜美,具有较高的营养价值和药用价值[1]。平菇经担孢子萌发形成单核菌丝,单核菌丝接合而成双核菌丝,当环境条件适宜时,双核菌丝扭结形成原基进而发育成熟形成子实体[2-3]。糙皮侧耳双核菌丝诱发形成原基进而发育成熟为子实体受到各种环境因素的影响,如光、温度、湿度、二氧化碳[4]和培养料碳氮比,这些条件共同作用诱导菌丝体形成原基发育成子实体,但原基诱发和子实体的发育机制还没有得到完全解析。
环磷酸腺苷(cAMP)作为信号转导途径中的“第二信使”[5],在原核及真核细胞中均有发现,响应多种胞外刺激,调节生物生长发育[6]。在生物体内,cAMP诱导的真核基因表达与蛋白激酶A(PKA)的激活紧密相关,一方面cAMP水平的升高可以激活PKA,另一方面PKA又可以磷酸化某些特定的转录因子,促进cAMP诱导的基因表达[7]。敲除裂褶菌蛋白激酶A(PKA)和腺苷酸环化酶编码基因,能引起突变株的子实体产量降低或子实体发育异常。cAMP信号涉及真菌的很多细胞过程,如细胞生长、新陈代谢、形态发生、胁迫响应和病原真菌的侵染能力等[8]。在担子菌中,cAMP可以诱导灰盖鬼伞的单核体菌株产生子实体,阻止cAMP的合成延缓双核菌丝体扭结形成原基,以高浓度的葡萄糖抑制cAMP的累积从而抑制原基的产生[9]。研究通过分析外源性cAMP对糙皮侧耳菌丝生长及原基形成的影响,旨在为进一步从分子水平解析糙皮侧耳原基形成过程中cAMP的作用机制提供一定的理论依据。
1 材料与方法
1.1 供试材料
糙皮侧耳新831,由河南农业大学生命科学学院应用真菌实验室保藏。
蔗糖天冬酰胺合成培养基(SA,固体培养基):蔗糖 20 g,天冬酰胺 0.88 g,磷酸二氢铵 2.0 g,L-缬氨酸1.0 g,三水磷酸氢二钾0.224 g,磷酸二氢钾0.803 g,七水硫酸镁0.99 g,氯化钙0.02 g,微量元素溶液5 mL,维生素核苷酸溶液5 mL,琼脂粉20 g,蒸馏水1000 mL。微量元素溶液:七水硫酸锌0.89 g,硫酸锰0.765 g,柠檬酸铁0.73 g,五水硫酸铜0.20 g,蒸馏水1000 mL。维生素核苷酸溶液:腺苷1.60 g,维生素B10.02 g,蒸馏水1000 mL。
1.2 试验方法
1.2.1 不同浓度的cAMP对糙皮侧耳菌丝生长及原基形成的影响
将外源添加药品按添加浓度现用现配,过滤除菌后备用,添加浓度 0mmol/L、0.5mmol/L、1mmol/L、2mmol/L、3mmol/L、4mmol/L、5mmol/L,SA培养基融化冷却到约60℃时,加入相应浓度cAMP混匀后制平板。将活化后的新831菌丝,用打孔器打取直径5 mm的边缘菌丝块,菌丝正面朝上接入制备好的固体平板培养基中央,在25℃恒温培养箱避光培养。待某个处理的菌丝满板时,测定糙皮侧耳菌丝生长速度,随后10℃恒温培养箱光照黑暗交替(8 h光照、16 h黑暗)培养18 d,记录原基形成情况(拍照),并测定相应蛋白浓度。每个浓度10个板,三次重复。
1.2.2 菌丝平均长速的测定
参照1.2.1生物接种方法接种,25℃恒温培养箱避光培养,待某个处理的菌丝满板时即结束培养。通过十字交叉法测定菌丝生长长度(mm),并计算出菌丝平均生长速度。
菌丝平均生长速度(mm/d)=菌丝生长长度(mm)/培养天数(d)
1.2.3 蛋白浓度的测定
蛋白含量测定原理:蛋白质中的碱性氨基酸和芳香族氨基酸可与考马斯亮蓝G250染料结合,使考马斯亮蓝G250染色液由黑棕色变为蓝色,并且生成的蓝色产物在595 nm处有最大吸收峰值。因此,通过测定反应液的OD595值,并带入蛋白浓度标准曲线即可计算出溶液中的蛋白浓度。
(1)蛋白浓度标准曲线的制作方法:根据蛋白浓度测定试剂盒(碧云天)的操作说明测定不同蛋白浓度下的OD595值,如表1所示。
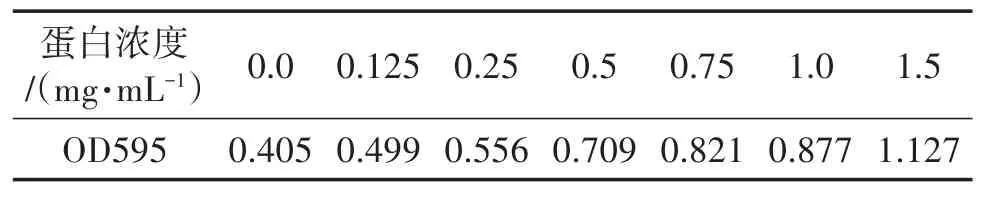
表1 蛋白浓度标准曲线绘制
(2)蛋白浓度测定方法:取5 μL待测液至酶标管内,之后加入200 μL考马斯亮蓝G250染色液,室温放置10 min,测定OD595值。将OD595值代入蛋白标准曲线所示标准曲线公式中,计算出待测液中的蛋白浓度。
1.2.4 cAMP对糙皮侧耳PKAC-1和PKAC-2基因表达量的影响
根据上述试验结果,选取cAMP1mmol/L的添加浓度制备平板,同时把cAMP 0mmol/L作为空白对照,将糙皮侧耳新831接种于平板中央。培养条件:25℃恒温培养箱避光培养,待菌丝满板,随后10℃恒温培养箱光照黑暗交替(8 h光照、16 h黑暗)培养4 d、8 d、12 d、16 d、20 d,每个培养时间3个板,三次重复。Trizol法提取不同时间总RNA,取1 μg总RNA样品,参照RevertAid First Strand cDNA Synthesis Kit说明合成cDNA的第一条链,选取糙皮侧耳actin为内参基因,参照AceQ qPCR SYBR Green Master Mix说明,实时荧光定量分析在不同培养时间添加cAMP与空白对照组糙皮侧耳PKAC-1和PKAC-2的差异表达。qRT-PCR反应体系为:10 μL SYBR Green Master Mix,上下游引物各0.8 μL(10 μmol/L),1 μLcDNA,7.4 μL ddH2O。循环参数设定为:95℃预变性3 min;95℃30 s,60℃25 s,共40个循环,3次重复。反应在applied 7500实时荧光定量PCR仪上进行,利用2-ΔΔCT的方法计算目的基因相对表达量。试验所需引物如下:PKAC-1荧光定量-F TCTGTCGATCCCCAAATGCC,PKAC-1荧光定量-R GCGTACCCTTGACCTCGAAA,PKAC-2荧光定量-FATTGTTCACGCTGCTACGGA,PKAC-2荧光定量-RTCAGGCTTGAGGTCCCGATA。
试验数据用SPSS 16.0统计分析软件进行单因素方差分析(LSD,P<0.05)。
2 结果与分析
2.1 不同浓度cAMP对糙皮侧耳(新831)菌丝长速的影响
不同cAMP浓度对糙皮侧耳菌丝平均长速的影响见图1。在测试浓度范围内,随着cAMP浓度的增加,糙皮侧耳菌丝平均长速先快后慢,cAMP添加浓度为1 mmol/L时菌丝平均长速达到最大值,cAMP添加浓度为1 mmol/L、2 mmol/L、3 mmol/L能显著提高糙皮侧耳菌丝平均生长速度(P<0.05),添加cAMP浓度继续升高,对菌丝生长出现抑制作用,但抑制效果不显著。
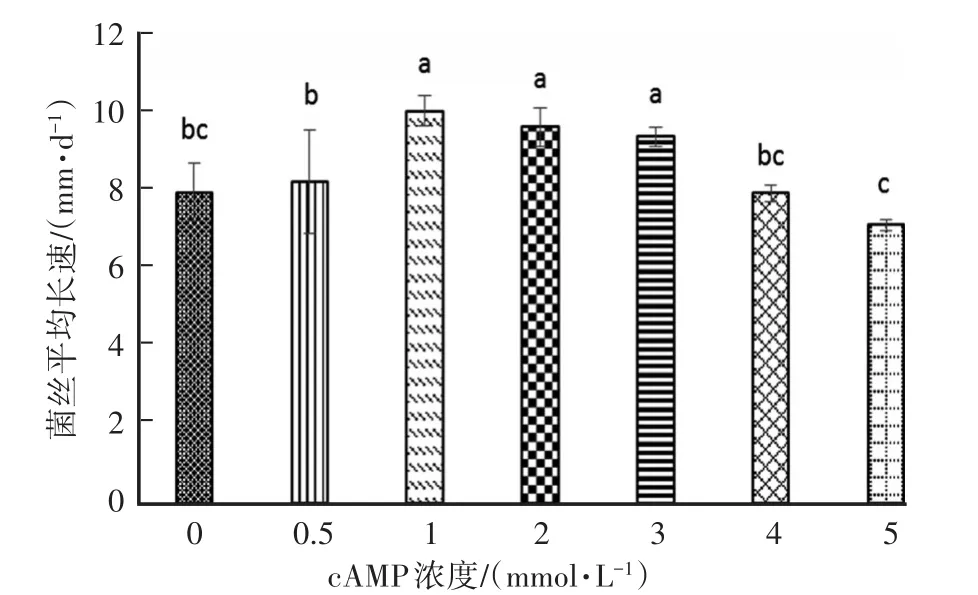
图1 不同浓度cAMP对糙皮侧耳(新831)菌丝长速的影响
2.2 不同浓度cAMP对糙皮侧耳(新831)原基形成的影响
不同cAMP浓度对糙皮侧耳(新831)菌丝原基形成的影响见图2。10℃恒温培养箱光照黑暗交替(8 h光照、16 h黑暗)培养18 d后,未添加cAMP的空白对照组,未见原基形成;cAMP添加浓度为1 mmol/L时明显可见原基形成;添加浓度为2 mmol/L、3 mmol/L、4 mmol/L时,平板中可见菌丝扭结,且随着添加浓度的升高,菌丝扭结越少;其他cAMP添加浓度与对照组没有差异。

图2 不同浓度cAMP对糙皮侧耳(新831)菌丝原基形成的影响
2.3 不同浓度cAMP对糙皮侧耳(新831)菌丝蛋白含量的影响
将上述1.2.1所得添加不同浓度cAMP培养基培养菌丝,按照蛋白浓度测定方法,测定菌丝蛋白含量。结果表明,在试验浓度范围内,与空白对照组相比,cAMP显著降低糙皮侧耳菌丝的蛋白含量(P<0.05);cAMP添加浓度为1 mmol/L时,菌丝蛋白含量最低;cAMP添加浓度为2 mmol/L、3 mmol/L、4 mmol/L、5 mmol/L时,菌丝蛋白含量略微提高,但仍显著低于空白对照组(P<0.05)(图3)。

图3 不同浓度cAMP对糙皮侧耳(新831)菌丝蛋白含量的影响
2.4 外源性cAMP对糙皮侧耳(新831)PKAC-1和PKAC-2表达量的影响
由图4可见,与对照组相比PKAC-1相对表达量整体下调,其中培养4 d后PKAC-1相对表达量下调显著(P<0.05),其他与对照组之间不存在显著性差异;培养时间8 d、12 d、20 d时,加cAMP组与不加cAMP相比PKAC-2的相对表达量整体上调,且在培养12 d时cAMP显著提高PKAC-2的相对表达量(P<0.05)。

图4cAMP对PKAC-1、PKAC-2相对表达量的影响
3 小结与讨论
研究结果表明,cAMP对糙皮侧耳(新831)菌丝生长影响显著,适宜浓度的外源cAMP显著促进糙皮侧耳菌丝生长,但高浓度的外源cAMP抑制菌丝生长,cAMP对糙皮侧耳菌丝生长的影响与对其他一些真菌的效应相同。2007年,HU等发现较高浓度的外源cAMP抑制水稻纹枯病菌Rhizoctonia solani AG-1IA分离物的菌丝生长[10]。OLIVER等2002年发现高浓度的外源cAMP抑制致病真菌烟曲霉Aspergillus fumigatus的菌丝生长[11]。
cAMP添加浓度1 mmol/L能显著缩短光诱导糙皮侧耳(新831)原基形成所需时间。绿色木霉中的光诱导伴随着细胞内cAMP水平的突然短暂升高[12],磷酸二酯酶抑制剂对光诱导的分生孢子形成有促进作用[13]。1998年,NEMCOVIC等发现cAMP在调节木霉菌分生孢子形成过程中起着关键作用[14]。对白色念珠菌的研究发现,刺激腺苷酸环化酶生成cAMP能诱导其菌丝形态发育,腺苷酸环化酶等位基因极度活跃或外源cAMP的添加能促进白色念珠菌菌丝发育[15],而腺苷酸环化酶缺失菌株(cyr1△)在菌丝发育方面存在缺陷[16],说明cAMP对于白色念珠菌的菌丝发育必不可少[17]。
2006年,ALFREDO等对绿色木霉的研究发现,在绿色木霉的分生孢子形成过程伴随着PKA活性的升高[18]。实时荧光定量PCR分析cAMP添加后糙皮侧耳(新831)PKAC-1和PKAC-2基因在不同培养时间的差异表达结果表明,添加cAMP对糙皮侧耳PKAC-1和PKAC-2基因的表达量有一定影响,处理组与对照组相比,PKAC-1表达量差异不显著,但PKAC-2表达量在培养12 d时显著上调,表明cAMP可能通过上调PKAC-2基因的表达量来提高蛋白激酶活性,从而加速原基形成。
添加外源cAMP对糙皮侧耳原基的形成可能起到了一定作用,研究结果对探究糙皮侧耳原基形成的分子机制提供了一定的理论基础。
