水稻育性调控的分子遗传研究进展
2019-08-26谢勇尧汤金涛杨博文胡骏刘耀光陈乐天
谢勇尧,汤金涛,杨博文,胡骏,刘耀光,陈乐天
水稻育性调控的分子遗传研究进展
谢勇尧1,汤金涛1,杨博文1,胡骏2,刘耀光1,陈乐天1
1. 华南农业大学生命科学学院,亚热带农业生物资源保护与利用重点实验室,广州 510642 2. 武汉大学生命科学学院,杂交水稻国家重点实验室,武汉 430072
杂交水稻为世界粮食安全做出了重要贡献。细胞质雄性不育和光/温敏不育分别是三系和两系杂交稻生产利用的遗传基础,而(亚)种间杂种不育则是杂交稻生产中要克服的主要技术瓶颈。因此,水稻育性调控是杂交水稻生产技术的关键,也是研究植物核质互作和物种生殖隔离等基础科学问题的重要模型。我国植物遗传学家在阐明杂交水稻育性调控的分子遗传基础领域做出了重要贡献。本文回顾了我国杂交水稻的发展历程,系统总结了杂交水稻生产涉及的细胞质雄性不育与恢复、光/温敏不育与育性转换、杂种不育与亲和性的遗传基础和分子作用机制,探讨了我国杂交水稻生产存在的问题,指明了水稻杂种优势利用的发展方向。
杂交稻;细胞质雄性不育;杂种不育;光/温敏不育;育性恢复
水稻(L.)是全球近50%人口及我国65%以上人口的主粮,随着人口增加与耕地面积减少的矛盾日益突出,提高水稻产量对保障全球粮食安全具有重要意义[1]。矮杆育种和杂种优势利用是水稻育种史上的两次重要的飞跃。在这两次飞跃中,我国的植物遗传学家发挥了非常重要的作用。
1956年,我国作物遗传育种学家黄耀祥院士以“矮仔占”为原始材料,筛选出“矮仔占4号”,然后与高秆品种“广场13”杂交,培育出第一个矮秆籼稻品种“广场矮”[2]。这一研究成果极大地推动了我国水稻育种的第一次“绿色革命”。1970年,袁隆平院士团队率先发现了花粉败育完全的野生稻,简称为野败[3]。经过全国大协作,成功地将这一创新性发现应用到三系杂交稻育种[3]。我国自主研发的杂交稻一直处于世界领先水平,为世界粮食生产做出了重大贡献,是我国育种史上的第二次重要飞跃[4]。
杂交水稻育种经历了三系杂交稻育种和两系杂交稻育种,目前正向一系杂交稻育种迈进(图1)。目前杂交稻利用主要依赖于亚种内杂种优势的利用,由于亚种内遗传差异小,杂种优势弱,利用潜力已经达到极限,难创新高,亟需利用遗传差异更大的(亚)种间的杂种优势利用来进一步提高粮食产量[5]。但(亚)种间存在严重的杂种不育现象(即杂种不能正常结实,导致杂种的产量优势无法体现),从而严重限制了(亚)种间的强优势的利用。
因此,阐明三系杂交稻涉及的细胞质雄性不育与恢复、两系杂交稻涉及的光/温敏不育与育性转换和远缘杂种优势利用涉及的(亚)种间杂种不育与亲和的分子遗传基础,具有重要的生产价值和理论意义。为此,本文回顾了我国杂交水稻的发展现状及其研究历史,总结了杂交水稻育性控制的分子遗传基础,展望了杂交稻的发展前景,以期为我国水稻杂交育种突破瓶颈提供新思路。
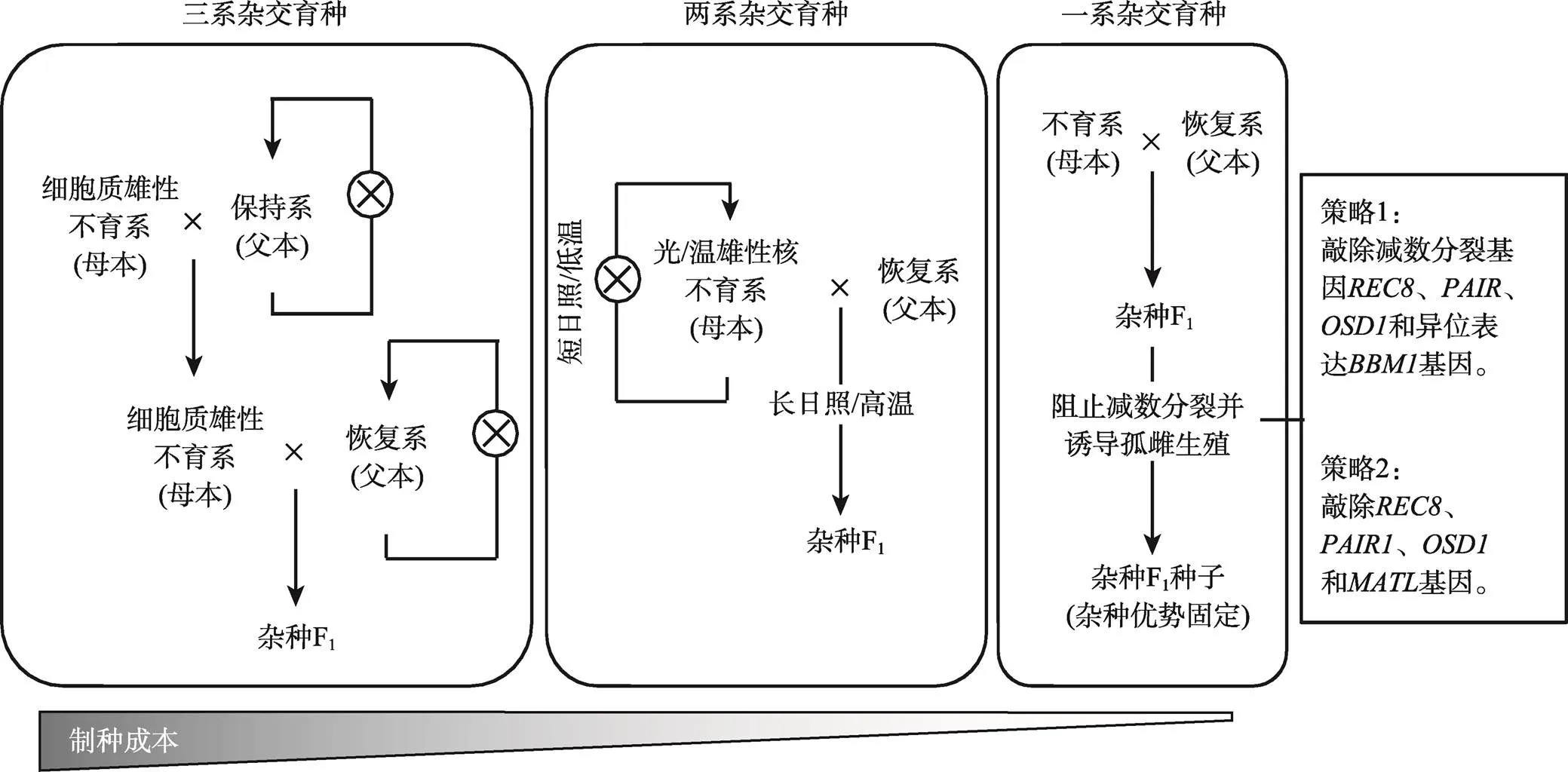
图1 杂交水稻育种体系的发展阶段
杂交水稻育种体系分为三系、两系、一系3个发展阶段。三系杂交育种体系由保持系、细胞质雄性不育系和恢复系组成。保持系和恢复系能够通过自交进行扩繁,而细胞质雄性不育系通过与保持系杂交进行繁种,不育系与恢复系杂交获得杂种F1。两系杂交育种体系由光/温敏不育系和恢复系组成。光/温敏不育系在短日照或低温条件下可育,能自交繁殖;在长日照或高温条件下不育,与恢复系杂交获得杂种F1。一系杂交育种体系则是通过杂种F1的无融合生殖,实现持续繁殖杂交种,固定杂种优势。
1 三系杂交稻涉及的细胞质雄性不育与育性恢复的分子遗传基础
1.1 三系杂交稻简介
杂种优势是指杂种F1在生长势、生物量和生长速度等方面优于双亲的现象[6]。我国杂交水稻育种始于1964年,袁隆平院士[7]率先提出水稻杂种优势利用的概念。“三系”育种正式拉开了水稻杂种优势利用的序幕。该育种体系由3个遗传育种材料系构成,分别为不育系、保持系和恢复系(图1)[8]。细胞质雄性不育系带有细胞质雄性不育基因,但不携带功能性核恢复基因,因此花粉表现为不育,无法自交产生后代;但其雌性器官不受影响,柱头可以接受保持系或恢复系的花粉产生杂交后代。保持系既不携带细胞质雄性不育基因,也不携带功能性恢复基因,其花粉表现为可育。保持系与不育系的杂种后代能够维持细胞质雄性不育的特性,从而达到繁殖不育系的目的。恢复系含有功能性核恢复基因,能够恢复不育系的育性,且与不育系存在一定的遗传差异,用于生产具有杂种优势的杂交种子[8]。因此,解析细胞质雄性不育和育性恢复的分子基础有利于了解三系杂交稻育性调控制的基础,并以此推动三系杂交稻的升级改造。
三系育种中,水稻细胞质雄性不育系的发现与利用是三系杂交稻的杂种优势应用的基础,对粮食安全具有划时代的意义[9]。目前,野败型细胞质雄性不育(wild-abortive type cytoplasmic male sterility, CMS-WA)、包台型细胞质雄性不育(BoroⅡtype CMS, CMS-BT)和红莲型细胞质雄性不育(Hong-Lian type CMS, CMS-HL)是应用于三系杂交稻的3大细胞质雄性不育系。其中,CMS-WA和CMS-HL是由我国科学家袁隆平院士团队和朱英国院士团队独立发掘的种质资源[3]。这些不育系已经推广应用了几十年,但长期以来关于它们的育性控制分子机制仍不清楚。直到近10多年,我国植物遗传学家才一一揭开了谜底,为阐明控制三大不育系的不育与恢复分子机制做出了突出贡献。
1.2 细胞质雄性不育发生的假说及其分子基础
细胞质雄性不育基因的克隆与功能分析是阐明其不育分子基础的关键。经过多年的努力,我国科学家们克隆了这3大类细胞质雄性不育系的不育基因,提出了多种导致细胞质雄性不育的作用机制假说。
1.2.1 PCD提前发生假说
绒毡层的正常发育对花粉发育非常重要,其提前或延后降解都会影响植株的花粉育性[10]。细胞质雄性不育基因导致植株绒毡层的程序性细胞死亡(programmed cell death, PCD)提前发生的现象首次在向日葵()中被发现[11]。Luo等[12]发现水稻CMS-WA的不育基因也能导致绒毡层的PCD提前发生,从而使得花粉败育,并阐明了其产生的分子机制。
1970年,袁隆平院士团队率先发现了CMS-WA不育株;1973年,颜龙安院士团队将CMS-WA型细胞质雄性不育材料育成实用性不育株系珍汕97A (ZS97A),并于1976年开始推广应用CMS-WA三系杂交稻。CMS- WA不育系的花粉呈现典型不规则形状,且不积累淀粉;在遗传上,其不育特性受母体细胞质基因控制。CMS-WA不育系在生产上推广了将近20多年后,其控制基因仍未被克隆。直到2002年,水稻线粒体基因组测序完成[13],Liu等[14]利用该序列信息,采取线粒体全基因组差异比较策略,对野败不育系ZS97A及其保持系的mtDNA进行结构与表达分析,发现在不育系中存在2个特异转录本。Luo等[12]进一步研究发现,其中一个转录本为嵌合基因编码的蛋白产物,含有352个氨基酸,命名为,是引起CMS-WA不育系花粉败育的基因;的表达呈现为组成型,但其编码的蛋白在小孢子母细胞期的花药绒毡层中特异积累;WA352蛋白属于典型的跨膜蛋白,其跨膜区对大肠杆菌能够产生毒性,但该区段并不能引起雄性不育;WA352蛋白通过与核编码蛋白COX11 (细胞色素C氧化酶的组装因子)互作,抑制COX11清除活性氧(reactive oxygen species, ROS)的功能,而导致了花药绒毡层细胞内ROS异常积累,进而引起PCD提前发生,最终导致雄性不育。
1.2.2 细胞质蛋白毒性假说
1988年,Dewey等[15]发现玉米(L.)细胞质雄性不育基因编码细胞毒素能引起花粉败育,首次提出了线粒体异常基因编码细胞毒素的假说。Wang等[16]发现CMS-BT的不育机制符合这一假说。
CMS-BT不育系由日本学者新城长友(Chou Shinjyo)[17]于1966年以印度籼稻Chinsurah BoroⅡ为母本,与粳稻台中65杂交,并经过连续回交而育成的水稻细胞质雄性不育类,但由于其配合力及杂种优势不强等因素导致其没有得到广泛的应用。Wang等[16]发现,BT型系统的不育系中,下游存在一个基因—,该基因编码一个含有79个氨基酸的细胞毒素蛋白。该基因的功能互补转基因植株的花粉为配子体不育,证明就是BT型细胞质雄性不育基因。编码的细胞毒素对细菌具有致死的效应,并能在花药小孢子中特异积累,导致携带的花粉败育。
1.2.3 能量供给紊乱假说
2003年,Sabar等[18]发现在向日葵细胞质雄性不育系中,线粒体异常的读码框(open reading frame, ORF)会导致不育系的能量供给出现紊乱的现象。Wang等[19]发现CMS-HL的不育基因也导致不育系的能量供给出现紊乱,从而揭示其CMS发生的分子机制。
水稻CMS-HL是朱英国院士团队于1974年利用海南红芒野生稻为母本,以籼稻莲塘早为父本育成。通过比较红莲型不育系粤泰A和其保持系粤泰B的线粒体基因组序列,发现在下游214 bp处存在一个与CMS相关的开放阅读框,与序列相比,两者高度同源,在编码区只存在5个SNP差异,从而导致4个氨基酸发生改变[20]。Peng等[21]通过遗传转化,证明就是CMS-HL的不育基因。Wang等[19]研究发现,ORFH79能够使得不育系的能量供给产生紊乱的现象;进一步研究发现,ORFH79通过与电子传递链复合体Ⅲ的一个亚基P61互作,影响复合体Ⅲ的酶活性,从而引起能量供给紊乱和ROS爆发,最终导致花粉败育。
1.3 细胞质雄性不育育性恢复的分子基础
三系杂交稻恢复系恢复基因的克隆与功能分析是阐明其恢复育性分子基础的关键。同样,我国科学家们为克隆三大类细胞质雄性不育的恢复基因也做出了巨大贡献。已克隆的水稻细胞质雄性恢复基因大部分编码PPR(pentatricopeptide repeat)蛋白,对细胞质雄性不育基因的调控主要体现在转录后水平的调控。
CMS-WA不育系的育性恢复受到两个主效的核基因座位控制,分别是位于第10染色体上的座位和位于第1染色体上的座位。编码一个包含782个氨基酸的PPR蛋白,能够将的mRNA水平降低到不育系的20%左右,从而抑制细胞质雄性不育[12,22]。而则在蛋白水平调控WA352蛋白的积累[12]。
CMS-BT不育系的育性恢复基因和都编码N端具有线粒体定位信号的PPR蛋白[16]。RF1a直接参与不育基因转录本的加工,将其剪切成1.5 kb和0.45 kb的2个片段;是在不存在的情况下介导不育基因相关转录本的完全降解。这两种作用的结果都导致不育基因的转录后基因的沉默,从而恢复花粉发育。在和共同存在的情况下,具有上位性效应,不能进一步作用于被介导切断的mRNA片段[16]。
CMS-HL育性恢复基因和也编码PPR蛋白。与CMS-BT的恢复基因是同一个基因,但其对的作用机理有所不同。RF5在辅助因子GRP162的帮助下结合到红莲型的不育基因转录本,进一步在RFC3等蛋白的帮助完成对转录本的切割,使花粉恢复育性[23]。RF6蛋白与OsHXK6结合,促进不育转录本在新位点进行加工剪切,从而恢复育性[24]。此外,不仅参与CMS-HL的育性恢复,同时也参与CMS-BT的育性恢复。
2 两系杂交稻涉及的温敏不育与育性转换的分子遗传基础
2.1 两系杂交稻的发展现状
在三系杂交水稻育种刚刚起步之时,两系杂交水稻育种也紧随其后。1973年,我国育种家石明 松[25]在粳稻品种农垦58中发现了一个光温敏不育株,这一开创性发现正式拉开了我国两系杂交水稻育种的序幕。随后,我国育种家邓华凤等[26]培育了籼型温敏不育系安农S,极大推动了我国籼型两系杂交育种的进程。两系育种系统中含有两个品系:光/温敏不育系和恢复系(图1)。光/温敏不育系受光/温调控具有可育与不育的两面性,在短日照(或低温)条件下,表现为正常可育,在长日照(或高温)条件下,表现为不育[8]。根据这一特性,该不育系在不育时用于制种,在可育时用于自身繁种。而两系中的另一品系为恢复系,用于与不育系进行制种。两系法进一步扩大了育种的配组限制,提高了杂交育种的遗传多样性。
近年来,我国科学家克隆了控制两大光温敏不育系的育性相关基因,阐明了非编码RNA介导光温敏不育和编码蛋白的功能缺失介导的光温敏不育的分子机制。
2.2 非编码RNA介导的光温敏不育的分子遗传基础
农垦58S的光温敏不育特性在粳稻农垦58的背景下单位点隐性的自然突变所致,通过日长处理实验发现,其不育特性主要与光照长短有关。利用农垦58S与不同籼稻的杂交,发现农垦58S的不育特性在不同遗传背景下,受到两个位点(显性,定位在7号染色体)和(隐性,定位在12号染色体)共同控制[27]。进一步研究发现,和编码两个非编码的RNA,参与调控农垦58S的光温敏不育特性。
是农垦58S原始的自发突变位点,其编码的非编码RNA在农垦58和农垦58S之间只存在一个碱基差异(C>G)[28]。该突变可能改变了非编码RNA二级结构,从而使得非编码RNA基因的启动子区甲基化水平提高,导致基因表达水平低而引起不育[28]。与此同时,控制籼稻培矮64S温敏不育特性的基因/也被克隆,该基因实际就是[29]。有趣的是,/()在籼稻背景下主要表现为温敏不育,不同于在粳稻农垦58S中的光敏不育表型。Zhou等[29]发现,该SNP(C>G)位于一个21nt小RNA— osa-smR5864第11位碱基处。野生型osa-smR5864w能够抑制下游基因的表达,而突变型osa-smR5864m丧失了抑制功能,最终导致了光温敏不育。
农垦58S的编码一个长链非编码RNA[30]。该RNA能够被长度为22nt microRNA—识别,降解成18对长度为21nt的phasiRNA。其中1对phasiRNA含有能够引起功能变异的SNP位点,暗示该phasiRNA的调控下游的能力在不同亲本存在差异,从而参与调控光敏不育[30]。
这些非编码RNA调控植物环境依赖育性的研究不仅拓宽了人们对环境依赖育性调控的分子机制,也阐明了非编码RNA在调控植株发育的广泛意义。
2.3 编码蛋白介导光温敏不育的分子遗传基础
近年来,我国科学家发现一些功能缺失的基因能够产生光温敏不育。这些基因主要通过调控光温诱导有害基因的表达和光温诱导同源基因功能补偿两种机制参与调控光温敏不育。
2.3.1 光温诱导有害蛋白积累的分子机制
温敏不育系安农S-1和株1S广泛运用在籼型两系杂交育种,其温敏特性由单个座位控制[26]。Zhou等[31]发现位点为一个编码核酸酶RNasZS1的基因,由于该基因的一个C>A突变产生了提前终止密码。的mRNA和蛋白水平的表达本身没有温敏性,这暗示不是通过自身的温敏特性来影响育性的。研究发现,在高温条件下编码泛素-60S核糖体蛋白L40的3个基因(Ub1、Ub2和Ub4)的转录本在植株花药中的水平显著高于野生型植株。在野生型植株中超量表达也会产生雄性不育,说明在花药中的高表达会引起雄性不育[31]。体外实验发现,TMS5蛋白能够降解mRNA,说明高温下RNasZS1能将mRNA控制较低水平,而的功能缺失导致丧失了降解mRNA的能力,使高温下过表达,最终导致温敏雄性不育。在较低温度下(23~24℃),温敏不育系的的表达水平较低,因而花药发育正常可育。
2.3.2 光温诱导同源基因功能补偿的分子机制
除了广泛应用的,近年来还克隆了和等光温敏相关基因。基因编码一个R2R3 MYB转录因子,该基因的突变体在短日照条件下不育,长日照条件下可育,表现为反光敏不育性[32]。基因编码一个富含亮氨酸重复的激酶受体,该基因突变能够引起植株高温不育,低温可育[33]。它们都是通过补偿性的光温敏效应来恢复育性的。基因受到短日照条件诱导高表达,基因的同源基因和在长日照条件下高表达,这表明、和在不同日照时长下控制花粉发育过程可能互为补偿关系[32]。基因本身不受温度诱导,但其同源基因在低温下高表达,能够在低温条件补偿的功能,从而恢复植株低温育性[33]。
3 (亚)种间杂交育性控制的分子遗传基础
3.1 (亚)种间杂种优势利用的现状
水稻栽培种分为亚洲栽培稻(L.)和非洲栽培稻(Steud.)两个种,而亚洲栽培稻又分为籼稻(L. subsp.)和粳稻(L. subsp.)两个亚种。目前,三系杂交和两系杂交主要运用籼–籼和粳–粳亚种内的杂种优势利用。水稻(亚)种间如籼–粳、亚–非具有更强的杂种优势,其产量潜力比亚种内杂交稻高15%~30%以上[5]。但由于(亚)种间存在较大的遗传背景差异,存在较为严重的杂种不育现象,远缘杂种不能结实,产量优势无法体现,从而阻碍了(亚)种间杂种优势的利用。
水稻(亚)种间杂种不育位点克隆和分子遗传基础的研究是打破生殖隔离和(亚)种间杂种优势利用的理论和应用基础。水稻杂种不育座位的遗传定位和分子克隆已经取得了一些突破性进展。在水稻中,已经遗传定位的杂种不育座位大约有50个[34,35]。由于杂种不育的遗传复杂性,目前只有11个座位(、、/、/和/)的杂种不育相关基因被克隆[36~49]。
3.2 杂种不育的分子遗传机制
根据这些已克隆杂种不育位点的机制,可以明确3种杂种不育的分子遗传机制:(1)特定配子显性致死的遗传机制;(2)特定配子选择性显性保护的遗传机制;(3)重复隐性致死的遗传机制[50]。
3.2.1 特定配子显性致死的遗传机制
特定配子致死的杂种不育机制是指在杂种中,配子杀手系统能够特定作用于相应的目标因子,从而特异地杀灭相应配子的一种分子机制,如水稻籼粳亚种间杂种不育基因座位和座位的杂种不育分子机制。
座位上是由两个连锁基因和组成的一个复合基因座位[40]。来源于籼稻SaM和SaF共同组成杀手系统,能够特定作用于粳稻靶标基因,从而使得籼粳杂种F1中携带的配子选择性败育[40]。座位在籼粳稻之间的存在基因组结构的变异[43]。粳稻中的座位只有,该基因编码一个含有DUF1618结构域的蛋白,是花粉发育的必需基因;而在籼稻中,与对应的基因由于转座子插入而失活,但其旁侧存在2个或3个约28 kb的大片段串联重复的基因组拷贝(、、和)。值得注意的是,的启动子与启动子序列完全不同,而编码区的序列则高度同源[43]。为二核期花粉特异的低水平表达,而拷贝为组成型高水平表达。在杂种F1中,的表达受到特异性抑制,导致配子败育[43]。这可能是由于组成一个杀手系统能够特异性作用启动子区,从而抑制在花粉中的表达。
3.2.2 特定配子选择性显性保护的遗传机制
选择性保护的杂种不育机制是指在杂种中,配子杀手系统发出不育信号能够无区别地杀灭所有配子,但含有相应保护因子的配子能够抑制这种不育信号,从而能够得到选择性保护此类配子而存活的一种分子机制。
籼粳亚种间杂种不育座位的杀手系统由来源于籼稻和来源于粳稻共同组成,这两个基因的在孢子体的遗传互作能够杀灭雌配子。但籼型雌配子携带了有功能的保护基因,从而抑制该杀灭效应而保护雌配子的正常发育;粳型的雌配子携带的无功能型保护基因不能抑制杀灭效应而导致败育[47]。类似地,亚洲栽培稻与南方野生稻的种间杂种不育座位的杀手基因ORF2在孢子体产生雄配子败育信号,但栽培稻型配子携带的功能保护基因ORF3能够抑制不育效应而存活[48]。
最近,关于亚洲栽培稻与非洲栽培稻(合称“亚非稻”)杂种不育座位的分子机制取得了突破性的进展。研究发现,非洲稻型等位基因座-中存在3个基因—、和,它们的编码蛋白能够形成复合体[44,45]。该复合体在孢子体引发对雌配子和雄配子的不育信号,但同时具有保护配子发育的双重功能。因此,携带的-型配子能够得到保护而选择性存活,而不携带的亚洲稻型-配子(只含有无功能的同源基因)则不被保护而败育[44]。区别于和需要依赖双亲的等位基因互作才能产生杂种不育的分子机制,座位介导的杂种不育是一种新的只依赖于一方亲本(非洲稻型)基因座基因的非对称遗传互作模型。此外,该系统的具有双重功能的特性也不同于和座位的杀手和保护者是完全独立的特性。
3.2.3 重复隐性致死的分子遗传机制
重复隐性致死的杂种不育机制是指易位造成一个配子发育必需基因在不同亲本中位于非同源染色体上,在杂种F1中不携带配子发育必需基因的配子会产生败育的分子机制。水稻杂种不育基因/、/和/均是配子发育的必需基因[41,42,46],由于易位使得配子发育必需基因在亲本间处于非同源染色体。在杂种F1中,同时携带无功能型配子发育必需基因的配子会败育。例如,和是高度保守的基因,编码植物特异的小蛋白,对配子发育都是必需基因[41]。位于1号染色体,籼稻的是无功能的,而粳稻的是有功能的;位于6号染色体,籼稻的是有功能的,粳稻的是无功能的。在杂种F1中,同时携带无功能的和的配子会败育[41]。
3.3 克服杂种不育的方法
研究杂种不育分子机制的一个重要目标是克服杂种不育。目前,克服水稻杂种不育的方法主要有三大类。第一类是由日本科学家Kitamura[51]提出的中性型杂种不育位点的广亲和系策略。即通过广泛的杂交和测交,在自然群体中寻找与籼粳稻杂交均能产生可育杂种的中性广亲和系[51]。但由于有些种间(比如亚非稻之间)的亲缘关系比较远,很难在自然群体中寻找到这种种质资源。第二类是由我国遗传育种家卢永根院士提出的杂种不育位点特异亲和系方法。张桂权等[52]在此理论基础上提出了“粳型亲籼系”育种策略。粳型亲籼系培育就是将籼粳杂种不育的籼型等位基因通过杂交和回交的方法导入到粳稻中,人为创建可以与籼稻亲和的水稻新种质[53,54]。在粳型亲籼系中,杂种不育育性基因与籼稻相同或者相近,除此以外的基因组为粳稻背景,保证粳型亲籼系与籼稻有较大的遗传差异而利用亚种间的杂种优势。另外,水稻育种过程中往往产生一些籼稻中有粳稻血缘和粳稻中有籼稻血缘的“搭桥品种”。通过在这两类“搭桥品种”间大量配组测试,也可能发现一些育性较高(由于各杂种不育座位是同型的),并且杂种优势较强的杂交组合如甬粳2号A[55]。以上方法耗时、耗力,而且不同杂交组合受到的杂种不育位点有所不同,容易产生不稳定的情况。第三种方法是利用最新发展的基因编辑技术来创建人工亲和系。例如,分别敲除和座位的杂种不育相关基因能够快速创建和亲和系;敲减基因的拷贝数也能创建亲和系[43,45,56]。随着越来越多的水稻杂种不育座位相关基因被克隆,利用基因编辑技术快速创建人工亲和系将成为克服远缘杂种不育障碍的主要手段。
4 杂交水稻育性控制未来的研究重点和发展方向
4.1 “三系”的局限性与破解方案
由于CMS-WA的稳定性和适用性,我国三系杂交籼稻的不育系大部分携带CMS-WA细胞质。长期单一的遗传背景存在一些较大的风险,容易引发粮食安全危机。一方面,挖掘更多可用的细胞质雄性不育资源能够提高多样性,但这种育种方法通常需要长时间积累;另一方面,利用先进的生物技术手段,快速创建新型不育系和杂交制种体系,对丰富杂交水稻遗传背景多样性有着重要的意义,是未来杂交水稻的重要的发展方向。例如,利用丰富的孢子体不育突变体种质资源,创建诱导型或智能型不育系[57],可以达到自由配组的目的。智能型不育系的核心是以转基因技术为依托,生产不携带转基因的不育系(图2)。邓兴旺教授团队利用一个无粉型核不育突变体作为受体,转入一个转基因元件含有互补基因、玉米α-amylase配子致死基因、红色荧光素酶基因。其中互补基因用于回补的花药不育表型,α-amylase配子致死基因用于杀死携带转基因的雄配子,红色荧光素酶基因用于筛选不携带转基因的不育系和携带转基因半合体的保持系(图2A)。这种技术能够地利用广泛的核不育突变体的种质,创建广泛的三系杂交稻[57]。
此外,随着社会和经济的发展,我国的农村劳动力逐渐变弱,制种的人工成本逐渐变高,因此机械化制种对降低成本有着重要的作用。通过现代生物技术,创制智能型雌性不育系(可作为雄性不育系的恢复系) (图2B),改变传统杂交育种模式可以实现安全和机械化制种。智能型雌性不育系的应用原理与智能型雄性不育系的应用原理类似(图2B)。制种过程中,利用雌性不育系和雄性不育系进行制种,由于它们自身均不能自交结实,因此可以采取随机箱式种植,能收获到的种子即为可用的杂交种[58],从而减少了传统制种工序和劳动力投入,降低了制种成本。另一方面,挖掘利用新型核不育类型也可以改变当前杂交育种遗传材料同质化现象,降低遗传脆性的风险。
4.2 两系育种存在的风险和解决措施
受到厄尔尼诺现象影响,近年极端天气频繁,容易影响温敏二系杂交稻制种的安全性。一方面挖掘更多的光温相关的不育系种质资源,有利于提供适合在不同环境下的制种或繁种的品系。比如,发掘反温敏不育系(高温可育,低温不育),可以提高其制种的安全性。另外,利用基因编辑技术将一些优良品种中光温敏基因进行定点编辑,能够快速育成耐受不同环境的多品系不育系[59,60]。
4.3 一系法的曙光—创造孤雌生殖系
袁隆平院士曾提出水稻育种方法需要从繁到简,不断提高效率,最终要利用“一系法”将远缘杂种优势固定下来(图1)。一系法是指培育遗传不分离的F1杂交种,其关键的核心技术就是有效地创建不发生减数分裂的孤雌生殖系。孤雌生殖系,又叫无融合生殖系统,是指不发生雌雄配子核融合而产生种子的无性繁殖手段。在杂交种无融合生殖中,大孢子母细胞不经过减数分裂和受精过程产生有活力的后代种子胚,因此不发生性状分离,能实现杂种优势的固定。最近,国内外研究者在无融合生殖的基础理论及实际应用领域取得了重要突破。当前一系法固定杂种优势的技术核心是通过现代生物技术让植株的配子染色体不发生减数分裂而,然后再产生诱导发生孤雌生殖。目前具体的做法有两种:策略一是利用基因编辑技术定点敲除与减数分裂相关的基因如、和,能将减数分裂转变成类似有丝分裂的过程,产生雌性和雄性二倍体配子[61]。同时,在卵细胞中异位表达()基因诱导卵细胞直接发育成胚,这样就可以绕过受精过程产生孤雌生殖,从而完成无融合生殖过程(图1)[62];策略二是利用()基因的突变能够诱导产生单倍体种子的特性[63~65]。因此,同时敲除、、和4个基因,也能获得与杂种亲本完全一致的无融合生殖种子(图1)[66]。这些方法策略虽然让育种家看到了杂种优势固定的曙光,但其育性(结实率)仍很低,且产生的种子胚大部分为四倍体。因此,要实现杂种优势利用的一系法实际应用还存在很大的挑战。
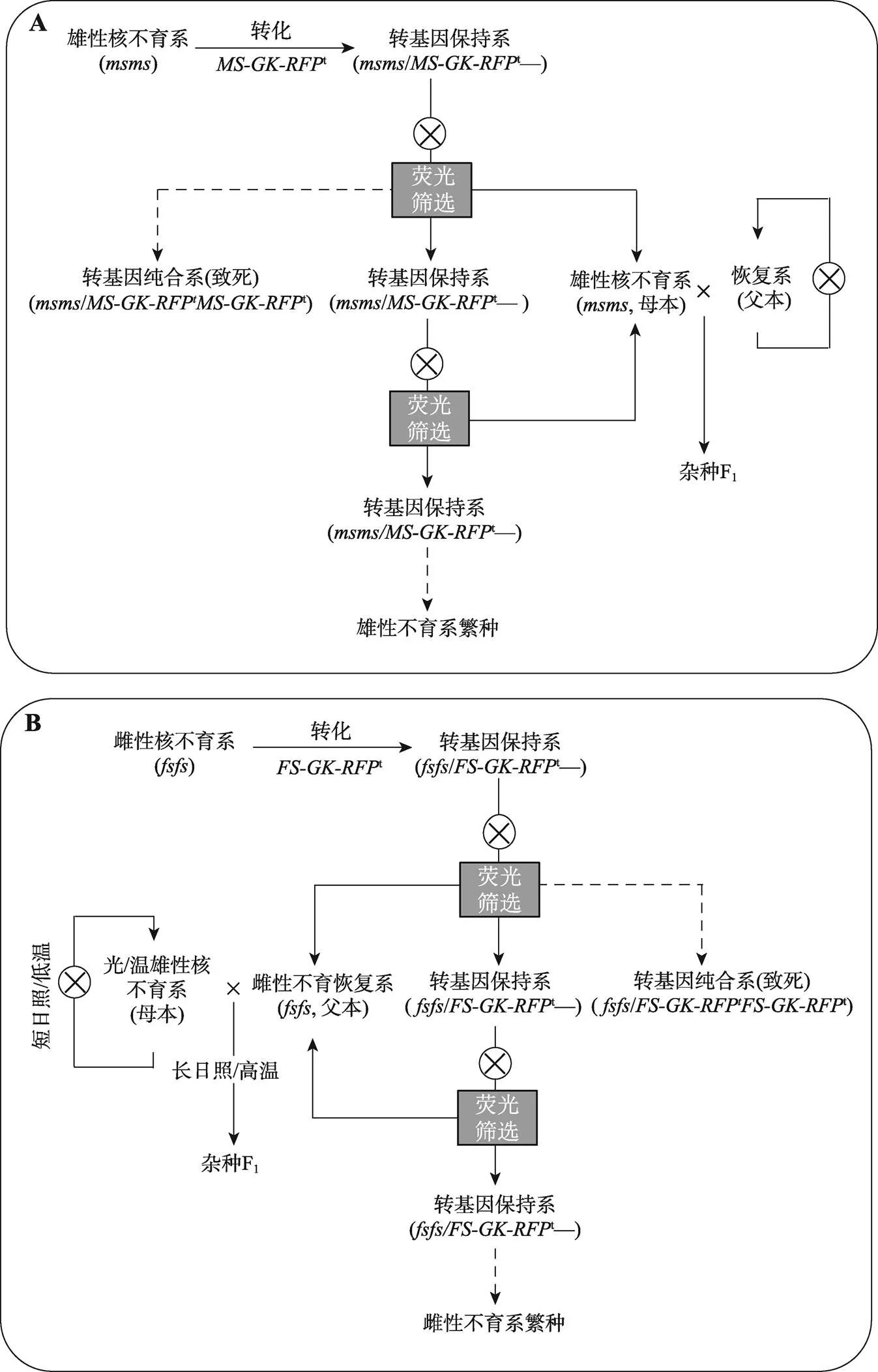
图2 智能型核雄/雌性不育系的育性调控和制种原理
A:智能型雄性不育系繁种及杂交育种原理;B:智能型雌性不育系繁种及杂交育种原理。它们的核心都是利用核雄性不育突变体()或核雌性不育突变体()作为受体,转入一个含有雄性或雌性功能型基因或、特异雄配子致死基因(,)和红色荧光素酶基因()的转基因元件(t或t),形成转基因保持系(/t—或/--t—)。在其分离后代中,或可以回补孢子体核不育表型,能杀死含有转基因元件的雄配子,能作为选择标记筛选出带转基因的保持系用于智能不育系的繁种。不带转基因的雄性不育系或雌性不育恢复系则用于杂交制种。虚线指示的基因型个体是致死的,理论上不出现。
4.4 (亚)种间优势利用的前景
当前,我国杂交水稻育种正在从品种间杂种优势利用逐渐迈向亚种间的杂种优势利用。经过长期的努力,我国育种家们已经培育了一些籼粳亚种间的杂交品种“甬优系列”和“春优系列”等[67,68]。这些亚种间杂交品种在生产上体现了比品种间杂种更强的产量优势,具有良好的应用前景。受限于籼粳亚种间杂种不育,这些品种多数是利用粳型不育系与籼粳广亲和型恢复系进行配置,还没有最大限度地利用籼粳稻之间的丰富遗传多样性。另外一方面,亚非稻种间比籼粳稻亚种间存在着更大的遗传差异,同时也蕴藏着更大的杂种优势,然而,其种间的生殖隔离也更加复杂多样的。在亚非稻之间存在很多的杂种不育位点,目前至少发现了10个种间杂种不育相关位点[69]。相较于籼粳稻亚种间杂种不育,亚非稻杂种不育的基因克隆和分子机制研究相对滞后,目前仅克隆和阐明了座位杂种不育相关基因及相关的分子机制[38,44,45]。因此,最大程度克隆籼粳亚种间和亚非稻种间杂种不育的基因并阐明相关分子机制,并结合基因编辑等技术手段快速创建人工亲和系,以及解决(亚)种间杂交的开花习性差异、生育期超亲遗传(往往生育期偏长)等问题,以推动远缘杂种优势利用。
[1] Cheng SH. Innovation and development of techniques for super-rice breeding in China., 2012, (6): 1–3.程式华. 中国超级稻育种技术的创新与发展. 作物杂志, 2012, (6): 1–3.
[2] 谢振文, 黄桂章.广东省早籼品种演变发展和系谱分析. 广东农业科学, 1989, (3): 4–9.
[3] Li CQ. The progresses on three-line and two-line hybrid rice breeding., 1998, (3): 3–6.李成荃. 三系和两系杂交水稻育种进展. 作物杂志, 1998, (3): 3–6.
[4] Wu B, Hu W, Xing YZ. The history and prospect of rice genetic breeding in China., 2018, 40 (10): 841–857.吴比,胡伟,邢永忠.中国水稻遗传育种历程与展望. 遗传, 2018, 40(10): 841–857.
[5] 袁隆平. 超级杂交水稻育种研究新进展. 中国农村科技, 2010, (2): 22–25.
[6] Birchler JA, Yao H, Chudalayandi S, Vaiman D, Veitia RA. Heterosis., 2010, 22(7): 2105–2112.
[7] Yuan LP. The cytoplasmic male sterility in rice., 1966, 17(4): 185–188.袁隆平. 水稻的雄性不孕性. 科学通报, 1966, 17(4): 185–188.
[8] Chen L, Liu YG. Male sterility and fertility restoration in crops., 2014, 65: 579–606.
[9] Chen L, Liu YG. Discovery, utilization and molecular mechanisms of CMS-WA in rice., 2016, 61(35): 3804–3812.陈乐天, 刘耀光. 水稻野败型细胞质雄性不育的发现利用与分子机理. 科学通报, 2016, 61(35): 3804–3812.
[10] Li N, Zhang DS, Liu HS, Yin CS, Li XX, Liang WQ, Yuan Z, Xu B, Chu HW, Wang J, Wen TQ, Huang H, Luo D, Ma H, Zhang DB. The rice tapetum degeneration retardation gene is required for tapetum degradation and anther development., 2006, 18(11): 2999–3014.
[11] Balk J, Leaver CJ. The PET1-CMS mitochondrial mutation in sunflower is associated with premature programmed cell death and cytochrome c release., 2001, 13(8): 1803–1818.
[12] Luo D, Xu H, Liu Z, Guo J, Li H, Chen L, Fang C, Zhang Q, Bai M, Yao N, Wu H, Wu H, Ji C, Zheng H, Chen Y, Ye S, Li X, Zhao X, Li R, Liu YG. A detrimental mitochondrial-nuclear interaction causes cytoplasmic male sterility in rice., 2013, 45(5): 573–577.
[13] Notsu Y, Masood S, Nishikawa T, Kubo N, Akiduki G, Nakazono M, Hirai A, Kadowaki K. The complete sequence of the rice (L.) mitochondrial genome: frequent DNA sequence acquisition and loss during the evolution of flowering plants., 2002, 268(4): 434–445.
[14] Liu ZL, Xu H, Guo JX, Liu YG. Structural and expressional variations of the mitochondrial genome conferring the wild abortive type of cytoplasmic male sterility in rice., 2010, 49(6): 908–914.
[15] Dewey RE, Siedow JN, Timothy DH, Levings CS 3rd. A 13-kilodalton maize mitochondrial protein inconfers sensitivity totoxin., 1988, 239(4837): 293–295.
[16] Wang Z, Zou Y, Li X, Zhang Q, Chen L, Wu H, Su D, Chen Y, Guo J, Luo D, Long Y, Zhong Y, Liu YG. Cytoplasmic male sterility of rice with boro II cytoplasm is caused by a cytotoxic peptide and is restored by two related PPR motif genes via distinct modes of mRNA silencing., 2006, 18(3): 676–687.
[17] Shinjyo C. Cytoplasmic genetic male sterility in cultivated rice,L. II. The inheritance of male sterility., 1969, 44 (3): 149–156.
[18] Sabar M, Gagliardi D, Balk J, Leaver CJ. ORFB is a subunit of F1F(O)-ATP synthase: insight into the basis of cytoplasmic male sterility in sunflower., 2003, 4 (4): 381–386.
[19] Wang K, Gao F, Ji Y, Liu Y, Dan Z, Yang P, Zhu Y, Li S. ORFH79 impairs mitochondrial function via interaction with a subunit of electron transport chain complex III in Honglian cytoplasmic male sterile rice., 2013, 198 (2): 408–418.
[20] Yi P, Wang L, Sun QP, Zhu YG. Identification of mitochondrially chimeric gene associated with Honglian type of cytoplasmic male sterility of rice., 2002(2): 130–133.易平, 汪莉, 孙清萍, 朱英国. 红莲型细胞质雄性不育线粒体相关嵌合基因的发现. 科学通报, 2002(2): 130– 133.
[21] Peng X, Wang K, Hu C, Zhu Y, Wang T, Yang J, Tong J, Li S, Zhu Y. The mitochondrial geneplays a critical role in impairing both male gametophyte development and root growth in CMS-Honglian rice., 2010, 10: 125.
[22] Tang H, Luo D, Zhou D, Zhang Q, Tian D, Zheng X, Chen L, Liu YG. The rice restorerfor Wild-Abortive cytoplasmic male sterility encodes a mitochondrial-localized PPR protein that functions in reduction oftranscripts., 2014, 7(9): 1497–1500.
[23] Hu J, Wang K, Huang W, Liu G, Gao Y, Wang J, Huang Q, Ji Y, Qin X, Wan L, Zhu R, Li S, Yang D, Zhu Y. The rice pentatricopeptide repeat protein RF5 restores fertility in Hong-Lian cytoplasmic male-sterile lines via a complex with the glycine-rich protein GRP162., 2012, 24(1): 109–122.
[24] Huang W, Yu C, Hu J, Wang L, Dan Z, Zhou W, He C, Zeng Y, Yao G, Qi J, Zhang Z, Zhu R, Chen X, Zhu Y. Pentatricopeptide-repeat family protein RF6 functions with hexokinase 6 to rescue rice cytoplasmic male sterility., 2015, 112(48): 14984–14989.
[25] Shi MS. The discovery and preliminary studies of the photoperiod-sensitive recessive male sterile rice (L. subsp.)., 1985, 18(2): 44–48.石明松. 对光照长度敏感的隐性雄性不育水稻的发现与初步研究. 中国农业科学, 1985, 18(2): 44–48.
[26] Deng HF, Shu FB, Yuan DY. An overview of research and utilization of Annong S-1., 1999, (3): 3–5.邓华凤, 舒福北, 袁定阳. 安农S-1的研究及其利用概况. 杂交水稻, 1999, (3): 3–5.
[27] Mei M, Dai X, Xu C, Zhang Q. Mapping and genetic analysis of the genes for photoperiod-sensitive genic male sterility in rice using the original mutant Nongken 58S., 1999, 39(6): 1711–1715.
[28] Ding J, Lu Q, Ouyang Y, Mao H, Zhang P, Yao J, Xu C, Li X, Xiao J, Zhang Q. A long noncoding RNA regulates photoperiod-sensitive male sterility, an essential component of hybrid rice., 2012, 109(7): 2654–2659.
[29] Zhou H, Liu Q, Li J, Jiang D, Zhou L, Wu P, Lu S, Li F, Zhu L, Liu Z, Chen L, Liu YG, Zhuang C. Photoperiod- and thermo-sensitive genic male sterility in rice are caused by a point mutation in a novel noncoding RNA that produces a small RNA., 2012, 22(4): 649–660.
[30] Fan Y, Yang J, Mathioni SM, Yu J, Shen J, Yang X, Wang L, Zhang Q, Cai Z, Xu C, Li X, Xiao J, Meyers BC, Zhang Q., producing phased small-interfering RNAs, regulates photoperiod-sensitive male sterility in rice., 2016, 113(52): 15144–15149.
[31] Zhou H, Zhou M, Yang Y, Li J, Zhu L, Jiang D, Dong J, Liu Q, Gu L, Zhou L, Feng M, Qin P, Hu X, Song C, Shi J, Song X, Ni E, Wu X, Deng Q, Liu Z, Chen M, Liu YG, Cao X, Zhuang C. RNase ZS1processesUbmRNAs and controls thermosensitive genic male sterility in rice., 2014, 5: 4884.
[32] Zhang H, Xu C, He Y, Zong J, Yang X, Si H, Sun Z, Hu J, Liang W, Zhang D. Mutation increates a new photoperiod-sensitive genic male sterile line applicable for hybrid rice seed production., 2013, 110(1): 76–81.
[33] Yu J, Han J, Kim YJ, Song M, Yang Z, He Y, Fu R, Luo Z, Hu J, Liang W, Zhang D. Two rice receptor-like kinases maintain male fertility under changing temperatures., 2017, 114(46): 12327–12332.
[34] Ouyang Y, Zhang Q. Understanding reproductive isolation based on the rice model., 2013, 64: 111–135.
[35] Ouyang YD. Progress of-hybrid sterility and wide-compatibility in rice., 2016, 61(35): 3833–3841.欧阳亦聃. 水稻籼粳杂种不育与广亲和. 科学通报, 2016, 61(35): 3833–3841.
[36] Chen J, Ding J, Ouyang Y, Du H, Yang J, Cheng K, Zhao J, Qiu S, Zhang X, Yao J, Liu K, Wang L, Xu C, Li X, Xue Y, Xia M, Ji Q, Lu J, Xu M, Zhang Q. A triallelic system ofis a major regulator of the reproductive barrier and compatibility of-hybrids in rice., 2008, 105(32): 11436–11441.
[37] Hou J, Cao C, Ruan Y, Deng Y, Liu Y, Zhang K, Tan L, Zhu Z, Cai H, Liu F, Sun H, Gu P, Sun C, Fu Y.is involved in embryo sac abortion in interspecific hybrid progeny of rice., 2019, 180(1): 356–366.
[38] Koide Y, Ogino A, Yoshikawa T, Kitashima Y, Saito N, Kanaoka Y, Onishi K, Yoshitake Y, Tsukiyama T, Saito H, Teraishi M, Yamagata Y, Uemura A, Takagi H, Hayashi Y, Abe T, Fukuta Y, Okumoto Y, Kanazawa A. Lineage- specific gene acquisition or loss is involved in interspecific hybrid sterility in rice., 2018, 115(9): E1955–E1962.
[39] Kubo T, Takashi T, Ashikari M, Yoshimura A, Kurata N. Two tightly linked genes at thelocus cause both F1and F2hybrid sterility in rice., 2016, 9(2): 221–232.
[40] Long Y, Zhao L, Niu B, Su J, Wu H, Chen Y, Zhang Q, Guo J, Zhuang C, Mei M, Xia J, Wang L, Wu H, Liu YG. Hybrid male sterility in rice controlled by interaction between divergent alleles of two adjacent genes., 2008, 105(48): 18871–18876.
[41] Mizuta Y, Harushima Y, Kurata N. Rice pollen hybrid incompatibility caused by reciprocal gene loss of duplicated genes., 2010, 107(47): 20417– 20422.
[42] Nguyen GN, Yamagata Y, Shigematsu Y, Watanabe M, Miyazaki Y, Doi K, Tashiro K, Kuhara S, Kanamori H, Wu J, Matsumoto T, Yasui H, Yoshimura A. Duplication and loss of function of genes encoding RNA polymerase III subunit C4 causes hybrid incompatibility in rice., 2017, 7(8): 2565–2575.
[43] Shen R, Wang L, Liu X, Wu J, Jin W, Zhao X, Xie X, Zhu Q, Tang H, Li Q, Chen L, Liu YG. Genomic structural variation-mediated allelic suppression causes hybrid male sterility in rice., 2017, 8(1): 1310.
[44] Xie Y, Tang J, Xie X, Li X, Huang J, Fei Y, Han J, Chen S, Tang H, Zhao X, Tao D, Xu P, Liu YG, Chen L. An asymmetric allelic interaction drives allele transmission bias in interspecific rice hybrids., 2019, 10(1): 2501.
[45] Xie Y, Xu P, Huang J, Ma S, Xie X, Tao D, Chen L, Liu YG. Interspecific hybrid sterility in rice is mediated byat thelocus encoding a peptidase-like protein., 2017, 10(8): 1137–1140.
[46] Yamagata Y, Yamamoto E, Aya K, Win KT, Doi K, Sobrizal, Ito T, Kanamori H, Wu J, Matsumoto T, Matsuoka M, Ashikari M, Yoshimura A. Mitochondrial gene in the nuclear genome induces reproductive barrier in rice., 2010, 107(4): 1494–1499.
[47] Yang J, Zhao X, Cheng K, Du H, Ouyang Y, Chen J, Qiu S, Huang J, Jiang Y, Jiang L, Ding J, Wang J, Xu C, Li X, Zhang Q. A killer-protector system regulates both hybrid sterility and segregation distortion in rice., 2012, 337(6100): 1336–1340.
[48] Yu X, Zhao Z, Zheng X, Zhou J, Kong W, Wang P, Bai W, Zheng H, Zhang H, Li J, Liu J, Wang Q, Zhang L, Liu K, Yu Y, Guo X, Wang J, Lin Q, Wu F, Ren Y, Zhu S, Zhang X, Cheng Z, Lei C, Liu S, Liu X, Tian Y, Jiang L, Ge S, Wu C, Tao D, Wang H, Wan J. A selfish genetic element confers non-Mendelian inheritance in rice., 2018, 360(6393): 1130–1132.
[49] Yu Y, Zhao Z, Shi Y, Tian H, Liu L, Bian X, Xu Y, Zheng X, Gan L, Shen Y, Wang C, Yu X, Wang C, Zhang X, Guo X, Wang J, Ikehashi H, Jiang L, Wan J. Hybrid sterility in rice (L.) involves the tetratricopeptide repeat domain containing protein., 2016, 203(3): 1439– 1451.
[50] Xie Y, Shen R, Chen L, Liu YG. Molecular mechanisms of hybrid sterility in rice., 2019 62(6), 737–743.
[51] Kitamura E. Genetics studies on sterility observed in hybrids between distantly related varieties of rice (L.)., 1962, 8: 141–205.
[52] Zhang GQ, Lu YG. Development of the-compatibiliticlines for the breeding of super-rice., 2007, 38(5): 676–680.张桂权, 卢永根. 水稻粳型亲籼系的创建及其在超级稻育种上的利用. 沈阳农业大学学报, 2007, 38(5): 676– 680.
[53] Chen L, Zhao Z, Liu X, Liu L, Jiang L, Liu S, Zhang W, Wang Y, Liu Y, Wan J. Marker-assisted breeding of a photoperiod-sensitive male sterilerice with high cross-compatibility withrice., 2011, 27(2): 247–258.
[54] Guo J, Xu X, Li W, Zhu W, Zhu H, Liu Z, Luan X, Dai Z, Liu G, Zhang Z, Zeng R, Tang G, Fu X, Wang S, Zhang G. Overcoming inter-subspecific hybrid sterility in rice by developing-compatiblelines., 2016, 6: 26878.
[55] Ma RR, Wang XY, Lu YF, Zhou HC, Cai KF, Li XN, Zhang ZY. Breeding and application of lateCMS line Yongjing 2A and its late-hybrid rice combinations., 2010, 25 (S1): 185–189.马荣荣, 王晓燕, 陆永法, 周华成, 蔡克锋, 李信年, 章志远. 晚粳不育系甬粳2号A及其籼粳杂交晚稻组合的选育及应用. 杂交水稻, 2010, 25(S1): 185–189.
[56] Xie Y, Niu B, Long Y, Li G, Tang J, Zhang Y, Ren D, Liu YG, Chen L. Suppression or knockout of/overcomes the-mediated hybrid male sterility in rice., 2017, 59(9): 669–679.
[57] Chang Z, Chen Z, Wang N, Xie G, Lu J, Yan W, Zhou J, Tang X, Deng XW. Construction of a male sterility system for hybrid rice breeding and seed production using a nuclear male sterility gene., 2016, 113(49): 14145–14150.
[58] Xia Y, Tang N, Hu Y, Li D, Li S, Bu X, Yu M, Qi S, Yang Y, Zhu H, Cao C, Li P, Yuan L, Cao M. A method for mechanized hybrid rice seed production using female sterile rice., 2019, 12(1): 39.
[59] Li Q, Zhang D, Chen M, Liang W, Wei J, Qi Y, Yuan Z. Development ofphoto-sensitive genic male sterile rice lines by editingusing CRISPR/Cas9., 2016, 43(6): 415–419.
[60] Zhou H, He M, Li J, Chen L, Huang Z, Zheng S, Zhu L, Ni E, Jiang D, Zhao B, Zhuang C. Development of commercial thermo-sensitive genic male sterile rice accelerates hybrid rice breeding using the CRISPR/Cas9-mediatedediting system., 2016, 6: 37395.
[61] Mieulet D, Jolivet S, Rivard M, Cromer L, Vernet A, Mayonove P, Pereira L, Droc G, Courtois B, Guiderdoni E, Mercier R. Turning rice meiosis into mitosis., 2016, 26(11): 1242–1254.
[62] Khanday I, Skinner D, Yang B, Mercier R, Sundaresan V. A male-expressed rice embryogenic trigger redirected for asexual propagation through seeds., 2019, 565(7737): 91–95.
[63] Kelliher T, Starr D, Richbourg L, Chintamanani S, Delzer B, Nuccio ML, Green J, Chen Z, McCuiston J, Wang W, Liebler T, Bullock P, Martin B. MATRILINEAL, a sperm-specific phospholipase, triggers maize haploid induction., 2017, 542(7639): 105–109.
[64] Liu C, Li X, Meng D, Zhong Y, Chen C, Xu X, Chen B, Li W, Li L, Tian X, Zhao H, Song W, Luo H, Zhang Q, Lai J, Jin W, Yan J, Chen S. A 4-bp insertion atencoding a putative phospholipase a generates haploid induction in maize., 2017, 10(3): 520–522.
[65] Yao L, Zhang Y, Liu C, Liu Y, Wang Y, Liang D, Liu J, Sahoo G, Kelliher T.mutation induces haploid seed formation inrice., 2018, 4(8): 530– 533.
[66] Wang C, Liu Q, Shen Y, Hua Y, Wang J, Lin J, Wu M, Sun T, Cheng Z, Mercier R, Wang K. Clonal seeds from hybrid rice by simultaneous genome engineering of meiosis and fertilization genes., 2019, 37(3): 283– 286.
[67] Lin JR, Wu MG, Song XW, Ruan GH. Chunyou 658, a new inter-subspecific hybrid rice combination with high yield., 2009, 24(5): 84–85.林建荣, 吴明国, 宋昕蔚, 阮关海. 籼粳亚种间高产杂交水稻新组合春优658. 杂交水稻, 2009, 24(5): 84–85.
[68] Wei HH, Jiang YH, Zhao K, Xu JW, Zhang HC, Dai QG, Huo ZY, Xu K, Wei HY, Zheng F. Characteristics of super-high yield population in Yongyou series of hybrid rice., 2013, 39(12): 2201–2210.韦还和, 姜元华, 赵可, 许俊伟, 张洪程, 戴其根, 霍中洋, 许轲, 魏海燕, 郑飞. 甬优系列杂交稻品种的超高产群体特征. 作物学报, 2013, 39(12): 2201–2210.
[69] Garavito A, Guyot R, Lozano J, Gavory F, Samain S, Panaud O, Tohme J, Ghesquière A, Lorieux M. A genetic model for the female sterility barrier between asian and african cultivated rice species., 2010, 185(4): 1425–1440.
Current advance on molecular genetic regulation of rice fertility
Yongyao Xie1, Jintao Tang1, Bowen Yang1, Jun Hu2, Yao-Guang Liu1, Letian Chen1
Hybrid rice has contributed greatly to global food security. Cytoplasmic male sterility (CMS) and photo/ thermo sensitive genic male sterility (P/TGMS) are genetic bases for three-line and two-line hybrid rice production, respectively. In contrast, (sub-) specific hybrid sterility (HS) is a major barrier for utilization of hybrid vigor of distant hybrid rice. Therefore, understanding the molecular regulatory mechanism of rice fertility is a key technical issue for hybrid rice industry, and a long-standing basic scientific issue for nuclear-cytoplasmic interaction and reproductive isolation. Chinese geneticists of plant sciences have made tremendous contributions on the molecular genetic basis of rice fertility related to hybrid rice production. Here, we review the development of hybrid rice production systems in China and summarize current advance on genetic basis and molecular mechanism of CMS, P/TGMS, and HS involved in hybrid rice. We also discuss problems of hybrid rice production in China and point out new direction for future utilization of heterosis in rice.
hybrid rice; cytoplasmic male sterility; hybrid sterility; photo/thermo sensitive genic male sterility; fertility restoration
2019-06-05;
2019-06-18
国家自然科学基金项目(编号:31701499),广州市科技创新委员会重点项目(编号:201707020016),中国博士后科学基金项目(编号:2018M630955)和亚热带农业生物资源保护与利用国家重点实验室开放课题(编号:SKLCUSA-b201717)资助[Supported by the National Natural Science Foundation of China (No. 31701499), the Key Research Program of Guangzhou Science Technology and Innovation Commission (No.201707020016), the China Postdoctoral Science Foundation (No. 2018M630955) and the State Key Laboratory for Conservation and Utilization of Subtropical Agro-Bioresources (No. SKLCUSA-b201717)]
谢勇尧,博士,博士后,研究方向:作物育性分子机制与杂种优势利用。E-mail: xieyongyao2005@163.com
陈乐天,博士,教授,研究方向:作物育性分子机制与杂种优势利用。E-mail: lotichen@scau.edu.cn
10.16288/j.yczz.19-162
2019/7/18 15:09:15
URI: http://kns.cnki.net/kcms/detail/11.1913.R.20190718.1415.002.html
(责任编委: 邢永忠)
