283例系统性治疗的肺癌患者静脉血栓栓塞症的危险因素分析
2019-08-26刘燕娥顾阳春易福梅曹宝山
刘燕娥 顾阳春 易福梅 曹宝山
静脉血栓栓塞症(venous thromboembolism, VTE)是血液在静脉内异常凝结,使血管完全或不完全阻塞的一种静脉回流障碍性疾病,包括深静脉血栓(deep venous thromboembolism, DVT)和肺栓塞(pulmonary embolism,PE)两种类型[1]。VTE的临床症状常常不典型,肿瘤相关VTE发生率约1.3%-12.6%[2,3],VTE相关死亡率高达12%-30%[2,4]。在美国,合并VTE的肺癌患者平均医疗费用高达84,187美元,显著高于无VTE的56,818美元[5]。VTE可导致化疗延迟、降低疗效、延长住院时间、增加治疗费用[6]。因此,近年来肿瘤相关性VTE日益被人们所重视及认识,已形成专家共识[1],对于早期诊断和预防VTE、降低患者风险、减轻患者及家庭经济和心理负担具有十分重要的意义。
肺癌患者容易发生VTE,约3%-19%的肺癌患者经历过VTE[7,8]。目前关于肺癌VTE的研究多侧重于围手术期患者,针对系统性治疗的肺癌患者VTE的发生情况及影响因素的研究仍较少。因此,本研究通过回顾性分析2016年1月-2018年12月在北京大学第三医院肿瘤化疗与放射病科住院接受系统性治疗的283例肺癌患者,旨在明确全身药物治疗期间肺癌患者VTE的发生率及高危因素,探寻具有较强影响的预测因素,为今后肺癌VTE的早期预防、早期发现和早期治疗提供了理论依据。
1 资料与方法
1.1 研究对象 通过电子病历查询系统,收集2016年1月-2018年12月在北京大学第三医院肿瘤化疗与放射病科住院的且符合如下标准的肺癌患者。入组标准:病理明确诊断为肺恶性肿瘤,有明确的肿瘤分期,接受系统性药物治疗的患者(包括化疗、酪氨酸激酶抑制剂和抗血管生成药物等)。排除标准:资料不完善者;持续应用抗凝药物治疗的患者。检索到在此期间住院的肺癌患者共计318例,符合上述标准者共283例。
1.2 资料收集 采集指标包括患者年龄、性别、身高、体质量、行为状态、既往病史(包括慢性阻塞性肺疾病、高血压、心脏病、糖尿病、血栓、下肢静脉曲张、6个月内接受根治性肺切除手术等)、烟酒史;肿瘤类型、肿瘤分期、是否化疗、治疗方案、首次药物治疗前的白细胞(white blood cell, WBC)、血红蛋白(hemoglobin,HGB)、血小板(platelet, PLT)、白蛋白、肝肾功能、凝血酶原时间(prothrombin time, PT)、纤维蛋白原降解产物(fibrin degradation product, FDP)(0 μg/mL-5 μg/mL)、D-二聚体(0 μg/mL-0.3 μg/mL)等。采集经外周中心静脉置管术(peripheral central venous catheterization, PICC)植入情况,并采集血管超声或CT血管造影结果。计算患者身体质量指数(body mass index, BMI),BMI=体质量(kg)/身高(m)2和内生肌酐清除率(endogenous creatinine clearance rate, Ccr)=[(140-年龄)×体质量(kg)]/[0.818×Scr(μmol/L)](女性按计算结果×0.85)。
1.3 评定标准 肿瘤分期依据美国癌症联合委员会颁布的第7版分期标准[9]进行评估。行为状态评分依据美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分系统。
肿瘤活动期是指肿瘤确诊后未行抗肿瘤治疗或治疗后疾病进展的患者;肿瘤稳定期是指经抗肿瘤治疗后疾病处于完全缓解、部分缓解或疾病稳定的以及根治性术后接受辅助化疗和随访期间的患者。
DVT诊断依据静脉超声图像或计算机断层扫描(computed tomography, CT)静脉血管造影判断。PE诊断通过CT肺血管造影或肺通气-灌注扫描证实。肱静脉、腋静脉、锁骨下静脉及颈内静脉血栓定义为上肢深静脉血栓。
1.4 统计学方法 应用SPSS 22.0统计学软件分析。计数资料采用卡方检验或Fisher精确检验;多因素分析采用Logistic回归分析。全部统计检验均为双侧概率检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 一般特征 283例患者符合研究要求,中位年龄为63(19-82)岁,<65岁的患者居多,占56.89%(161/283);男性居多,占65.00%(184/283);肺腺癌占52.65%(149/283);晚期患者居多,IV期患者占63.61%(180/283),接受根治性肺切除手术者占16.96%(48/283);ECOG 0分-1分患者居多,占88.69%(251/283);接受化疗者居多,占88.69%(251/283),见表1。
2.2 VTE组肺癌患者的临床特征 283例肺癌患者中,VTE发生率为12.01% (34/283),VTE发生时距离肿瘤确诊的中位时间为3.0(0.2-49)个月。34例VTE患者中DVT 24例、PE 7例、DVT合并PE 3例。VTE组患者的中位年龄为60(19-78)岁,男性居多,占76.50%(26/34);处于肿瘤活动期的患者居多,占61.76%(21/34);症状性DVT患者占75.00%(18/24),上肢静脉血栓占79.16%(19/24);症状性PE占57.14%(4/7),左肺动脉栓塞占42.86%(3/7);症状性DVT合并PE占66.66%(2/3),见表2。接受PICC的患者共计175例,上肢静脉血栓的发生率为9.71%(17/175),显著高于未行PICC组的1.85%(2/108)(P=0.010)。

表1 283例肺癌患者的临床特征分析Tab 1 Analysis of clinical features in 283 patients with lung cancer
2.3 VTE组与非VTE组临床资料的比较 下肢静脉曲张患者VTE发生率为50.00%(5/10),显著高于无下肢静脉曲张患者的9.89%(27/273)(P=0.001)。远处转移患者的VTE发生率为14.05%(26/185),高于带瘤但无远处转移患者的14.00%(7/50),且高于无瘤患者的2.08%(1/48)(P=0.024)。肿瘤活动期组的VTE发生率为16.93%(21/124),显著高于稳定期组的8.18%(3/159)(P=0.025),见表3。接受抗血管生成药物治疗的患者VTE的发生率高于对照组,但未见明显统计学差异(P>0.05),见表4。
2.4 VTE组与非VTE组血液学指标的比较 本研究发现:白蛋白<35 g/L组VTE发生率为22%(11/50),显著高于≥35 g/L组的9.87%(23/233)(P=0.017)。FDP>5 μg/mL组VTE发生率为24.49%(12/49),显著高于≤5 μg/mL组的9.41%(22/234)(P=0.003)。D-二聚体>0.3 μg/mL组VTE发生率为17.93%(26/145),显著高于≤0.3 μg/mL组的5.80%(8/138)(P=0.006)。肾功能Ccr<90 mL/min的VTE发生率为6.66%(12/181),显著低于≥90 mL/min组的21.57%(22/102)(P=0.001)。而在WBC≥11×109/L组、HGB<100 g/L组、PLT≥350×109/L组VTE发生率均呈现出高于对照组的趋势,但均无明显统计学差异(P>0.05),见表5。
2.5 多因素分析 校正是否有肿瘤负荷、是否处于活动期、有无下肢静脉曲张病史、是否合并低蛋白血症(白蛋白<35 g/L)、肾功能是否异常(Ccr<90 mL/min)、FDP是否升高(FDP>5 μg/mL)、D-二聚体是否升高(D-二聚体>0.3 μg/mL)等因素,Logistic分析(向前法)表明下肢静脉曲张、低白蛋白血症、D-二聚体升高是VTE的独立影响因素(P<0.05),见表6。
3 讨论
肺癌患者中VTE有较高的发病率和死亡率[10,11],但关于肺癌在药物治疗期间VTE的发生情况及影响因素尚缺乏报道。本研究中肺癌患者的VTE发生率为12.01%(34/283),与Connolly等[5]和Alexander等[8]报道的13.9%和19%相近,但显著高于Chew等[7]报道的3.0%-3.4%。产生差异的原因在于本研究人群为接受系统性治疗的肺癌患者,且61.83%的患者接受PICC,而Chew等[7]研究人群为新诊断的肺癌患者。此外,化疗、靶向治疗和PICC等因素均可增加VTE的发生风险[13]。因此,从VTE发生率上来说并不矛盾。
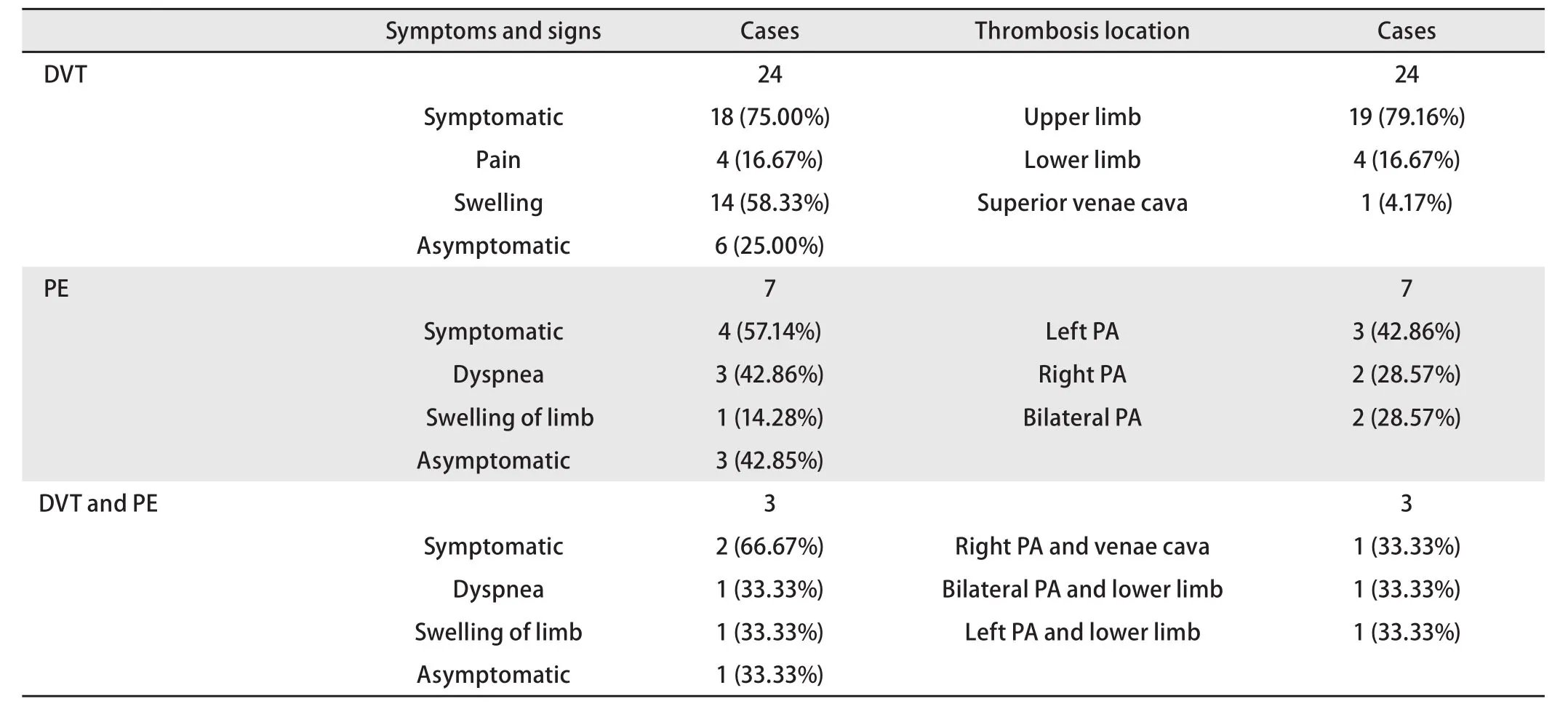
表2 34例发生VTE的肺癌患者临床特征分析Tab 2 Analysis of clinical features in 34 patients with lung cancer and VTE
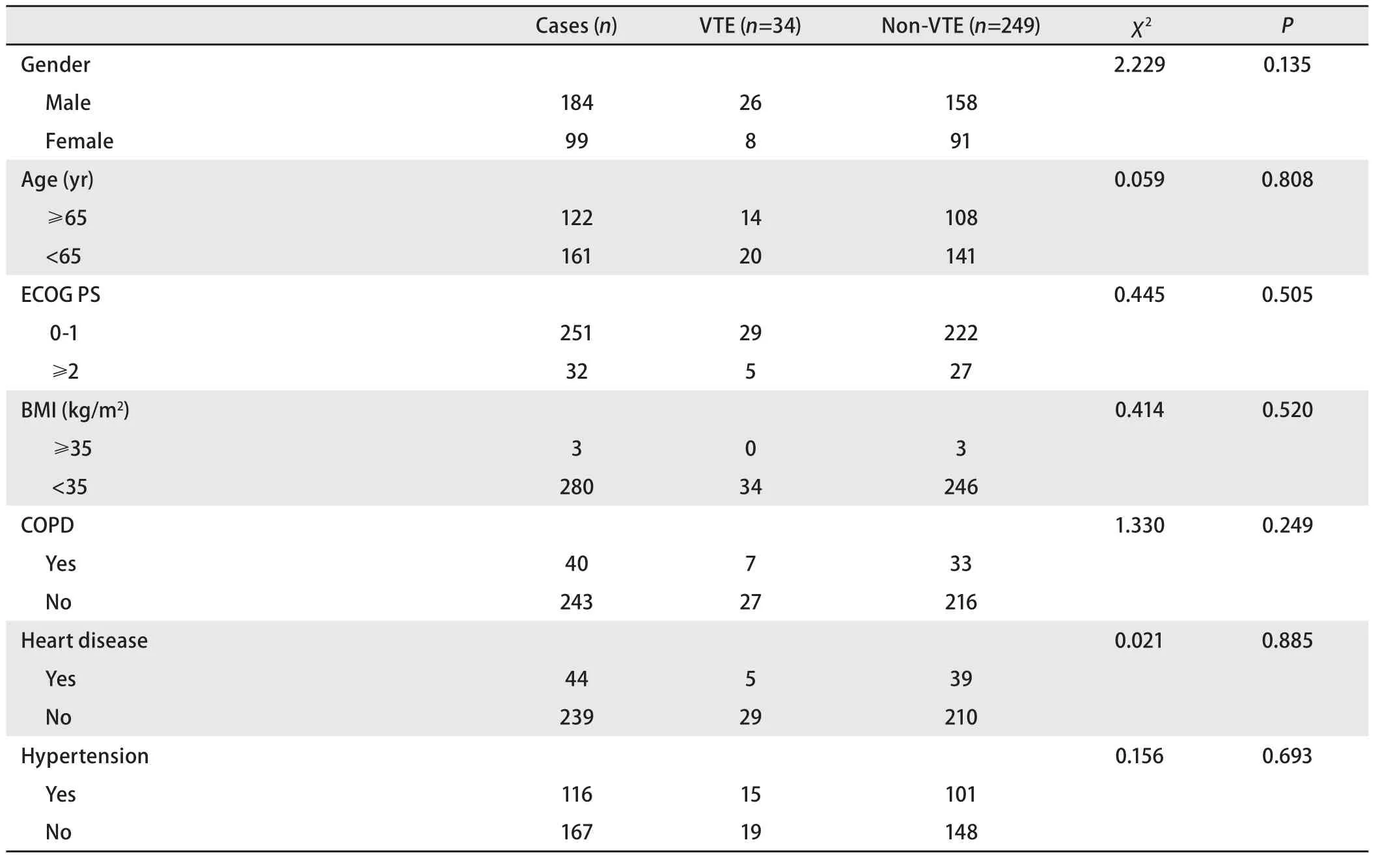
表3 283例肺癌患者VTE组与非VTE组的临床特征分析Tab 3 Analysis of clinical data in 283 patients with lung cancer between VTE group and Non-VTE group

表3 283例肺癌患者VTE组与非VTE组的临床特征分析(续表)Tab 3 Analysis of clinical data in 283 patients with lung cancer between VTE group and Non-VTE group (Continued)
本研究中带瘤、远处转移的患者更容易发生VTE,与既往研究结果类似[12,13]。处于肿瘤活动期的患者VTE发生率为16.93%,显著高于稳定期的患者(8.19%)。其原因可能为:肿瘤组织本身可分泌组织因子、纤维蛋白溶酶原激活剂等促凝物质,使机体处于高凝状态,而肿瘤细胞损伤血管内皮,更容易在血管壁形成血栓[14]。本研究发现肾功能异常患者VTE发生率低于肾功能正常者,但多因素分析未提示两者独立相关。在非肿瘤患者中慢性肾脏疾病与VTE风险独立相关[15]。但在肿瘤患者中仍存在争议,Kooiman等[16]研究发现合并慢性肾脏疾病的肿瘤患者复发性VTE发生率低于肾功能正常的患者,这与我们的结论类似,而在Joanna等[17]的研究中,合并慢性肾脏疾病的肺癌患者VTE事件发生率更高,目前机制尚不明确。此外,本研究中PICC组上肢静脉血栓发生率显著高于非PICC组,可能与中心静脉导管置入后对上肢静脉血管内皮的机械性损伤、血流缓慢及增加血小板的聚集有关。
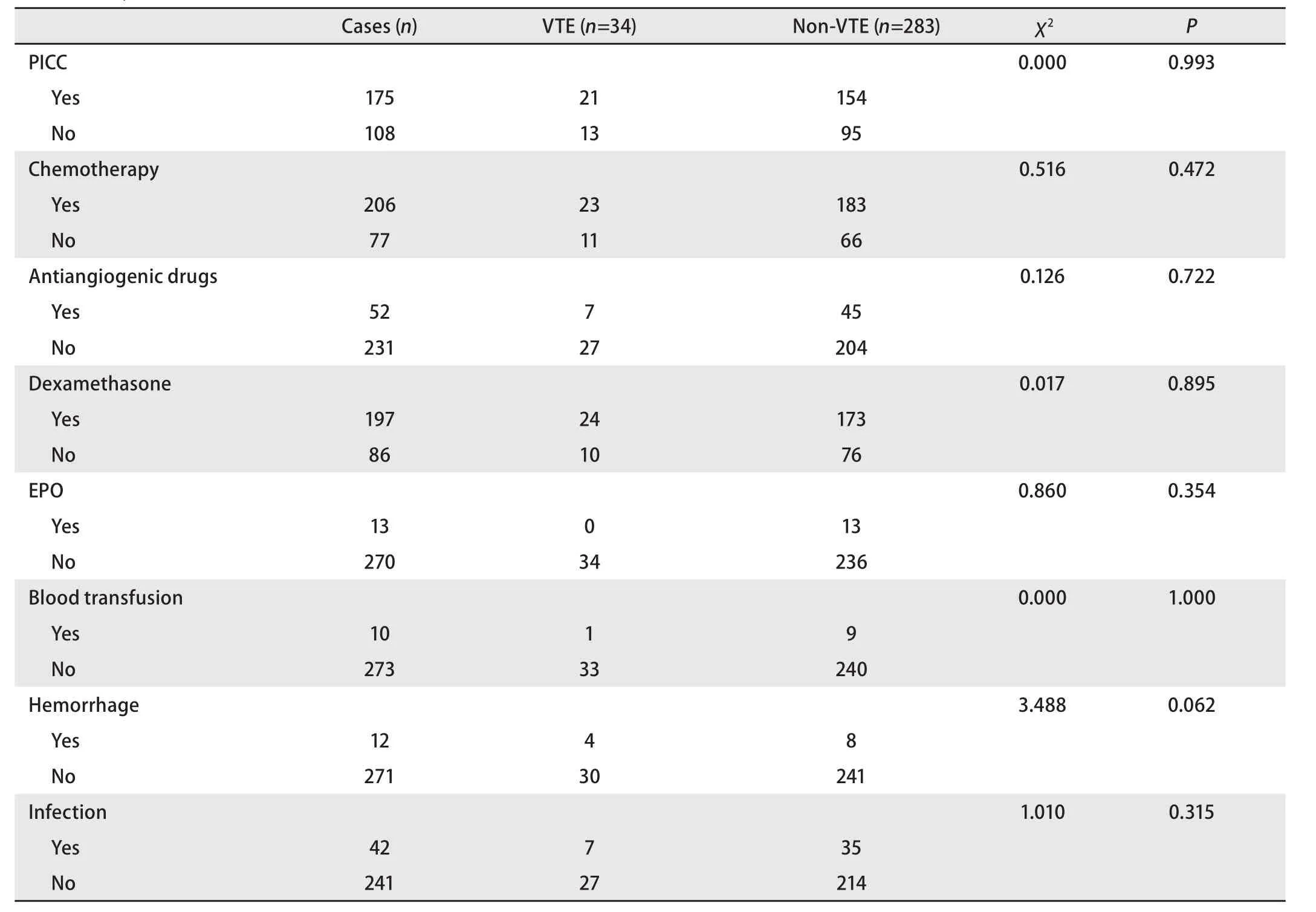
表4 283例肺癌患者VTE组与非VTE组的治疗相关因素分析Tab 4 Analysis of clinical factors associated with therapy in 283 patients with lung cancer between VTE group and non-VTE group
本研究显示下肢静脉曲张、低蛋白血症及D-二聚体是肺癌VTE的独立危险因素。下肢静脉曲张患者由于静脉管壁变薄、内膜损伤、血液淤滞易发生血小板黏附聚集,容易形成血栓,Barsoum等[18]也发现静脉曲张是VTE的独立危险因素。低白蛋白血症者血浆胶体渗透压降低,血浆中水分加速流向组织间隙,导致血液粘稠,使血液与血管内皮细胞之间剪切力增加,引起血管内皮细胞损伤,易形成血栓,且影响凝血因子的合成,尤其是纤溶及抗凝系统,导致血液高凝。本研究中单因素及多因素分析均提示低蛋白血症与肺癌VTE显著相关,而有研究[19]仅在单因素分析中发现低蛋白血症与肺癌VTE风险增加有关。考虑产生差异的原因为:该研究为病例对照匹配研究,纳入人群较少。此外,本研究中发现异常水平的FDP和D-二聚体与VTE风险增加有关,且D-二聚体升高是VTE的独立预测因素,与既往研究[19]一致。尽管临床上D-二聚体成为VTE首要的筛查指标之一,但由于90%的肺癌患者存在血液高凝状态,其特异性仅为50%[20]。目前,已有KRS、PROTECHT、CONKO和COMPASS-CAT VTE的预测评分模型[21-24],但上述评分系统缺乏对下肢静脉曲张、白蛋白水平、D-二聚体的考量,因此,进一步建立和完善肺癌VTE的风险预测模型显得非常重要。
本研究是一项回顾性研究,因为不是所有的患者都例行血管超声或CTPA检查, VTE发生率存在低估的可能;此外,本研究纳入样本量偏少,存在选择性偏倚的可能。
综上所述,本研究发现有下肢静脉曲张病史、低白蛋白血症、高D-二聚体是肺癌患者发生VTE的独立危险因素,提示后续预测模型的建立应纳入有无下肢静脉曲张病史、白蛋白、D-二聚体等因素,进一步进行前瞻性临床验证,从而有助于早期识别、早期预防及早期治疗肺癌VTE,对于改善患者生活质量及预后具有非常重要的意义。
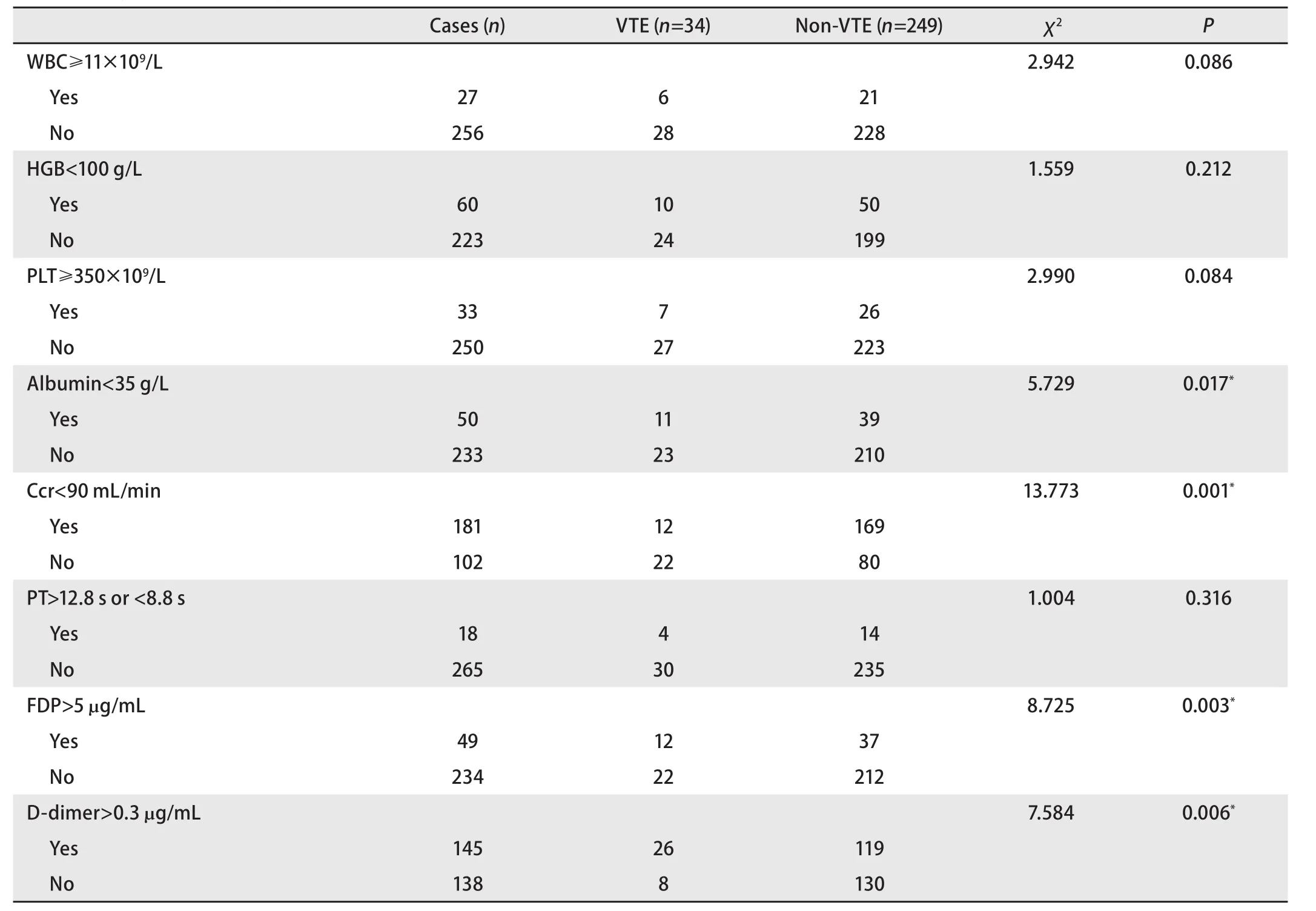
表5 283例肺癌患者VTE组与非VTE组的血液学指标分析Tab 5 Analysis of hematology indexes in 283 patients with lung cancer between VTE group and non-VTE group
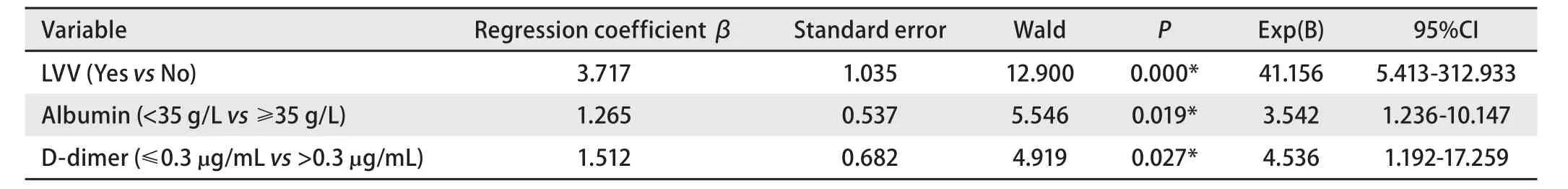
表6 283例肺癌患者VTE发生率的多因素分析Tab 6 Logistics analysis of the incidence of VTE in 283 patients with lung cancer
