腹腔镜脾切除后门静脉系统血栓形成早期预防与治疗
2019-08-24王泉雄方志杰刘志苏钱玉元
王泉雄,方志杰,刘志苏,钱玉元
(1.云梦县中医医院普外科, 湖北 孝感 432500;2.武汉大学中南医院肝胆胰外科,湖北 武汉 430071;3.武汉大学中南医院急救中心,湖北 武汉 430071)
脾脏发挥着储血造血、免疫等作用,是人体的重要脏器,腹腔镜脾切除术是治疗外伤性脾破裂、门静脉高压性脾肿大、原发性血小板减少性紫癜等疾病的重要及有效的微创治疗措施[1]。但是脾切除后可合并免疫功能下降、凶险性感染等风险,并常继发性血小板增多甚至血栓形成等严重并发症[2]。尤其以门静脉血栓形成或肠系膜静脉血栓形成常见,严重影响病人预后甚至危及生命。
门静脉血栓形成造成的肝前性阻塞,加上因肝硬化肝内纤维组织增生肝细胞结节性再生造成的窦性阻塞和窦后性阻塞均可加重门静脉高压,出现上消化道出血、顽固性腹水、黄疸、肝性脑病等严重并发症。肠系膜静脉血栓形成造成肠管水肿、急性缺血坏死、绞窄性肠梗阻等严重并发症。相关研究指出行脾切除手术后病人静脉血栓形成的发生率明显高于非手术病人,因此,术后积极预防和治疗静脉血栓具有重要意义[3]。虽有不少文献报道术后常规应用抗凝、溶栓治疗可以预防血栓形成,但大部分都是经验性报道,对本病发生的危险因素及预防策略,目前缺乏一个普遍接受的指南和标准[4-5]。因此从临床角度分析门静脉系统血栓(portal vein systemic thrombosis,PVST)的相关危险因素,建立围手术期预测PVST形成的Logistic回归预测模型对于指导临床工作意义重大。
资料与方法
一、病人一般资料
1.病例选择 选择武汉大学中南医院普外科2009年2月至2016年12月期间接受腹腔镜脾切除手术治疗的病人130例,所有病人资料完整,术前都有不同程度的脾功能亢进或特发性血小板减少性紫癜或脾外伤,两组病人经术前腹部彩超或腹部CT检查均未发现门静脉或肠系膜上静脉血栓,术后1个月内影像学检查明确有无发生PVST分为PVST和非PVST组。该临床研究经过医院伦理委员会批准,病人及其家属同意并签署知情同意书。术后,病人血小板骤然升高及长时间卧床等高危因素易导致血栓形成,因此术后可选择行抗凝治疗。根据病人意愿不选择术后抗凝治疗为非抗凝组(57例),病人给予常规抗感染、护肝、营养支持等治疗;抗凝组(73例)病人在上述治疗的基础上给予皮下注射低分子肝素钙治疗(万脉舒,河北常山生化药业股份有限公司,0.4 ml:4 100 IU)0.4 ml/d,疗程为7 d,用药过程中密切监测病人凝血功能。
2.病例排除标准 术前经过多普勒超声仪或腹部CT证实已存在门静脉系统或肠系膜静脉血栓者;术中或术后肝脏病理证实肝硬化合并肝脏肿瘤者;术中或术后使用止血药物者;合并心肝肺肾等器官重大基础疾病;其他部位深静脉血栓者均不纳入本研究。
二、观察指标及数据收集
搜集病人腹腔镜脾切除术1个月后的病例资料,包括病人性别、年龄、病因、合并糖尿病、高脂血症、有无脾功能亢进、有无食管胃底静脉曲张、凝血酶原时间(PT)、国际标准化比值(INR)、血小板平均体积(MPV)、血小板计数(PLT)、血浆D-二聚体、有无术后抗凝治疗等指标。收集两组病人手术1个月后临床生化血样检测指标,并通过腹部B超或CT确定有无PVST。
三、统计学处理

结 果
一、一般资料
在130例病人中,术后49例(37.7%)出现PVST并发症。PVST主要发生在肝内门静脉血栓形成的分支,主要门静脉、肠系膜上静脉和脾静脉。典型的CT图像如图1所示。
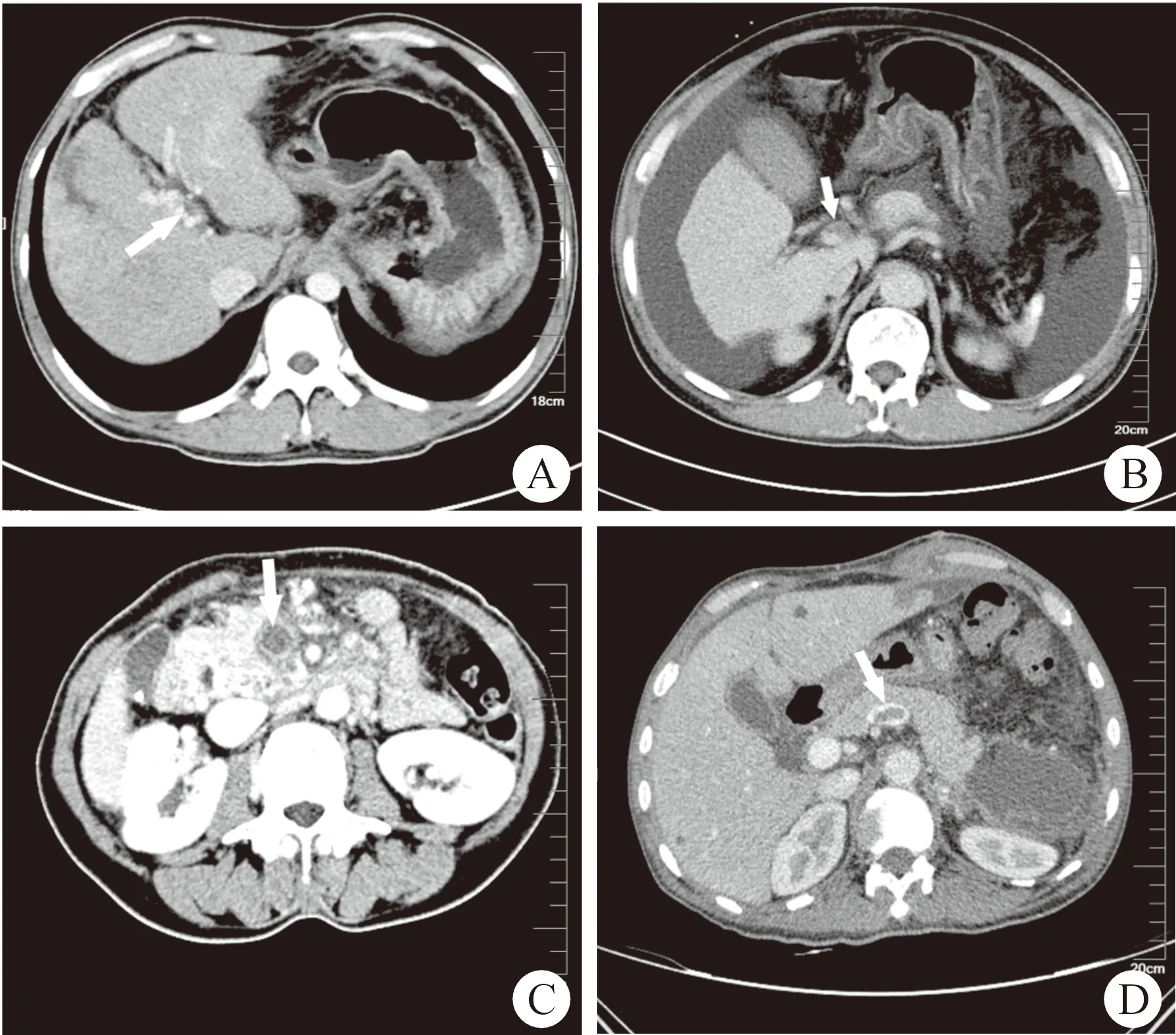
图1 门静脉系统血栓栓塞类型 A.肝内门静脉分支血栓(箭头所示);B.门静脉主干血栓栓塞(箭头所示);C.肠系膜上静脉血栓栓塞(箭头所示);D.脾静脉血栓栓塞(箭头所示)
二、单因素分析
PVST组和非PVST组的临床特点如表1所示。两组之间差异没有统计学意义,包括性别,年龄,高血压,糖尿病,高脂血症,PT,INR,纵向脾脏直径,门静脉血流速度,手术时间,术中失血,术中输血,均P>0.05。
单因素分析结果显示,与非PVST组相比,PVST组MPV明显增大(P<0.01),PLT明显增高(P<0.001),血浆D-二聚体显著增高(P<0.001),脾脏厚度增加(P<0.001),门静脉直径显著增宽(P<0.001)(表1)。
三、多因素Logistic 回归分析
术后相关因素Logistic回归分析结果显示PLT、血浆D-二聚体、脾脏厚度、门静脉直径等指标是形成的独立危险因素,两组间差异有统计学意义(均P<0.05);术后使用抗凝治疗为术后PVST形成的独立保护因素(均P<0.05)。见表2。
四、抗凝药物结果分析
在抗凝组和非抗凝组之间进行分析表明,与非抗凝组相比,抗凝药物可以改变血液高凝状态。抗凝组PT(P=0.041)和INR (P=0.040) 值较非抗凝组明显增高。当病人使用抗凝药物时,PLT和血浆D-二聚体显著降低,见表3。
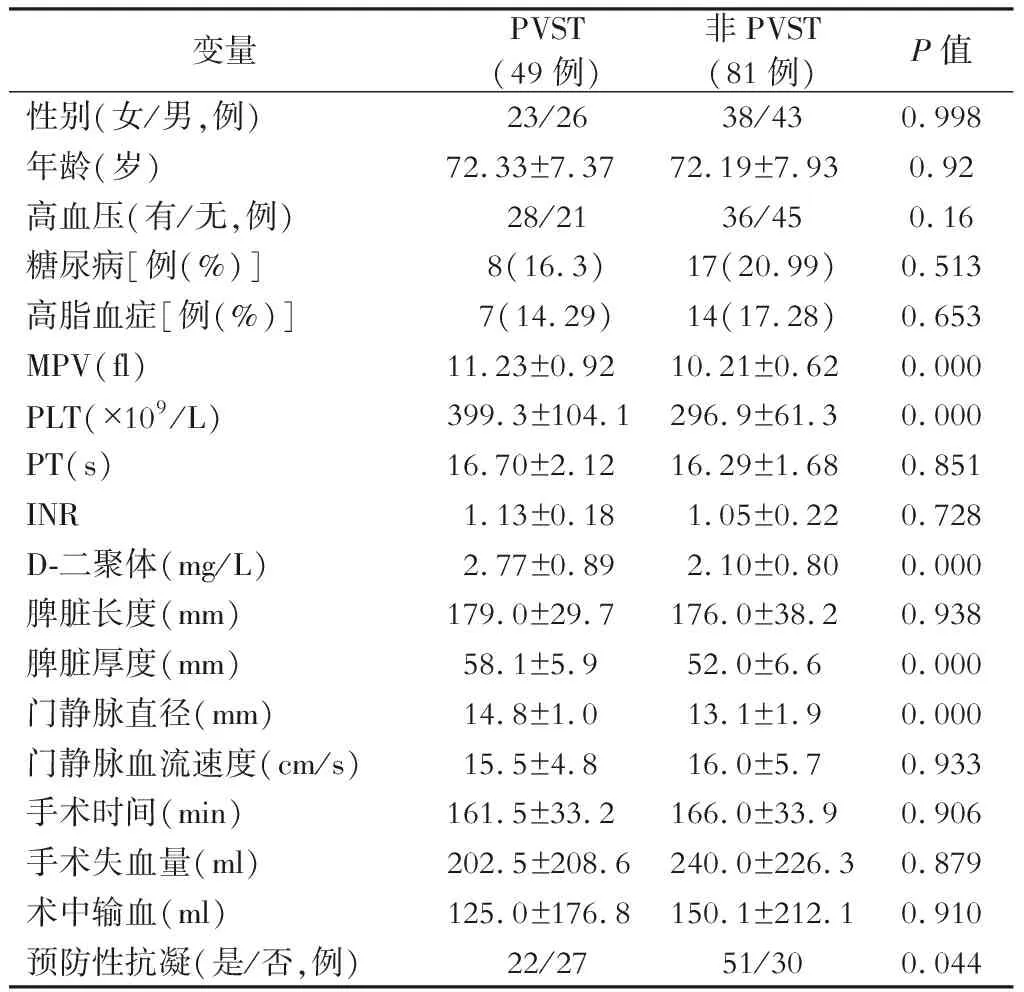
表1 术后PVST影响因素的单变量分析
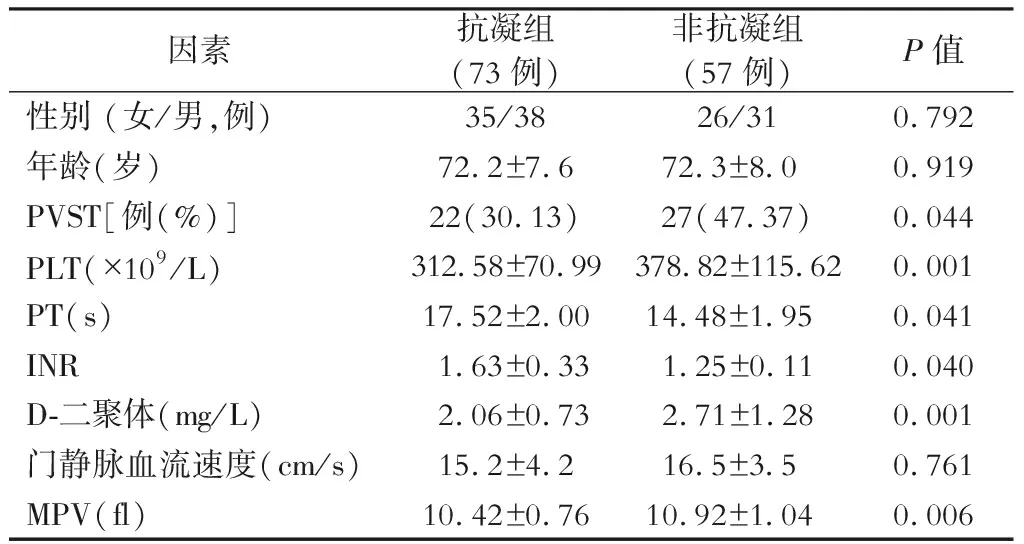
表3 抗凝药物对PVST的影响
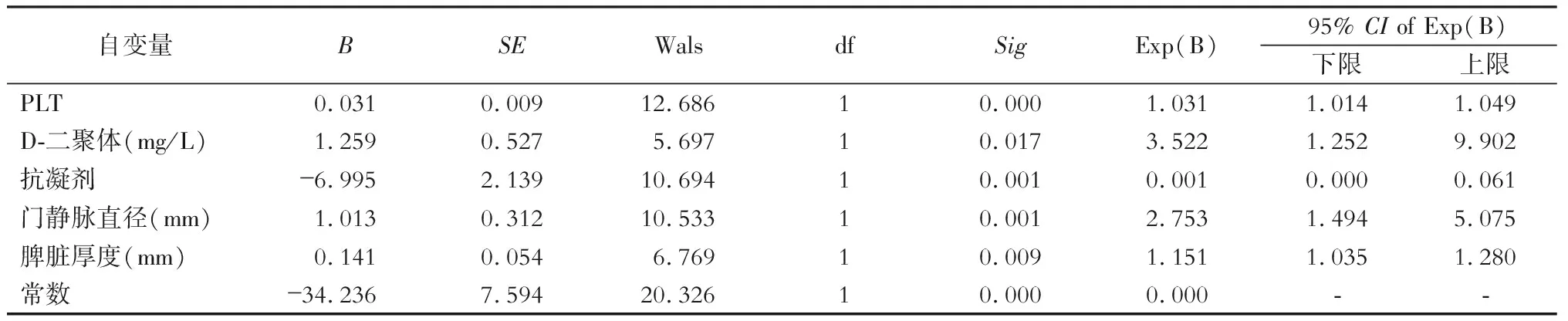
表2 术后PVST影响因素的多变量分析
讨 论
在正常生理状况下,脾脏中血小板储存量约占全身血液中30%,当发生脾功能亢进、脾大时可增加至80%。当肝硬化脾功能亢进时以下因素导致血小板降低:脾脏肿大后血小板和红细胞在脾脏中储藏量增加,淤血使血小板和红细胞通过脾索时变形能力较差;通过脾索时血小板和红细胞的速度减慢,使其有充足的时间与巨噬细胞接触;脾脏分泌相关因子可抑制血小板从骨髓释放,同时肝硬化时血小板生成素减少。因此脾切除术后失去对滞留血小板的清除作用,同时血小板巨核细胞在骨髓中增生活跃,导致血小板在循环血中可迅速增加2~6倍[6]。从本组病例可以看出外伤性脾或特发性血小板减少性紫癜行脾切除手术后少见门静脉血栓形成的并发症,但肝硬化门静脉高压脾功能亢进的病人手术后,48例出现门静脉或肠系膜上静脉血栓形成,可见虽然同为脾脏切除手术,脾功能亢进的病人门静脉或肠系膜上静脉血栓形成的发生率明显增高。
当肝门静脉或肠系膜上静脉血栓形成后,导致胃肠道内血液淤滞,造成胃壁、肠壁的水肿,肠道通透性增强且屏蔽功能减弱,菌群移位,内毒素释放入血导致毒血症,严重者可产生大量的腹水,甚至导致肠曲广泛坏死等严重后果。肝脏供血减少,进一步损伤肝脏功能,病情加重者可导致肝衰竭,肝昏迷甚至死亡。同理,术后高血小板血症也易导致下肢深静脉血栓形成,血栓脱落,可导致肺栓塞以致死亡。根据报道[7],外伤脾破裂脾切除术后红细胞压积、血浆黏度增高,因此应以血液稀释为主;目前在临床上预防脾切除术后血栓形成仍采取全身抗凝治疗为主。通过本组治疗得出,脾切除术后动态监测PLT、MPV及凝血功能、D-二聚体、脾脏厚度、门静脉直径,早期给予抗凝及溶栓疗法,是防止脾切除术后血栓形成的有效措施。
门静脉血栓形成是病人行腹腔镜脾切除术后的常见并发症之一,如果不及时治疗,可能导致门静脉血流减少,加重肝功能损害,加重窦前性及窦性肝硬化使门静脉压力增高,消化道再出血风险增加,降低病人术后生活质量。国外文献[8]报道,因肝硬化脾功能亢进行脾切除术后肝门静脉或肠系膜上静脉血栓的发生率约在30%~40%。本研究中,脾切除术后肝门静脉和肠系膜上静脉血栓的发生率为37.7%。
脾切除术后PLT、MPV升高曾被认为是导致门静脉血栓形成的主要因素[9-10]。有报道[11-12]指出,与体积小的血小板相比较,体积大的血小板代谢和酶促反应活跃,含更多的致密颗粒、α-颗粒和活性高的蛋白酶,可促进血小板聚集,易发生凝血。
在正常生理情况下,凝血系统和纤溶系统在血液中保持动态平衡,从而维持血液系统的正常功能。当血液处于高凝状态时,继发纤溶系统亢进。纤维蛋白或纤维蛋白原在纤溶酶的作用下被分解产生的降解物称作纤维蛋白降解产物,是综合反映纤溶亢进的敏感指标。D-二聚体反映继发性纤溶的特异指标是纤维蛋白单体经活化因子Ⅶ交联后再经纤溶酶水解所产生的一种特异性降解产物。由于纤维蛋白降解产物反映了原发性纤溶和继发性纤溶亢进而D-二聚体只反映继发性纤溶亢进且对血栓诊断特异性较差、敏感性较高,因此D-二聚体只能对已发生的血栓具有诊断价值,而不能作为预测血栓形成的指标[13-14]。
通过研究对比抗凝组与非抗凝组,我们发现抗凝药物能显著改善病人血液的高凝状态,明显降低血小板数量及MPV,激活体内纤溶系统对抗血栓形成。最后证实:术后早期应用抗凝药物的确有预防门静脉血栓形成的作用,明显降低病人血栓发生率[15]。
综上所述,腹腔镜脾切除术后病人可以通过检测术后PLT、MPV及门静脉直径及术前脾脏厚度等值标来预测术后PVST的发生风险。对于静脉血栓形成高风险者,术后早期进行预防性抗凝治疗可减少血栓形成发生率,具有重要的临床意义。
