连作和轮作模式下花生土壤微生物群落不同微域分布特征*
2019-08-24姚小东李孝刚丁昌峰韩正敏王兴祥
姚小东 李孝刚,† 丁昌峰 韩正敏 王兴祥
(1 南方现代林业协同创新中心,南京林业大学生物与环境学院,南京 210037)(2 中国科学院土壤环境与污染修复重点实验室(南京土壤研究所),南京 210008)
花生是我国重要的油料作物和经济作物。2 0 1 6 年全国种植面积仅次于油菜,高达4 6 6 万hm2,总产量1571万t,在我国农业生产和农产品出口贸易中占有重要地位[1]。近年来,由于花生产区规模相对集中,常常多年成片、大规模种植,而随着种植年限增加,连作障碍现象普遍发生,导致花生产量降低、品质变劣、生育状况变差以及病虫害严重等诸多生产问题,成为制约我国花生产业可持续发展的重要瓶颈[2]。
花生连作障碍的主要原因可能是,长期单一种植花生导致特定的根系分泌物刺激土壤中病原微生物大量生长并在根部定殖、进而破坏了根组织的正常分化和生理活动,使水分和养分运输不足。同时,长期连作后,根系分泌物进入土壤也会对微生物种群进行特异性筛选,改变群落结构[3]。很多研究认为连作后土壤微生物多样性下降,细菌总量下降而真菌显著上升,连作土壤由“细菌性”转为“真菌性”土壤[4,5]。诸如,尖孢镰刀菌、黑曲霉等真菌、青枯劳尔氏菌均是引起花生土传病害发生的重要病原菌[6,7],然而这些微生物在作物根际微域的分布、丰度与侵染力密切相关,对作物土传病害的发生具有重要影响。但是,已有研究大多未考虑到根际土与根表土中微生物因受根系生理生化影响不同而产生的差异,多数研究中仅聚焦于非根际土壤或根区土,缺乏比较研究,尤其是连作作物根表微生物群落结构特征。此外,除典型病原菌外,连作栽培下根系分泌物对某些真菌类型也有化感诱导作用,如大豆根系分泌物能显著促进粉红粘帚菌的生长,连作太子参根际踝节菌大量繁殖[8, 9]。
近年来,高通量测序被广泛应用于连作障碍研究。研究发现,花生长期连作后引起潜在病原菌如Fusarium sp.、Phoma sp.和Bionectria sp.相对丰度的增加[10]。然而,这些病原菌相对丰度的增加并不能准确表明其在土壤中的实际变化。此外,由于扩增片段短,大量菌群难以鉴定到种,且缺乏实体菌株的获得,限制了进一步实验研究。据此,本研究采用传统分离培养技术和长片段基因克隆方法,通过比较轮作与连作花生根表、根际及非根际微生物数量、可培养微生物种群结构,以期从土壤可培养微生物组成的角度探讨连作花生土传病害高发的微生态机制,从而为解决花生连作障碍问题提供新的科学依据。
1 材料与方法
1.1 试验地概况
试验地位于江西省鹰潭市余江县刘家站一分场典型的丘陵区红壤旱地(116°55′E,28°12′N),花生种植普遍,兼有其他旱地作物类型如西瓜、红薯等。土壤母质发育类型为第四纪红色黏土,年均气温17.6 ℃,年均降水量1750 mm。
1.2 试验设计
于2017年花生播种前期(3月)在区域内选择2种典型的种植模式:1)连作,2012—2017年连续种植花生地块;2)轮作,近年来采用各种旱作物轮换种植的地块。连作花生地块面积约为0.35hm2,花生栽培品种为赣花5号,每年4月上旬播种、7月下旬收获,秋冬季抛荒。轮作地块近5年分别采用花生、西瓜和红薯进行倒茬种植,地块面积约为0.5hm2,2016年种植季为西瓜,同样秋冬季抛荒。
播种前采集2个地块土壤样品,带回实验室分析土壤理化性质,结果如表1所示,轮作和连作土壤有机质、pH、全氮、全磷、全钾及速效养分等均无显著性差异。于2017年4月上旬,2个地块均开始播种花生,品种为赣花5号。花生播种株距10cm,行距50cm,每穴播种2粒。在播种前基施尿素150 kg·hm-2、氯化钾 225 kg·hm-2、钙镁磷肥1125 kg·hm-2;其他管理措施如中耕培土、除草均按常规模式进行。
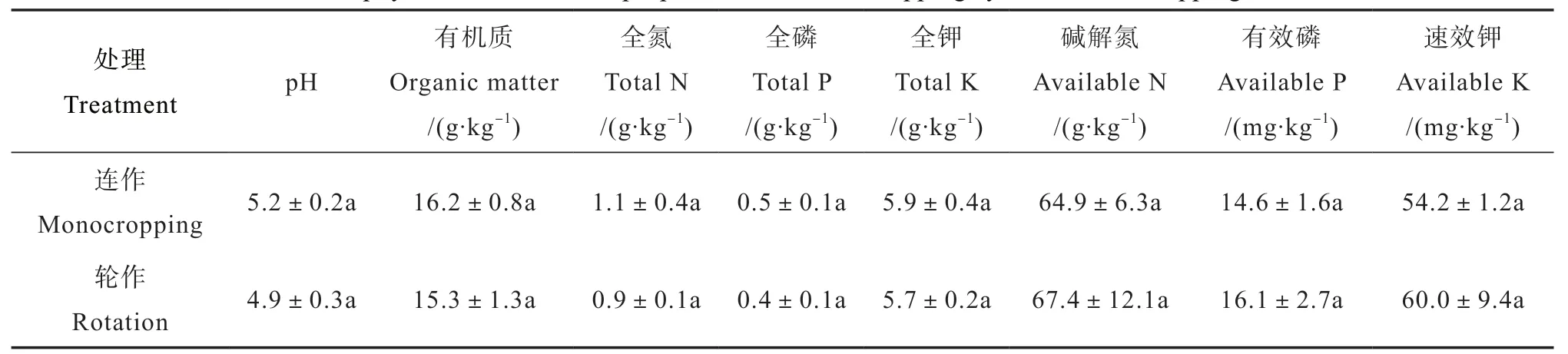
表1 连作、轮作花生土壤主要理化性质比较Table 1 Soil physical and chemical properties relative to cropping systems, monocropping or rotation
1.3 花生生长测定及病害分析
针对花生青枯病的分析策略如下:于2017年6月2日随机5点取样,每点选择20株花生,共调查100株,分0~4级调查花生青枯病发生程度。0为没有症状,1为花生25%以下的叶子萎焉,2为25%~50%叶子萎焉,3为75%以上的叶子萎焉但植株仍然存活,4为整个植株死亡。针对花生根腐病:于2017年7月6日,随机5点调查,每点拔取20株花生,共100株,分0~4级调查花生根部病害程度。0为没有症状,1为25%花生根部发病,2为25%~50%根部发病,3为50%~75%根部发病,4为整个根部发黑,植株死亡。
考种测产:花生收获时(8月5日),每个地块采集5个1 m×1 m的样方,收获花生荚果,折算单位面积的实际产量。同时,测定花生植株各生长指标和根瘤数量。
1.4 土壤样品采样
于花生花针期(6 月2 日)和结荚期(7 月6日),每块样地按5点取样法采集不同微域土壤,每点随机选取3株混合作为一个重复,每个地块共采集5个重复样品用于分析。花生轻轻拔出后,拍打整个根系使得疏松土块全部脱落,利用无菌毛刷收集附在根系表面的土壤作为“根际”土壤。同时,在两行植株中间的无根区域取0~20cm的耕层土壤作为相对的“非根际”土壤。将采过根际土的植株根系剪下称重,置于装有50 mL无菌水的三角瓶中,摇床上100 r·min-1振荡30 min后取出根系,吸水纸吸尽根周围的水分后再称重,2次质量之差即为根表土质量[11];溶解于水中的土壤作为“根表土壤”用于后续分析。其他土壤样品过2 mm筛混匀,去除根系、植物残体以及其他杂质,4 ℃保存,3 d内完成土壤微生物区系测定。
1.5 土壤微生物数量测定
总真菌采用马铃薯葡萄糖琼脂培养基(PDA),总细菌采用大豆酪蛋白琼脂培养基(TSA)。分别采用Nash和Snyder培养基(NS)[12]、TSB培养基(TSB)、Masaago培养基(MAS)[13]、和假单胞菌CFC选择培养基(杭州百思生物技术有限公司),对土壤典型微生物类型进行选择培养。采用平板涂抹法测定各种微生物数量,换算为每克干土所含菌群数量表示。各种微生物具体采用的土壤稀释梯度、培养条件见表2。

表2 用于培养土壤各类微生物的培养基、稀释浓度及培养条件Table 2 Incubation condition, dilutions and media for different cultural microorganisms in soils
1.6 土壤微生物种类鉴定
由于分离、鉴定工作繁重,难以对所有样品进行微生物种类鉴定,本研究主要分离、鉴定花针期花生根表中各种微生物的类型。计数后,在真菌性培养平板上随机挑取典型单菌落于PDA平板上培养,经多次纯化后转入PDA斜面,于4℃冰箱保存。在细菌性培养平板上挑取单菌落,经过平板划线于NA培养基上,37℃培养1~2d,经多次纯化后转入NA斜面,于4℃冰箱保存。纯化的真菌菌株在PDA平板上活化,7d后挑取少量菌丝,液氮研磨,使用试剂盒Ezup柱式真菌基因组DNA抽提试剂盒(上海生工生物工程有限公司)提取DNA。纯化的细菌菌株接种于NA液体培养基,振荡培养24h,收集菌液,采用Ezup柱式细菌基因组DNA抽提试剂盒(上海生工生物工程有限公司)提取DNA。
细菌1 6 S r D N A 采用通用引物2 7 F(5′-A G A G T T T G AT C C T G G C T C A G-3′)和1492R(5′-TACCTTGTTACGACTT-3′)[14],真菌I T S 序列采用通用引物I T S 5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[15]进行扩增测序。4 0 μ L P C R 反应体系包含2×MASTER Mix(20 μL)、模板DNA、正反向引物(10μmol·L-1)各1 μL,ddH2O补足至40 μL。PCR扩增反应程序为,真菌:94℃起始变性5min,94℃变性30s,56℃退火30 s,72℃延伸45 s,32个循环;72℃延伸7 min后4℃保存备用。细菌:94℃起始变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸90 s,32个循环,72℃延伸7 min后4℃保存备用。
将上述的PCR产物送至上海生工生物工程有限公司分析,测序结果提交GenBank数据库,用Blast软件在GenBank数据库进行相似性比对分析。从PDA培养基随机挑选21个克隆,NS培养基13个,MAS培养基9个,TSB培养基15个,TSA培养基41个,CFC培养基21个等用于序列分析;根据每个克隆的测序频度计算对应物种分检的相关丰度。
1.7 数据分析
采用Microsoft Excel和SPSS软件进行数据整理和分析,数据处理结果用平均值及标准差表示(means±SD),采用Dunnett法分析处理间差异的显著性(P<0.05)。
2 结 果
2.1 连作对花生生长及病害发生的影响
在成熟期,轮作种植下花生荚果鲜重和生物量分别为8300 kg·hm-2、14100kg·hm-2,是连作条件下的1.89倍和1.32倍;每株平均有效根瘤数为305,高于连作134.6%。相应的,与连作相比,轮作花生根腐病和青枯病病情指数分别降低58.7%和65.8%(图1)。
2.2 连作和轮作种植模式下花生土壤微生物数量变化规律
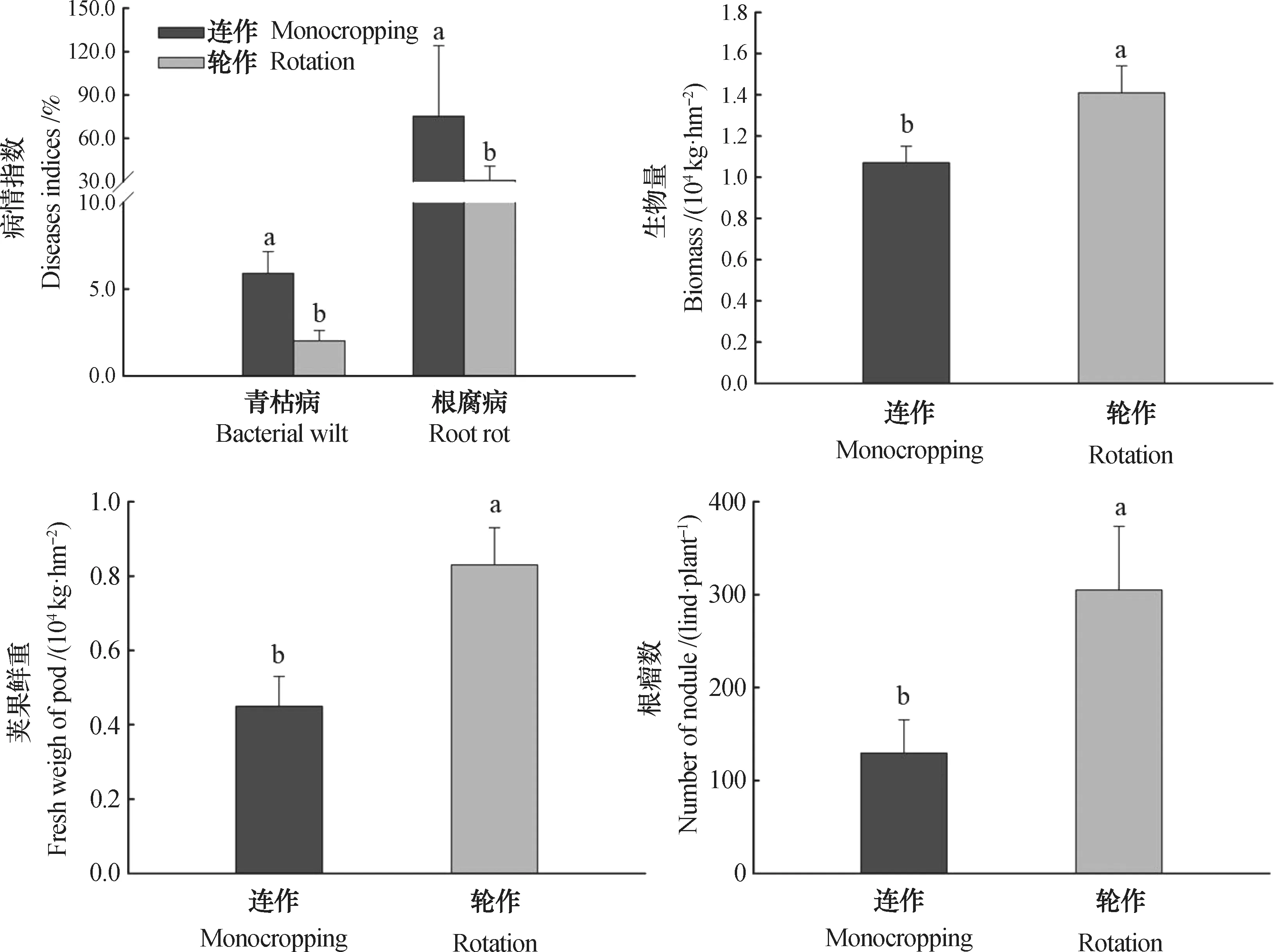
图1 连作、轮作地块花生生长、产量和病害发生情况Fig. 1 Peanut growth,yield anddisease incidencerelative to cropping system, monocropping or rotation
经典可培养技术方法研究表明,与轮作相比,花针期和成熟期连作花生根际微生物明显较高,其中根表真菌数量增加83%~134%,根表细菌数量增加108%(花针期);而对于“非根际”样品,连作与轮作花生之间无显著差异。尖孢镰刀菌的分析结果表明,花针期连作和轮作花生根表其数量无显著差异;而到结荚期,连作花生根表数量高于轮作27.2%(P<0.05)。木霉和疫霉则在连作地块花生“非根际”的数量均显著低于轮作花生;而在花生“根际”和“根表”微域内却呈现出相反的趋势,连作花生根表木霉和疫霉的数量分别较轮作花生增加390.4%~1344.1%和39.9%~76.1%。假单胞菌在“非根际”微域连作花生的数量显著低于轮作;但在“根表”和“根际”微域连作花生显著高于轮作,其中在“根表”区域表现的差异最为显著,增幅达47.1%~227.7%(图2)。
从不同微域花生土壤的变异来看,各类微生物均表现从“根表”到“根际”再到“非根际”逐渐下降趋势,其中“根表”到“根际”下降趋势剧烈,例如真菌数量下降64.6%~97.8%,细菌数量下降73.8%~99.7%。方差结果显示各类微生物从“根表”到“根际”的变异程度均高于“根际”到“非根际”(表3)。
2.3 连作和轮作种植模式下花生根表可培养真菌群落变化
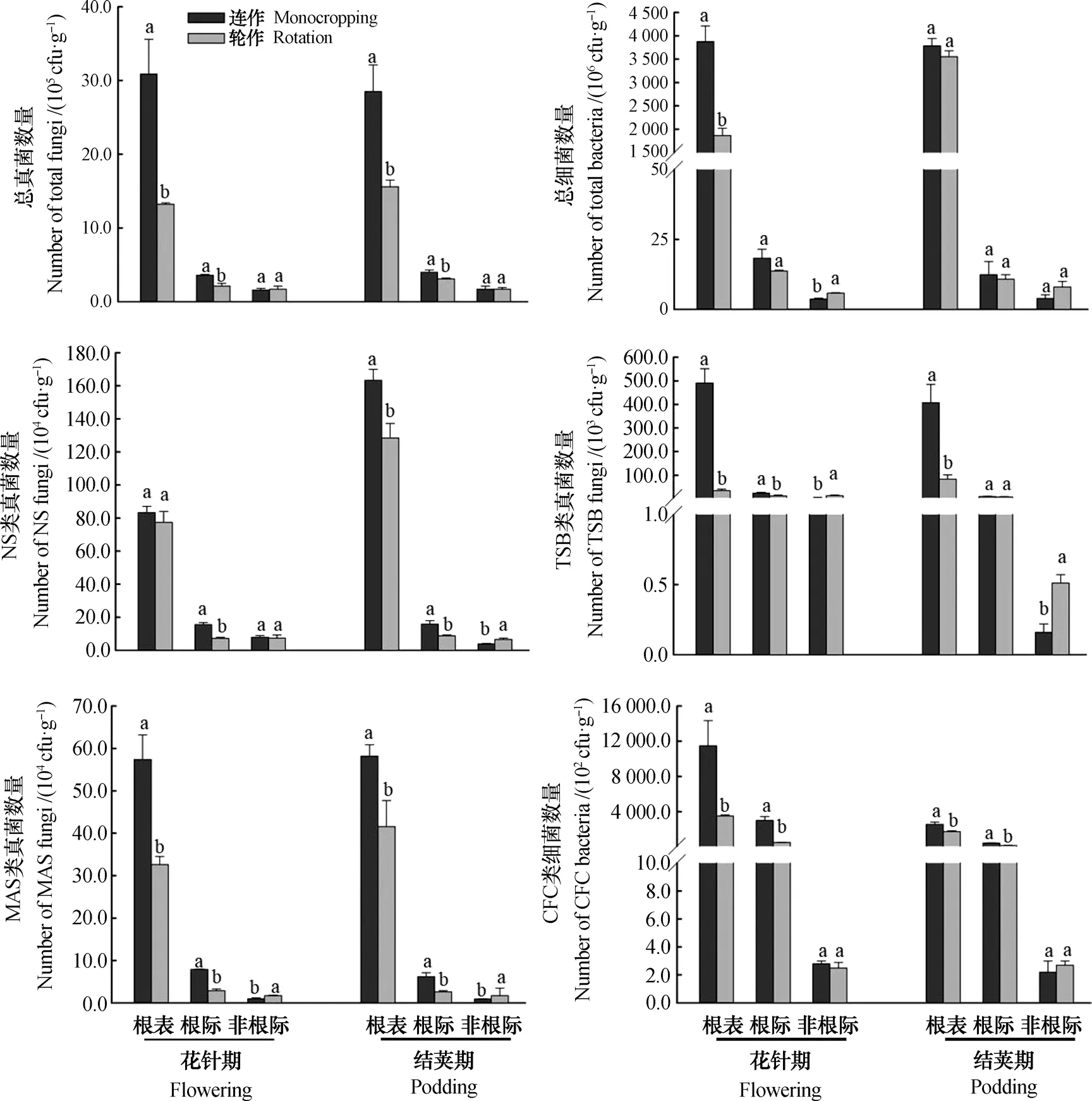
图2 不同培养基下连作和轮作地块花生根表、根际及非根际各类可培养微生物数量Fig. 2 Number of culturable microbes in peanut rhizoplane, rhizosphere and bulk relative to culture medium and cropping system
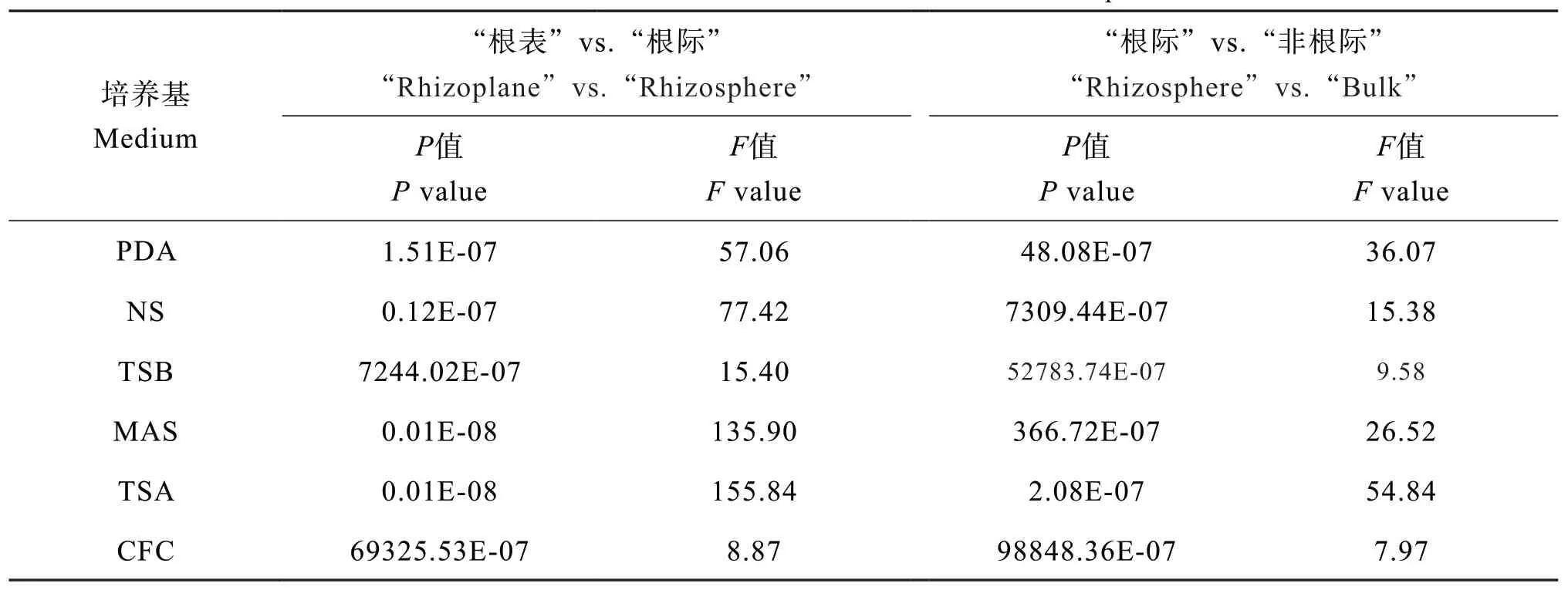
表3 不同微域分布的花生土壤可培养微生物数量的方差比较Table 3 ANOVA of culturable microbes relative to microzonesof peanut soil
由图3可知,青霉属(Penicillium sp.)在轮作与连作花生根表均能鉴定到,连作中以微紫青霉菌(P. janthinellum)和Penicillium s p.2 8 B R O-2 0 1 3 为主,轮作中以微紫青霉菌和Penicillium sp. 196F为主。轮作和连作花生根际均分离出曲霉属(As pergillu s s p.),连作中包括黑曲霉(Aspergillus niger)、烟曲霉(A. fumigatus)和Aspergillus sp. J2;轮作中包括黑曲霉、烟曲霉、Aspergillus sp. J2和Aspergillus sp. BAB-5682,其中连作中黑曲霉丰度较高。粉红粘帚菌(Clonostachys rosea)主要在连作花生根表鉴定到,且丰度高于轮作花生。在连作花生根表鉴定到踝节属中Talaromyces pinophilus、T. verruculosus、T. aculeatus,毛壳菌(C h a e t o m i u m s p. AT T 2 1 0),尖孢镰刀菌(F u s a r i u m o x y s p o r u m)和小球腔菌(Leptosphaeria spegazzinii),但这些真菌类型没有在轮作花生根表分离到,其中连作花生根表踝节属菌丰度较高。相反,茎溃疡病菌(Diaporthe phaseolorum var. caulivora)、毛霉菌(M u c o r s p. F B C C 2 3 1 9)、白地霉(Geotrichum candidum)、木霉菌(Trichoderma gamsii)、卵形孢球托霉(Gongronella butleri)和Didymella molleriana仅在轮作花生根表中鉴定到,其中白地霉在轮作花生根表中丰度较高(图3)。
用于分离镰刀菌选择性培养基(NS)中,除了鉴定到尖孢镰刀菌外,还分离到青霉和白地霉等菌株。木霉选择性培养基(TSB)仅分离到少量的木霉,多数属于踝节菌和曲霉;而在疫霉选择性培养基(MAS)中并未鉴定到疫霉,多数分离为粉红粘帚菌和白地霉(图3)。

图3 不同培养基中连作和轮作花生根表可培养真菌(a)、细菌(b)鉴定及丰度Fig. 3 Identification of cultivable fungi (a) and bacteria (b) and their abundance in the peanut rhizoplanerelative to medium and cropping system
2.4 连作和轮作种植模式下花生根表可培养细菌群落变化
芽孢杆菌(B a c i l l u s s p.)、节细菌(Arthrobacter sp.)和假单胞菌(Pseudomonas sp.)是花生根表中常见类型,其中假单胞菌在轮作花生根表中丰度更高(图3)。连作花生根表节细菌以烟草节杆菌(A. nicotianae)、Arthrobacter sp. 95-0188、分枝节杆菌(A. ramosus)和金黄节杆菌(A. aurescens)为主,而轮作中以嗜烟碱节杆菌(A. nicotinovorans)、Arthrobacter sp. 95-0188和分枝节杆菌为主。连作中假单胞菌只有黄褐假单胞菌(Pseudomonas fulva),轮作中包括Pseudomonas sp. BX2、Pseudomonas koreensis和恶臭假单胞菌(Pseudomonas putida)。
在连作和轮作花生根表中均能分离到生癌肠杆菌(Enterobacter cancerogenus),且丰度差异不明显(图3)。连作花生根际中分离到沙雷氏菌Serratia sp. MIE2、嗜线虫沙雷氏菌(Serratia nematodiphila)、皮氏罗尔斯通氏菌(Ralstonia pickettii)、泛菌(Pantoea sp. 57917)和红串红球菌(Rhodococcus erythropolis),其中沙雷氏菌属(Serratia sp.)丰度较高,但这些细菌在轮作花生根表没有鉴定到。相反,泡囊短波单胞菌(Brevundimonas vesicularis)和溶淀粉类芽胞杆菌(Paenibacillus amylolyticus)均仅在轮作花生根表鉴定到(图3)。用于分离假单胞菌的CFC培养基中,除了鉴定到假单胞菌外,还分离到一些沙雷氏菌、伯克氏菌(Burkholderia cenocepacia)和无色杆菌(Achromobacter xylosoxidans)等。
3 讨 论
连作障碍是很多农作物普遍存在的问题,一般连作后均有可能影响土壤的理化和生物特性,进而影响作物生长及产量。本研究中连作和轮作土壤基本理化性质无显著性差异。同样,研究发现土壤高温灭菌可有效控制连作土壤对作物生长的影响,有的还可明显促进作物生长[16],说明土壤理化因子一般不是造成连作下作物生长受限的主要因素。本研究发现,与轮作花生相比,连作花生根部根瘤数量降低50%以上,进而导致连作花生自身固氮能力和氮素转化的降低[17],这可能是引起连作地块花生生长显著低于轮作地块的重要因素之一。然而,连作花生根部土传病害发生显著上升,这与王明珠和陈学南[18]针对红壤区花生病害调查结果一致,说明花生连作后根系对病原菌的微生态抗性能力显著下降。
根际效应是植物通过根系分泌物的代谢,致使植物根际微生物种类、数量和活性显著高于非根际土壤的现象[19]。而目前关于揭示土壤微生物群落失衡与作物连作障碍发生关系的研究,没有考虑到微生物数量和种群在土壤不同微域分布。从本研究结果来看,无论连作还是轮作花生,各种微生物数量均呈现从“根表”到“根际”再到“非根际”逐渐下降趋势,尤其是从“根表”到“根际”层次下降幅度更加明显。“根表”作为根土界面,其特定的生理代谢活性是影响根际微生物到“根表”定殖的关键因素。例如,Williams和Russo[20]研究发现根部Acidic Exopolysaccharide (EPS)基因的表达是影响根瘤菌附着大豆根表和形成生物膜的重要因素,同时发现根部分泌甘露聚糖可以介导土壤微生物大量附着在大豆根部表面。Kos等[21]也发现微生物的自凝集作用与其附着在根表面物质之间存在密切关系。总体而言,由于根域微生物变化与植物根系分泌物代谢特征关系密切,而根表是受根系分泌物代谢影响最为直接的部位,因此微生物数量在连作和轮作花生“根表”中差异巨大,说明“根表”附着的微生物种群结构与植物健康最为密切相关,未来有关连作障碍的微生物生态研究应着重于作物“根表”,因而针对连作障碍的微生物修复重点也应放在作物“根表”上。
通过对比连作和轮作地块,发现连作花生在“根表”和“根际”层次上的真菌和细菌数量显著较高,而在“非根际”层次无显著差异。与本研究结果有所不同是,一些研究发现连作作物根际土壤呈现细菌数量下降、真菌数量上升的趋势[22]。但也有研究表明连作后植物细菌数量高于轮作[23]。与“根际”相比,连作花生“根表”微生物受根系的影响及对根系的反作用明显增强。这可能因为当根系受到病原微生物侵染发生病变时,根表组织溃烂、分泌物增多,导致根表上细菌、真菌数量与比例发生明显变化。研究发现当病原菌侵染植物根部时不仅引起根际微生物群落组成的改变,还会导致根际生态代谢功能的变化[10,24,25]。Wu等[26]研究结果表明相比于健康三七植株,三七病株的根际微生物总量增加,并且根际微生物群落结构发生改变。而根瘤菌作为根域微生物的重要成员,根表微生物种群的变化可能影响植物结瘤。因此,“根表”微生物数量的急剧增多及组成改变可能是引起连作花生根瘤降低、根部病害上升的重要原因。但是,“根表”细菌和真菌丰度增多与连作花生根部生理代谢功能关系及“根表”根瘤菌种群变化,还需进一步研究。对于“非根际”土壤,由于距离根系相对较远,故而受植物根系分泌物的影响很小,但其他栽培措施可能对其影响较大,这可能是引起连作和轮作地块花生非根际土壤微生物数量无显著差异的原因。对此,本研究从样品采集及分析方法上对“根表”与“根际”土进行区别研究,有助于从更精确的微观分析中发现作物连作障碍发生与微生物生态的关系。
进一步结合分子生物学鉴定来看,相对于轮作花生,连作花生根表中踝节菌(Talaromyces sp.)、黑曲霉(Aspergillus niger)和粉红粘帚菌(Clonostachys rosea)种群丰度较高。其中,黑曲霉是花生土传性病害—冠腐病的病原菌[7];也有研究报道踝节菌在连作太子参中大量繁殖,引起发病[9];粉红粘帚菌是引起大豆根腐病潜在病原菌[9]。而在轮作花生根表中丰度较高的白地霉(Geotrichum candidum),有研究发现其对黄瓜枯萎病菌尖孢镰刀菌的防治具有显著成效[27]。值得注意的是,在镰刀菌选择培养基(NS)中,连作和轮作花生之间的“根表”尖孢镰刀菌数量花针期并无明显差异,但到了花生结荚期,连作花生“根表”尖孢镰刀菌数量明显高于轮作花生,这与收获期连作花生根腐病发病率显著高于轮作的结果一致,表明尖孢镰刀菌可能是花生生长后期根腐病发生的重要病原菌。针对花生根表细菌,连作中沙雷氏菌属丰度很高,而轮作花生根表的优势种群转变成假单胞菌,说明连作花生根表有益细菌数量大幅度下降与植株生长状况密切相关[28]。此外,在鉴定到丰度相对较低的菌株中,连作花生根表中分离到的小球腔菌(Leptosphaeria sp.)、泛菌属(Pantoea sp.)、红球菌(Rhodococcus sp.)和青枯雷尔氏菌(Ralstonia sp.),有报道很多与植物发病有关[29]。相反,仅在轮作花生根表分离到的木霉(Trichoderma sp.)、类芽孢杆菌(Paenibacillus sp.)和短波单胞菌(Brevundimonas sp.)是很多病原菌的拮抗菌,尤其木霉已作为生防菌剂进行应用[30]。由此可见,轮作可能通过改善花生根表微生物结构,增加了有益/拮抗菌群的丰度,有效避免了病原菌在作物根表的定殖,从而降低了花生罹患土传病害的风险。
目前,关于土壤微生物多样性的研究方法已从传统平板培养方法转向为分子生物学方法,尤其是近年来高通量测序技术的普及,其一次性可以对高达数百万的DNA分子序列进行测定,在微生物生态研究中具有数据通量高、微生物组成多样性丰富等优势[31]。同时,也面临着海量数据分析难、测序短不能有效鉴定到“种”、数据库中存在过多未鉴定物种以及实验过程步骤繁琐等问题。本研究采用传统的微生物平板分离并结合分子生物技术,单个菌株可获得更长的基因组片段,对各分离菌株做了更为准确的定位。并且,所分离到的各菌株可用于后续微生物生态功能研究,有助于进一步揭示连作作物根部病害与微生物生态的关系。
4 结 论
花生连作后植株生长受限、根瘤数减少、土传性病害上升,进而导致花生产量降低。与“非根际”土壤相比,“根表”微生物受花生根系生理代谢活动影响最大,因而与连作障碍发生关系密切,是未来连作障碍微生态发生机制研究中重点关注部位。连作后花生“根表”细菌和真菌种群数量持续增多,但有益型微生物的鉴定频度降低,而病原性微生物种群丰度较高,进而导致“根表”微生物生态系统遭到破坏,可能是引起连作下土传性病害大幅上升关键原因。
致 谢 感谢中国科学院南京土壤研究所时玉博士在构建系统进化树中的帮助!
