乙酰辅酶A羧化酶在卵巢癌中的表达与促增殖作用研究
2019-08-24罗剑波邓晓杨
邓 洁,罗剑波,彭 聪,邓晓杨
肿瘤是一种基因病,同时也是一种代谢性病[1-3]。大量研究表明,与正常细胞相比,肿瘤细胞代谢网络发生了显著的改变,主要体现为:糖酵解与脂肪酸从头合成活性的显著增强,以及谷氨酰胺代谢异常活跃[4]。靶向异常改变的细胞代谢网络被认为是良好的肿瘤靶向治疗策略[5-7]。目前,与糖酵解和谷氨酰胺代谢相比,肿瘤细胞的脂肪酸代谢异常受到的关注相对较少[8]。而事实上,肿瘤细胞的快速分裂增殖需要大量的脂肪酸为其生物膜等结构性成份的合成提供原料[9],脂肪酸代谢重编程已被证实在促进肿瘤细胞恶性增殖及转移中发挥着关键的作用[10-11]。
乙酰辅酶A羧化酶(Acetyl-CoA carboxylas 1,ACC1)是参与脂肪酸合成调控第一步反应的关键酶,负责催化乙酰辅酶A羧化生成丙二酰辅酶A。近年来,ACC1被证实在多种类型的肿瘤细胞中表达异常升高,其中包括肝癌、肺癌、乳腺癌与胰腺癌等[12-15],以ACC1为靶点的抑制剂被证实可通过抑制脂肪酸合成而抑制肿瘤细胞的增殖[16-17]。然而,卵巢癌细胞中ACC1的表达与作用尚不十分清楚。本研究旨在探讨ACC1在卵巢癌组织中的表达及其在卵巢癌细胞增殖中的调控作用。
1 材料与方法
1.1 卵巢癌细胞系与组织标本
1.1.1 卵巢癌细胞 卵巢癌细胞系SKOV3购自美国模式菌种收集中心细胞库,细胞培养采用含10%胎牛血清(SV30087,Hyclone,美国)的RPMI-1640培养基(R8758,Sigma-Aldrich,美国),培养箱环境设为37 ℃含5%浓度的CO2。
1.1.2 临床组织标本 共收集10例卵巢癌患者癌与癌旁组织,所有患者具有完整临床资料与明确的病理诊断,并事先签署了知情同意书,术中取得组织后立即置于液氮中保存。
1.2 实验方法和步骤
1.2.1 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR) 首先,用组织RNA提取试剂盒(R6688,美国OMEGA公司)对卵巢癌组织与癌旁组织中总RNA进行提取。随后,用反转录试剂盒(RR037A,日本TAKARA公司)将所提RNA反转录合成cDNA。PCR实验开始前需分别合成目的基因ACC1与内参基因GAPDH的引物,ACC1引物序列为:上游5′-ATGTCTGGCTTGCACCTAGTA-3′,下游5′-CCCCAAAGCGAGTAACAAATTCT-3′;GAPDH序列为:上游5′-ACAACTTTGGTATCGTGGAAGG-3,下游5′-GCCATCACGCCACAGTTTC-3′;用2-△△Ct相对定量法对最终结果进行计算。
1.2.2 Western Blot 首先,用含蛋白酶抑制剂的RIPA裂解液对卵巢癌癌组织与癌旁组织进行裂解以提取总蛋白,并采用BAC法对蛋白浓度进行检测。随后加入商品化的蛋白上样缓冲液并在沸水中煮5 min,按BCA定量结果将相同量的蛋白上样至聚丙烯酰胺凝胶孔中后即可进行电泳分离,待酚蓝至凝胶底部时即可停止电泳。随后将凝胶中蛋白用“三明治”法转移至聚偏二氟乙烯膜表面。膜用5%的BSA溶液室温封闭1 h后,加入稀释过的ACC1抗体(1∶1 000)并于4 ℃冰箱中孵育过夜,PBS洗涤3次(每次5 min)后加入二抗并于28 ℃孵育2 h,继续用PBS洗涤3次(每次5 min)。最后,用ECL发光系统对结果进行分析。
1.2.3 siRNA下调卵巢癌细胞SKOV3中ACC1表达首先由上海吉玛公司合成两条靶向ACC1不同区域的siRNA干涉片段,靶向序列分别为:siACC1#1为CCUACAAUGGGAACAGCUA;siACC1#2为GAACUUAACCGGAUGCGUA。随后,将合成好的siRNA转染SKOV3细胞,方法为:将对数生长期的SKOV3细胞以2×105个/孔的密度种至6孔板中,过夜培养后进行siRNA转染,转染步骤严格按脂质体(lipofectamine 2000,lip2000)操作说明进行。分别将lip2000与siRNA片段用不含血清的RPMI-1640培养液稀释,静止5 min后将二者混和并进行上下颠倒混合,静置25 min后用移液器吸取100 μL并加入6孔板细胞中,随后将细胞置于孵箱中培养,6 h后更换含血清培养基继续培养24 h。此时,细胞即可分别用于四氮唑蓝盐[3-(4,5-diethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-etrazolium inner salt,MTS]增殖、5-乙炔基-2′-脱氧尿苷(5-ethynyl-2′-deoxyuridine,EDU)与凋亡实验。
1.2.4 MTS增殖实验 用“1.2.3”中所述的方法对卵巢癌细胞SKOV3中ACC1表达进行siRNA干涉处理,胰酶消化并离心收集细胞按3×103个/孔的密度接种至96孔板中。分别在第1、2、3、4、5天进行MTS检测,具体操作步骤如下:用移液器将10 μL的MTS工作液加入96孔板中并在37 ℃反应4 h,随后于450 nm处检测吸光值(optical density,OD)。以时间(天)为横轴,OD为纵轴绘制细胞的增殖曲线。
1.2.5 EDU实验 用“1.2.3”中所述的方法对卵巢癌细胞SKOV3中ACC1表达进行siRNA干涉处理,胰酶消化并离心收集细胞按5×104个/孔的密度将细胞接种至共聚焦显微镜专用细胞培养皿中培养过夜后即可进行后续EDU染色实验,染色过程严格按EDU试剂说明书(广州锐博生物公司,货号C10327-1)进行,细胞依次经Triton-X-100打孔、4%多聚甲醛固定后、EDU染色、细胞核复染后,用激光共聚焦显微镜对结果进行观察。以时间(天)为横轴,OD为纵轴绘制细胞的增殖曲线。
1.2.6 细胞凋亡的流式细胞术检测 首先,用“1.2.3”中所述的方法对卵巢癌细胞SKOV3中ACC1表达进行siRNA干涉处理,胰酶消化并离心收集细胞,随后按凋亡试剂盒说明(美国Everbright lnc公司,货号Y6026)对细胞进行Annexin V与PI染色,最后上机进行细胞凋亡的流式细胞术检测。
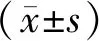
2 结果
2.1 卵巢癌患者癌与癌旁组织中ACC1的表达情况 分别用qRT-PCR与Western Blot对10例卵巢癌患者癌组织与癌旁组织中ACC1的mRNA与蛋白表达水平进行了检测,结果如图1A与1B所示:所有10例卵巢癌患者癌组织中ACC1表达均不同程度的高于癌旁组织(P<0.01),表明ACC1在卵巢癌细胞中的表达发生了显著上调。
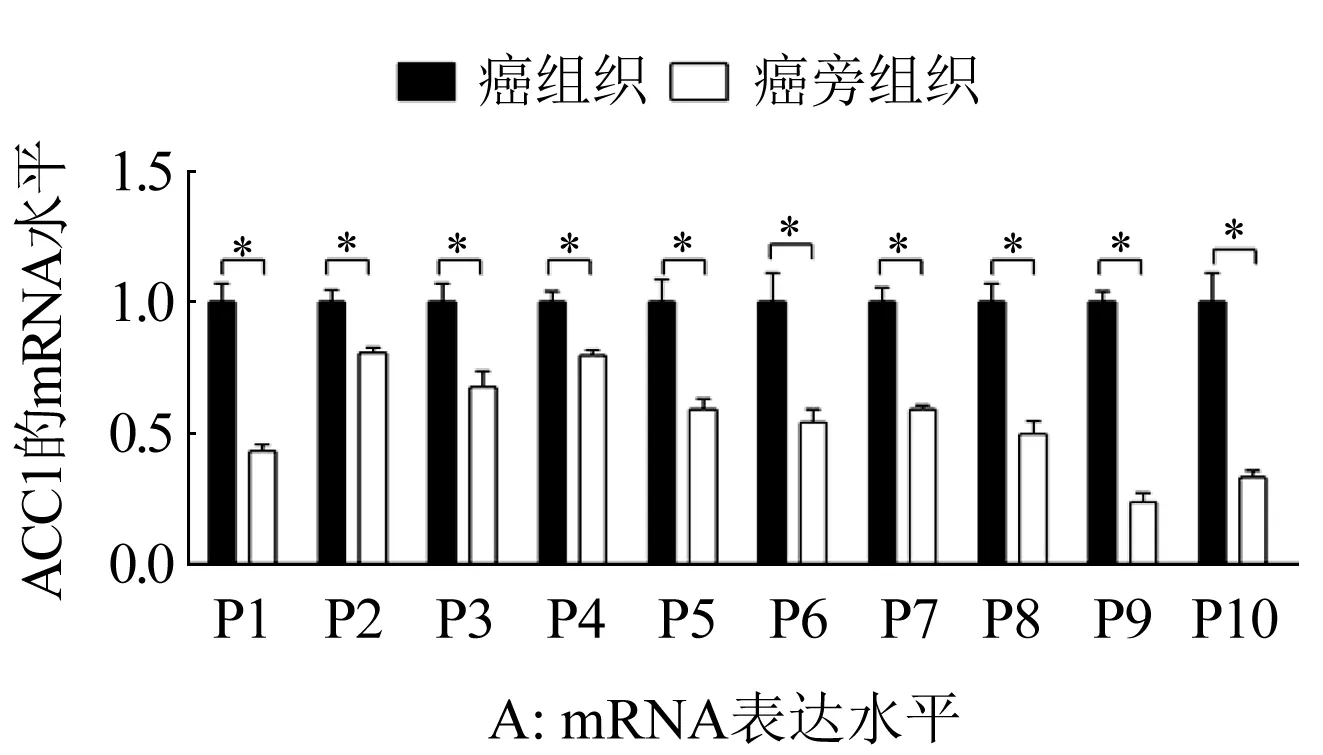
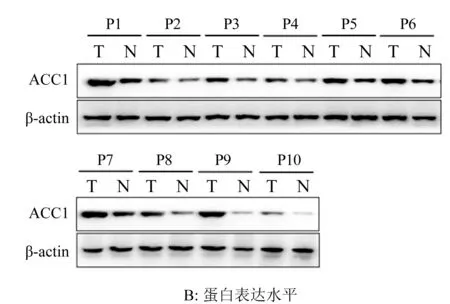
图1 卵巢癌患者癌与癌旁组织中ACC1的表达
2.2 siRNA下调对SKOV3细胞中ACC1表达和细胞增殖的影响 为研究ACC1在卵巢癌细胞增殖中的调控作用,首先合成了2条靶向ACC1不同位置的siRNA干涉片段(分别命名为si-ACC1#1与si-ACC1#2),通过用qRT-PCR与Western Blot分析二者干涉效率后发现(图2A与2B):转染2条siRNA(si-ACC1#1与si-ACC1#2)均可显著下调SKOV3细胞中ACC1的表达(P<0.01),且二者效率相当。
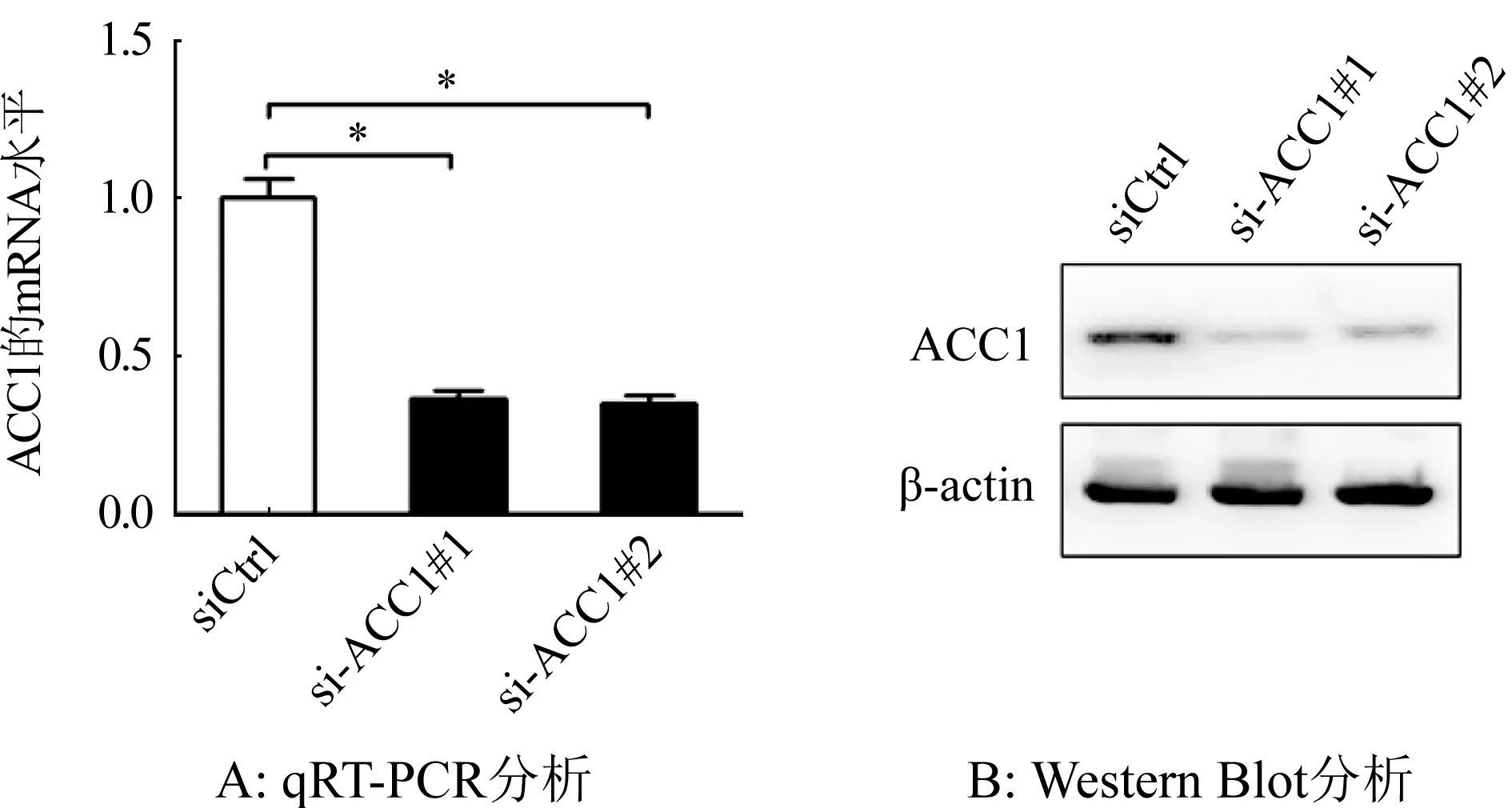
图2 siRNA下调SKOV3细胞中ACC1表达的qRT-PCR与Western Blot验证
用MTS实验分析下调ACC1对卵巢癌细胞SKOV3增殖的影响,结果表明下调ACC1表达后卵巢癌细胞的增殖被显著抑制(P<0.01;图3)。
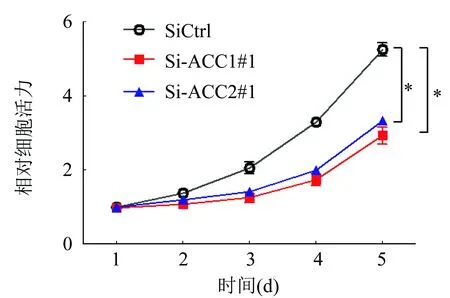
图3 MTS实验分析下调ACC1对SKOV3细胞增殖的影响
利用EDU实验分析下调ACC1对卵巢癌细胞SKOV3增殖的影响,结果与MTS相一致,下调ACC1表达后,卵巢癌细胞的增殖被显著抑制(P<0.01;图4)。
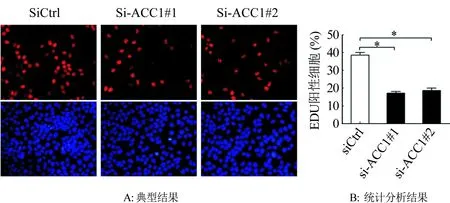
图4 EDU实验分析下调ACC1对SKOV3细胞增殖的影响
2.3 siRNA下调对SKOV3细胞凋亡的影响 进一步又利用流式细胞术分析下调ACC1对卵巢癌细胞凋亡的影响,结果表明下调ACC1表达后,卵巢癌细胞的凋亡未发生显著改变(P>0.05;图5)。

图5 流式细胞术分析下调ACC1对SKOV3细胞凋亡的影响
3 讨论
Cell杂志在2011发表权威综述文章,总结了肿瘤细胞的十大最主要特征,其中包括了肿瘤细胞代谢的重编程[18]。肿瘤细胞代谢重编程的主要表现包括糖酵解、脂肪酸从头合成和谷氨酰胺代谢的异常活跃[19]。而其中,与糖酵解和谷氨酰胺代谢相比,肿瘤细胞脂肪酸代谢受到的关注相对较少。但目前研究已证实,脂肪酸从头合成增强是大多数类型肿瘤细胞所具有的共同代谢特点,在肿瘤发生发展中发挥了重要的促进作用[17,20]。肿瘤细胞通过大量合成游离脂肪酸,为其快速分裂增殖所需的生物膜等结构性成份的合成提供脂类原料[9]。此外,多种脂肪酸衍生物,如溶血磷脂酸[21-22]和人前列腺素[23]等,均是细胞内重要的参与生存、增殖和转移调控的信号分子[11]。
ACC1是调控脂肪酸合成第一步反应的关键酶,催化乙酰辅酶A羧化生成丙二酰辅酶A。近年来,多个研究证实,ACC1在肝癌、肺癌、乳腺癌与胰腺癌中表达均异常升高。Wang等[12]研究发现肝癌细胞中ACC1表达显著上调,ACC1可通过促进肝癌细胞中脂含量储存,而促进能量应激时肿瘤细胞的生存。Svensson等[13]在肺癌中研究也证实,抑制ACC1可通过抑制脂肪酸合成而抑制非小细胞肺癌的生长。Chajes等[14]在乳腺癌中研究也发现,用siRNA下调ACC1可降低细胞内脂肪酸含量,并能诱导乳腺癌细胞发生凋亡。同样,Petrova等[15]研究发现,ACC1在胰腺癌中显著高表达,通过小分子抑制剂抑制ACC1活性后,肿瘤细胞中蛋白质的脂化与脂相关信号均被显著抑制,并最终使肿瘤细胞的增殖变慢。此外,Corominas-Faja等[24]研究发现,用小分子化合物抑制ACC1活性后,乳腺癌干细胞的自我更新被显著抑制。
以往研究表明,卵巢癌中脂类信号分子,尤其是溶血磷脂酸的水平显著升高并调控肿瘤多个恶性生物学过程[25],表明脂代谢异常与卵巢癌发生发展密切相关。然而目前,卵巢癌组织细胞中ACC1等调控脂肪酸代谢关键酶的表达与作用尚不十分清楚。本研究在卵巢癌中发现:ACC1在卵巢癌中表达显著上调;下调ACC1可显著抑制卵巢癌细胞的增殖,而不影响其凋亡。我们的研究结果进一步表明卵巢癌细胞中脂肪酸合成活性异常增强,并提示通过靶向ACC1分子抑制脂肪酸合成可能是潜在的卵巢癌治疗分子靶标。但本研究尚缺乏ACC1对卵巢癌生长与凋亡调控作用的体内实验证据。此外,导致卵巢癌细胞中ACC1表达上调及ACC1调控细胞增殖与凋亡的分子机制仍有待进一步阐明。
