法舒地尔对过氧化氢介导的内皮损伤后TGF-β2及IL-8的影响
2019-08-24肖晨雪金元哲周东晖
肖晨雪,周 霞,金元哲,周东晖
冠状动脉粥样硬化是一种患病率居高不下的常见病,且至今仍无法彻底的探明其所有的发病因素及机制,而氧化应激与炎症被认为在其发病过程中扮演着重要角色。过氧化氢(hydrogen peroxide,H2O2)引起的活性氧(reactive oxygen species,ROS)增加引发的氧化应激能够促进脂质的氧化,使内皮下间隙的低密度脂蛋白(low density lipoprotein,LDL)氧化,进而促进粥样硬化斑块形成[1]。炎性介质也是一个不可或缺的因素。白细胞介素8(interleukin 8,IL-8)可以增强白细胞对血管内皮的粘附力,进而引起内皮损伤,诱发动脉粥样硬化[2]。同时氧化应激损伤能够增加转化生长因子-β2(transforming growth factor-β2,TGF-β2)的生成,进而引起心肌细胞损伤[3]。有研究发现在人晶状体上皮细胞中,糖基化终产物(advanced glycation end products,AGEs)诱导的ROS增加能够促进TGF-β2的生成[4]。
法舒地尔(Fasudil,FH)作为一种新型Rho激酶抑制剂,对于氧化应激与炎性介质有有效的抑制作用。FH可以直接与Rho激酶(Rho-associated protein kinase,ROCK)-CD结合,抑制Rho酶的活性[5],从而减轻ROS诱导的RhoA-ROCK信号通路的异常激活。周中兴等[6]发现FH可以降低球囊损伤后大鼠主动脉血清IL-8的浓度。还有文献提示FH可以有效减少心肌梗死大鼠非梗死心肌细胞中炎性因子TGF-β2的表达[7]。
但目前在血管内皮细胞中,ROS对TGF-β2及IL-8的影响国内少有报道,本研究通过体外应用H2O2诱导细胞发生氧化应激损伤,建立氧化损伤细胞模型,探究氧化应激对血管内皮细胞炎性因子TGF-β2及IL-8的影响以及FH的抑制作用。
1 材料与方法
1.1 材料与设备 细胞株EA.Hy926(广州吉欧姆公司);DMEM高糖培养基、PBS缓冲液(HyClone公司,美国);胎牛血清(Biological Industries公司,以色列)。实验试剂:兔抗GAPDH一抗、羊抗兔二抗(Santa Cruze公司,墨西哥);人IL-8酶联免疫分析试剂盒、人TGF-β2酶联免疫分析试剂盒(Abcam公司,英国);BCA试剂盒(北京致力生物科技有限公司);ROS试剂盒(南京建成生物工程研究所);FH(Selleck公司,美国);超灵敏化学发光底物(Thermo公司,美国);RIPA裂解液(Thermo公司,美国);GADPH(中国康为世纪生物公司);WB曝光仪(型号:Tanon 5200,上海天能科技有限公司)等。
1.2 实验方法
1.2.1 细胞培养 Hy926细胞用含10%胎牛血清的DEME培养液在37 ℃、5%CO2的培养条件下培养,待细胞融合至70%~80%,用胰酶消化,按1∶2传代,选3~6代作为实验用细胞。
1.2.2 氧化损伤模型建立 取对数生长期细胞,按5×104/mL接种于无菌24孔板上,37 ℃、5% CO2培养箱培养24 h,选取细胞融合80%~90%的孔板以30% H2O2诱导细胞2 h后,显微镜下观察细胞状态,PBS清洗,换用完全培养液继续培养细胞[8]。
1.3 实验分组 选融合至80%~90%的培养瓶细胞,胰酶消化,按1∶4传代,待传代细胞生长至70%左右,作为实验分组用细胞。H2O2组(过氧化氢损伤2 h后换用10%FBS培养基37 ℃、5%CO2培养箱中培养细胞48 h);FH干预组(PBS清洗2次氧化损伤细胞,更换为75 nmol/L FH+培养基37 ℃、5% CO2培养箱中培养细胞48 h);单纯FH组(无氧化处理,使用75 nmol/L FH+培养基,37 ℃、5%CO2培养箱中培养细胞48 h);对照组:无处理正常细胞。用倒置相差显微镜观察各组实验细胞生长状况。
1.4 观察细胞的形态及凋亡情况 收集对数生长期的细胞,用含10%胎牛血清RPMI1640培养基将细胞调至2×104/mL,100 μL/孔的量接种于96孔板内,1 mL/孔的量接种于6孔板于37 ℃、5% CO2条件下进行培养。细胞培养12 h后按实验分组处理。处理后的细胞通过吖啶橙/溴乙锭(AO/EB)染色30 s,在荧光显微镜下观察细胞染色情况。
1.5 荧光法测ROS以及ELISA法测氧化产物IL-8、TGF-β2及Western Blot法测RhoA、肌球蛋白磷酸酶靶蛋白-1(myosinephosphatae targeting subunit-1,MYPT-1)的含量
1.5.1 裂解液的制备 收集各组细胞,用冰浴后的PBS洗涤,随后加入RIPA裂解液,低温高速离心(4 ℃,12 000 r/min,15 min),留上清测定蛋白质浓度。
1.5.2 荧光法测ROS 测定孔版加入190 μL各组细胞裂解上清液样本与1 mmol/L的DCFH-DA 10 μL,对照孔则加入等量细胞裂解上清液样本与PBS 10 μL,混匀,37 ℃孵育30 min。于485 nm测定其荧光强度,根据公式“ROS量=荧光强度×190÷200”计算ROS的量。
1.5.3 ELISA法测氧化产物IL-8、TGF-β2 取标准品干粉83 ng溶于83 μL双蒸水中,混匀后取2 μL用双蒸水配制成2 000 pg/mL的标品备用。在酶标包被孔板上设7个标准孔,按浓度梯度为2 000 pg/mL、1 000 pg/mL、500 pg/mL、250 pg/mL、125 pg/mL、62.5 pg/mL、0 pg/mL稀释。待测样品孔中加样品稀释液90 μL及培养基上清液样品10 μL混匀,随后除空白孔外均加入100 μL酶标试剂。混匀后弃去液体,甩干后洗涤4次。随后每孔加入100 μL抗体检测溶液,室温孵育2 h。弃上清洗涤4次后每孔加入100 μL稀释400倍的Streptavidin-hrp溶液,在室温下孵育30 min。弃上清洗涤4次后加入终止液100 μL,于450 nm波长测定各孔光密度(optical density,OD)值。计算待测样品浓度:用标准物的浓度与OD值计算出标准曲线的回归方程,将待测样品孔的OD值代入回归方程,算出待测样品浓度,再乘以稀释倍数,即为待测样品实际浓度。分别测量IL-8、TGF-β2,重复检测实验6次。
1.5.4 Western Blot检测 细胞裂解液经过BCA试剂盒细胞总蛋白经12%SDS-PAGE凝胶电泳分离,然后通过Western Blot转移到孔径为0.2 μm的聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上。经过4 ℃过夜封闭PVDF膜上非特异结合位点后,用5%脱脂奶粉配制的特异性抗体(一抗),稀释度均为(1∶1 000),室温封闭PVDF膜2 h,之后用TBS-T洗去未结合的抗体,再用带有辣根过氧化物酶(HRP)标签的羊抗兔二抗继续室温封闭PVDF膜1 h。然后用TBS-T洗去未结合的二抗,最后用Tanon5200机器曝光。以GAPDH作为内参对照。用GTS图像分析系统分析Western Blot的目的条带。以校正值K对所检测蛋白进行半定量分析。K=样本条带吸光度值/GAPDH吸光度值。
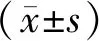
2 结果
2.1 FH对细胞形态影响 单纯H2O2处理显著抑制细胞生长,并出现细胞变小,变圆,没有正常Hy926细胞形态。FH能够抑制H2O2产生的这种现象,但无法逆转,图1。

图1 显微镜下Hy926细胞形态(×160)
2.2 FH对H2O2引发细胞凋亡的影响 AO/EB染色,48 h处理,可见H2O2大量的凋亡细胞出现,而FH干预组细胞虽然也出现了缩小变形,但镜下凋亡的细胞较H2O2组有所下降,图2。

图2 荧光显微镜下Hy926细胞调亡情况(×40)
2.3 FH对H2O2引发Hy926细胞产生ROS影响 与对照组比较,H2O2组ROS明显上升(P<0.01);与对照组比较,FH干预组ROS明显上升(P<0.01);与H2O2组比较,FH干预组ROS下降(P<0.01),图3。
与H2O2组比较,*P<0.01;与对照比较,&P<0.01图3 各组ROS荧光测定结果
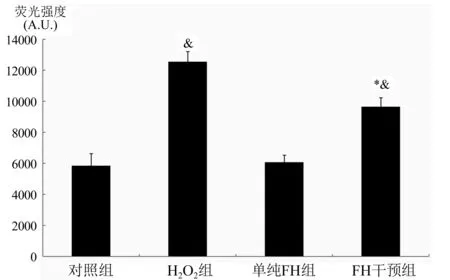
2.4 FH对H2O2引发Hy926细胞产生IL-8能力影响 与对照组比较,H2O2组IL-8明显上升(P<0.01);与对照组比较,FH干预组IL-8明显上升(P<0.01);与H2O2组比较,FH干预组IL-8下降(P<0.01),图4。
与H2O2组比较,*P<0.01;与对照比较,&P<0.01图4 各组IL-8浓度测定结果
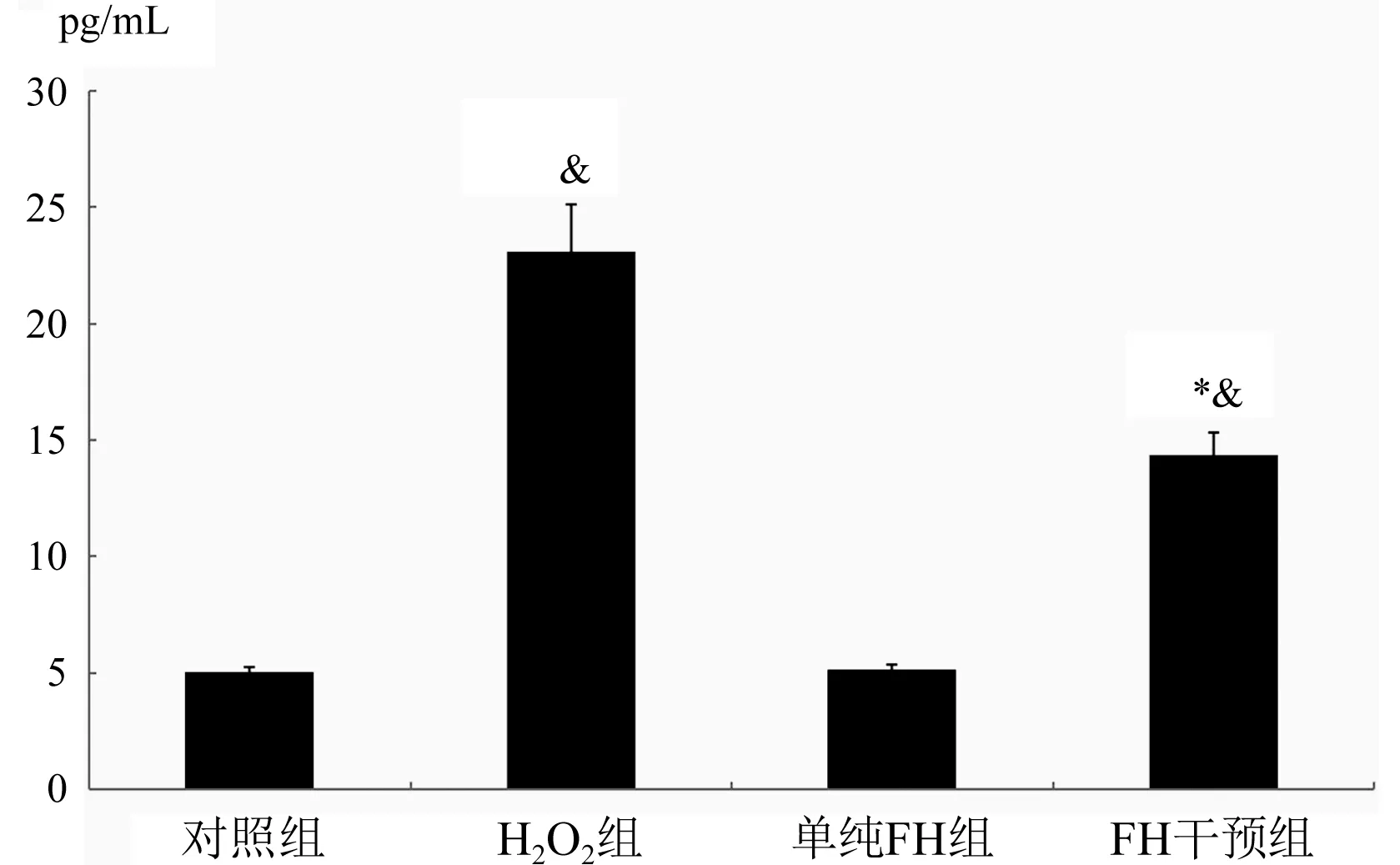
2.5 FH对H2O2引发Hy926细胞产生TGF-β2的影响 与对照组比较,H2O2组TGF-β2明显上升(P<0.01);与对照组比较,FH干预组TGF-β2明显上升(P<0.01);与H2O2组比较,FH干预组TGF-β2下降(P<0.01),图5。
与H2O2组比较,*P<0.01;与对照比较,&P<0.01图5 各组TGF-β2浓度测定结果
2.6 RhoA蛋白表达水平 RhoA蛋白表达水平能够被H2O2激活,而FH具有抑制H2O2激活RhoA蛋白表达的能力,图6。
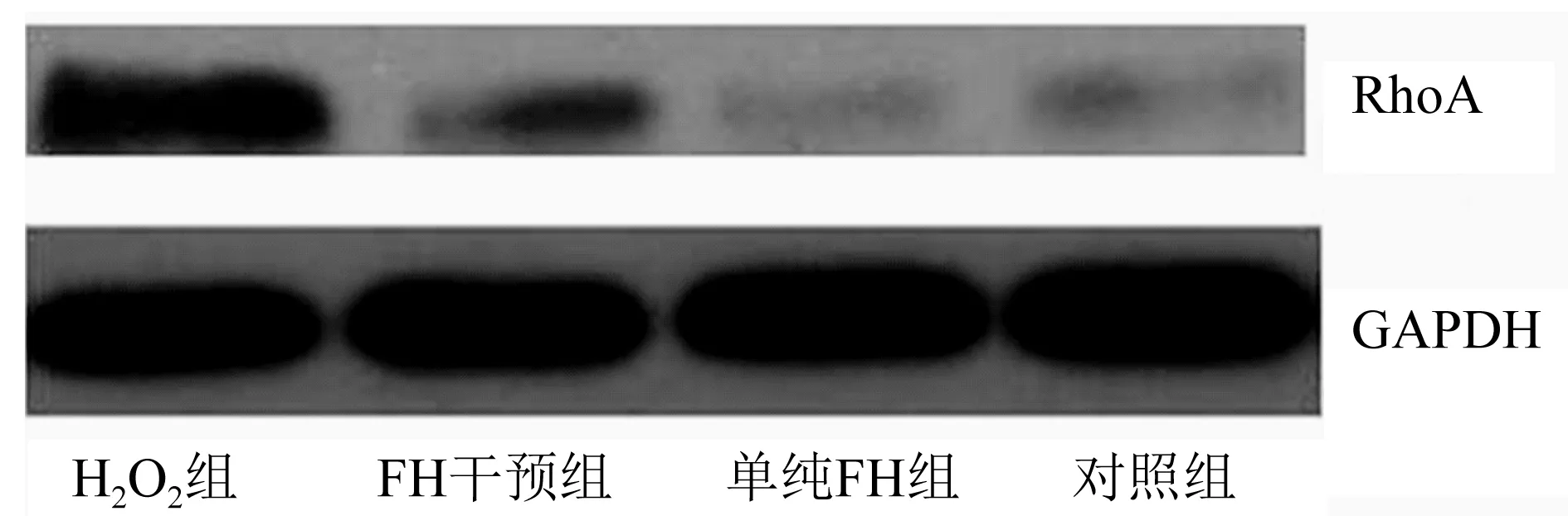
图6 RhoA蛋白表达水平
2.7 MYPT-1磷酸化水平 H2O2损伤组MYPT-1磷酸化较对照组明显升高,FH干预组的MYPT-1磷酸化水平较H2O2组明显下降,说明FH能够抑制H2O2诱导的MYPT-1磷酸化,即抑制RhoA-ROCK信号通路的激活。
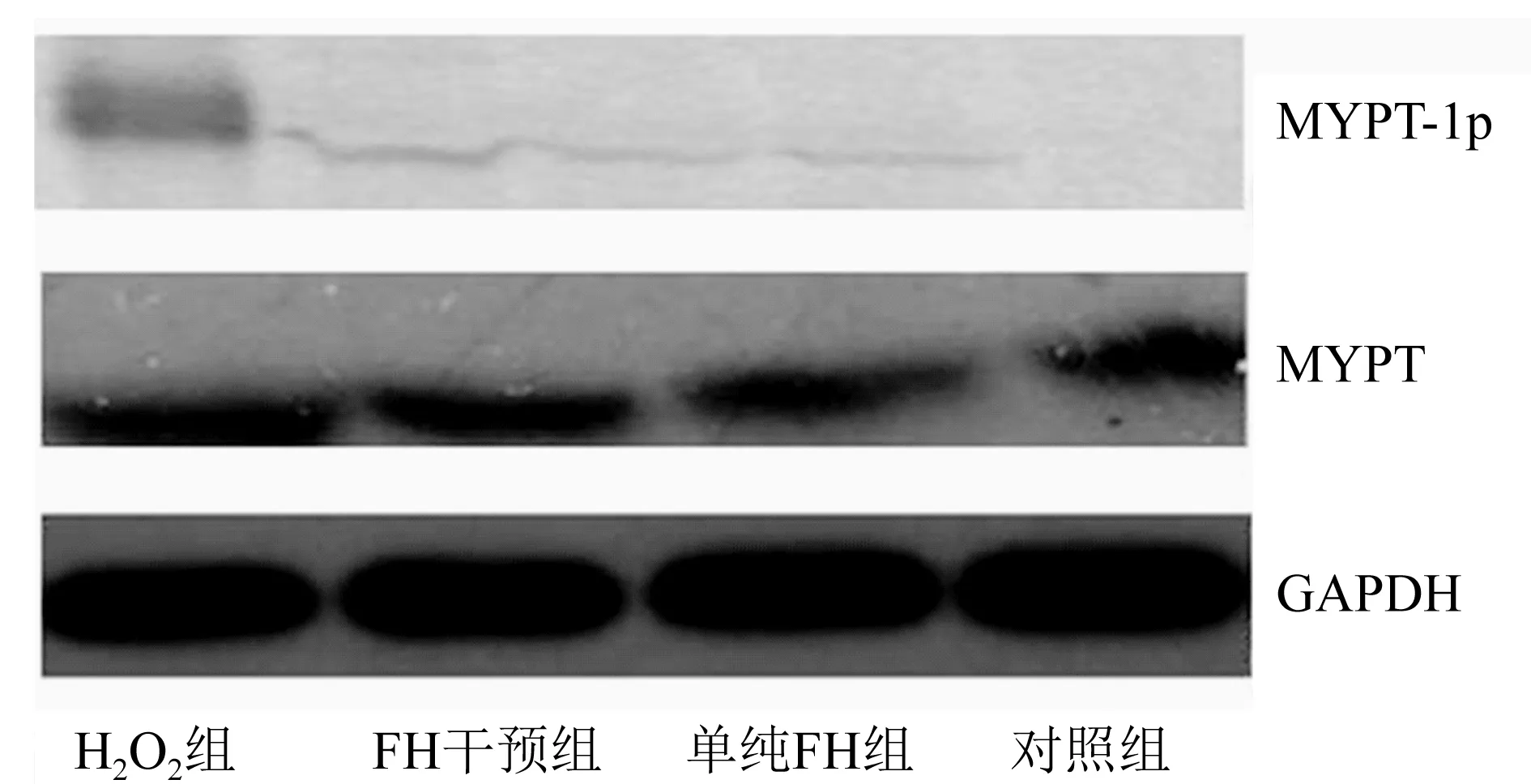
图7 MYPT-1磷酸化水平
3 讨论
抑制氧化应激反应对于预防冠状动脉粥样硬化至关重要。异常增加的TGF-β2可以激活Rho激酶信号通路,进而加剧冠状动脉粥样硬化,IL-8亦可以调节炎性细胞的转移,从而加剧内皮损伤。本研究通过H2O2诱导Hy926细胞发生氧化损伤,比较FH对于氧化应激后早期炎性因子IL-8以及TGF-β2的影响。
有研究已证实FH可以有效拮抗高糖引起的人腹膜间皮细胞的氧化应激引发的细胞损伤[9],但该研究未详细探究相关机制。而另一项研究表明,FH可以通过抑制NF-κB的活性来减弱AGEs引起的细胞凋亡[10]。本研究中FH能拮抗H2O2介导的氧化应激对血管内皮细胞增殖的抑制作用,同时抑制血管内皮细胞凋亡,但无法逆转。提示FH能够有效减轻H2O2导致的氧化应激带来的细胞损伤,可能与FH对NF-κB的抑制作用有一定的关系。但同时在本研究中氧化应激引起的炎性介质TGF-β2及IL-8的异常增加也可能导致细胞的凋亡加速,其具体机制是否与NF-kB有关系尚有待进一步研究。本研究中并未发现FH对正常细胞的增殖有明显的影响,可能与用药时间及用药浓度相关。FH对无异常增殖的血管内皮细胞的影响以及FH对细胞氧化损伤的缓解在其他细胞中是否也有同样的作用仍有待进一步研究。
IL-8是嗜中性粒细胞的一种主要激活剂,多种炎性疾病被证实与其密切相关[11]。在诱导中性粒细胞向受损细胞聚集这一过程中IL-8起着至关重要的作用[12]。在慢性炎性刺激过程中,IL-8可以增加中性粒细胞在内皮细胞上的粘附能力,并诱导其跨内皮转移,引发血管功能障碍和血管疾病,包括动脉粥样硬化、主动脉瘤形成和高血压[2]。有研究指出,ROCK信号通路的激活可以导致IL-8的表达增加[13],从而加重内皮损伤。TGF-β2作为TGF超家族中的一员,其可以抑制巨噬细胞的凋亡[14],而巨噬细胞在早期动脉粥样硬化斑块形成的过程中起到了至关重要的作用。血管平滑肌细胞会因巨噬细胞分泌出Fas配体出现加速凋亡,同时平滑肌细胞的凋亡又反向加速了巨噬细胞的凋亡[15]。因此,当TGF-β2过度表达时,巨噬细胞的凋亡下降,进而加速了冠状动脉粥样硬化斑块的进展。有研究表明,当RhoA-ROCK通路被激活时,可观察到TGF-β2的表达显著增加[16],而TGF家族蛋白的增加还可以反过来通过Rho鸟嘌呤核苷酸交换因子1(ARHGEF1)增强Rho激酶活性[17],从而进一步加剧内皮损伤。本研究结果发现,当H2O2损伤内皮细胞时,IL-8与TGF-β2的含量显著增加,而FH则能够抵抗这种效应,也许与FH对Rho激酶的抑制作用有关。FH对于炎性介质的影响究竟是影响其合成还是在释放的途径有阻断,仍需进一步证实。
MYPT1是平滑肌细胞内肌球蛋白轻链磷酸化酶(myosin light-chain phosphase,MLCP)的一个亚基,而ROCK是一种小G蛋白RhoA的下游效应器。当ROCK被激活时,MYPT1就会发生磷酸化,进而引起MLCP失活、胞内磷酸化肌球蛋白轻链(p-MLC)水平增高[18],引起血管平滑肌细胞功能障碍。因此MYPT1是ROCK信号通路激活的一个标志。还有研究表明ROS亦可以通过ARHGEF1激活RhoA蛋白活性[19],进而激活RhoA-ROCK信号通路,引起大鼠肺动脉收缩。本研究中我们通过MYPT-1的磷酸化程度增加,证实了ROCK信号通路确实被激活。且FH作为一种Rho激酶抑制剂,可以有效抑制氧化应激损伤后导致的细胞凋亡以及炎性介质TGF-β2与IL-8的增加,其机制可能与FH对ROCK信号通路的抑制作用有关,且单纯的FH对于细胞的损伤并不明显。但ROCK的激活是否与ARHGEF1有关联,以及其中具体分子机制有待进一步研究。氧化应激损伤的机制纷繁复杂,本研究仅验证了RhoA-ROCK单一信号通路,FH对氧化应激损伤的抑制作用是否仅有这一种机制本研究尚未证实,其他信号通路是否受影响仍有待进一步研究。且当损伤加剧,FH的作用是否仍然有效尚需更深入的研究。
综上,FH能有效的通过抑制RhoA-ROCK信号通路来减轻H2O2诱导的内皮细胞损伤,这对冠心病等其他心血管疾病的治疗与预防有一定的指导作用。但本研究仅检测了TGF-β2与IL-8这两个产物,而FH对于氧化应激的抑制的更详细的分子机制以及FH对内皮细胞的保护作用还有待进一步研究。
