iNKT细胞联合卵清蛋白对髓源性树突状细胞表型和功能的影响*
2019-08-23郭旭雪聂汉祥陈千慧邓霓姗
郭旭雪, 聂汉祥, 陈千慧, 邓霓姗
(武汉大学人民医院呼吸与危重症医学科, 湖北 武汉 430060)
恒定自然杀伤T细胞(invariant natural killer T-cells,iNKT细胞)是一类独特的T淋巴细胞亚群,活化的iNKT细胞产生Th2和Th1细胞因子,如白细胞介素(interleukin,IL)-4和干扰素γ(interferon-γ,IFN-γ)等,发挥免疫调节作用,因此被认为是一种免疫调节细胞[1]。我们的初步研究表明iNKT细胞可以增强卵清蛋白(ovalbumin,OVA)诱导的哮喘小鼠过敏性气道炎症[2],但具体机制尚不清楚。目前认为树突状细胞(dendritic cells,DCs)是哮喘发生的始动者,可以诱导CD4+Th0细胞向Th2细胞分化,并在维持哮喘Th2反应中发挥重要作用[3]。机体稳定状态下,树突状细胞数量有限,因此经常以髓源性树突状细胞(bone marrow-derived dendritic cells,BMDCs)探讨树突状细胞的表型和功能特征[4]。本实验首先分选OVA诱导的哮喘小鼠脾脏iNKT细胞,检测iNKT细胞联合OVA与BMDCs共培养后BMDCs表面分子和分泌细胞因子的表达水平;同时分选共培养后的BMDCs,检测其与DO11.10转基因小鼠脾脏 CD4+T细胞共培养上清液IL-4和IFN-γ的水平,探讨iNKT细胞联合OVA对髓源性树突状细胞表型和功能的影响。
材 料 和 方 法
1 实验动物与材料
6周龄健康雌性野生型BALB/c小鼠购自武汉大学实验动物中心,6周龄健康雌性DO11.10 OVA特异性MHC II限制性TCR转基因BALB/c小鼠购自美国Jackson实验室,均在无特定病原体(specific-pathogen-free,SPF)环境饲养。卵清蛋白(Grade V)和脂多糖(lipopolysacchride,LPS)购于Sigma;免疫佐剂氢氧化铝凝胶购自Thermo;亲和素连接的辣根过氧化物酶,PE-Cy5标记的TCR-β抗体和同型阴性对照,PE-Cy5标记的F4/80抗体,APC-Cy7标记的CD11c抗体,PE标记的MHC II 、CD80、CD86和CD40抗体,链霉亲和素连接的PE及ELISA试剂盒(IL-12 p70、IL-10、IL-6、TNF-α、IL-4和IFN-γ)均购自eBioscicence;CD1d磁珠、CD11c磁珠和CD4+T细胞分离试剂盒均购自Miltenyi;PE标记的未负载的小鼠CD1d四聚体和PE标记的PBS-57/小鼠CD1d四聚体由美国国家卫生研究院(National Institutes of Health,NIH)赠送。
2 方法
2.1小鼠哮喘模型的制备与脾iNKT细胞的分选 野生型BALB/c小鼠[体重 (20±1) g]于第0和14天腹腔注射OVA 20 μg (含氢氧化铝佐剂2 mg),第25、26和27天腹腔注射1%戊巴比妥钠麻醉,以OVA 100 μg滴鼻激发。末次激发24 h后取哮喘小鼠脾脏,用玻片碾磨,以50 μm尼龙膜过滤,离心后弃上清,用红细胞裂解液裂解红细胞,PBS洗2遍后得到脾单个核细胞(mononuclear cells, MNCs)混悬液。采用免疫磁珠2步法分选获得iNKT细胞,参考试剂说明书操作。简要过程如下,首先向脾MNCs悬液中加入抗CD45R(B220)磁珠,通过MACS分选器阴性选择去除细胞悬液中的B细胞;然后将阴性选择得到的细胞 PE-PBS57/mCD1d四聚体,加入抗PE磁珠,通过MACS分选器进行阳性选择获得iNKT细胞,采用流式细胞术检测脾iNKT细胞(PBS57/mCD1d四聚体+TCR-β+细胞)的纯度。
2.2BMDCs的制备 髓源性树突状细胞的制备参考文献[4],首先将野生型BALB/c小鼠以颈椎脱臼法处死,在无菌环境下分离小鼠股骨和胫骨,冲洗骨髓腔,收集骨髓至离心管,离心后弃上清,用红细胞裂解液裂解红细胞,无血清RPMI-1640洗涤2次后获得小鼠骨髓细胞。随后使用6孔培养板,采用RPMI-1640完全培养基,内含有10%热灭活FBS、10 μg/L rmGM-CSF和10 μg/L rmIL-4,每孔加入4 mL 骨髓细胞悬液(细胞浓度 109/L),置37 ℃,含5% CO2培养箱培养7 d,强力吹打收集贴壁BMDCs,采用流式细胞术检测BMDCs(CD11c+细胞)的纯度。
2.3哮喘小鼠脾iNKT细胞与BMDCs体外共培养 用含10%热灭活胎牛血清、2 mmol/L L-谷氨酰胺、0.1 mmol/L非必需氨基酸、50 μmol/L巯基乙醇、25 mg/L庆大霉素和5×104U/L青霉素的RPMI-1640完全培养基重悬细胞于96孔板中,每孔含BMDCs 2×105个,分别与哮喘小鼠脾iNKT细胞(每孔 4×105个)联合100 mg/L OVA (iNKT细胞联合OVA组)、50 mg/L LPS (LPS组)、iNKT细胞(每孔 4×105个)联合PBS(iNKT细胞联合PBS组)、100 mg/L OVA (OVA组)或PBS(PBS组)在体外培养20 h,收集细胞及培养上清液,分别用于检测BMDCs表面分子和细胞因子水平。
2.4BMDCs表面分子和分泌细胞因子表达水平的检测 首先采用流式细胞术检测各组共培养后的BMDCs表面分子MHC-II、CD80、CD86和CD40的表达水平。树突状细胞表面表达CD11c分子,不表达F4/80分子,因此以CD11c+F4/80-细胞为树突状细胞[5]。取各组培养悬液于离心管中,离心后分离上清液,加入抗小鼠CD16/CD32抗体,4 ℃,避光孵育30 min。分别加入APC-Cy7标记的CD11c抗体和PE-Cy5标记的F4/80抗体,分别向对照管中加入相应的同型阴性对照,4 ℃ 避光 30 min,随后分别加入PE标记的MHC-II、CD80、CD86、CD40抗体或相应的同型阴性对照,4 ℃ 避光 30 min,PBS液洗涤2次,重悬细胞到0.5 mL PBS中,上机检测。随后采用ELISA法检测培养上清液IL-12p 70、IL-6、TNF-α和IL-10的水平,检测方法参考试剂盒说明书。
2.5DO11.10 CD4+CD25-T细胞的分选及与各组BMDCs体外共培养 为了进一步探讨与iNKT细胞联合OVA共培养的BMDCs的功能,分选DO11.10 OVA特异性TCR转基因小鼠脾CD4+T细胞,与共培养后的BMDCs体外共培养。首先取6周龄DO11.10转基因小鼠脾脏,用玻片碾磨,以50 μm尼龙膜过滤,离心后弃上清液,用红细胞裂解液裂解红细胞,PBS洗涤2次后获得脾MNCs混悬液。使用CD4+T细胞分离试剂盒,以磁珠分选法分选DO11.10 CD4+T细胞,按试剂盒说明书进行操作;参考试剂说明书采用CD11c磁珠分选各组共培养后的CD11c+细胞,即为树突状细胞。用含有10%热灭活胎牛血清、2 mmol/L L-谷氨酰胺、0.1 mmol/L非必需氨基酸、50 μmol/L巯基乙醇、25 mg/L庆大霉素和5×104U/L青霉素的RPMI-1640完全培养基重悬细胞于96孔板中,每孔含DO11.10 CD4+T细胞2×106个和OVA(100 mg/L),分别与各组分选的CD11c+DCs(2×105个)在体外培养48 h,收集培养上清液,用于检测IL-4和IFN-γ的水平。为排除各组BMDCs对其与DO11.10 CD4+T细胞共培养上清液IL-4和IFN-γ水平的干扰,以RPMI-1640完全培养基重悬细胞于96孔板中,每孔含各组分选的CD11c+DCs 2×105个和OVA(100 mg/L),体外培养48 h,收集培养上清液,用于检测IL-4和IFN-γ的水平。
2.6DO11.10 CD4+CD25-T细胞分泌细胞因子水平的检测 采用ELISA法检测DO11.10 CD4+T细胞培养上清液和各组共培养后BMDCs培养(无DO11.10 CD4+T细胞)上清液IL-4和IFN-γ的水平,检测方法参考试剂盒说明书。
3 统计学处理
应用SPSS 20.0软件进行统计分析。数据以均数±标准差(mean±SD)表示,各组间比较采用独立样本t检验或单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 髓源性树突状细胞和哮喘小鼠脾iNKT细胞的纯度检测
采用流式细胞术检测免疫磁珠法分选的哮喘小鼠脾iNKT细胞(PBS57/mCD1d四聚体+TCR-β+细胞)纯度,纯度达94.9%,见图1A;采用流式细胞术检测野生型小鼠BMDCs(CD11c+细胞)的纯度达94.5%,见图1B。

Figure 1. The purity of the splenic iNKT cells from OVA-induced asthmatic mice (A) and the bone marrow-derived dendritic cells from naïve WT BALB/c mice (B).
图1 分选哮喘小鼠脾iNKT细胞和髓源性树突状细胞的流式纯度图
2 各组共培养后BMDCs表面分子表达水平的比较
以MHC-II+、CD80+、CD86+和CD40+BMDCs占BMDCs百分比表示BMDCs表型成熟水平[6]。iNKT细胞联合OVA组BMDCs表面分子MHC-II、CD80、CD86和CD40表达水平与LPS组比较差异无统计学显著性(P>0.05),但明显高于iNKT细胞联合PBS组、OVA组和PBS组(P<0.05或P<0.01),见图2和表1。
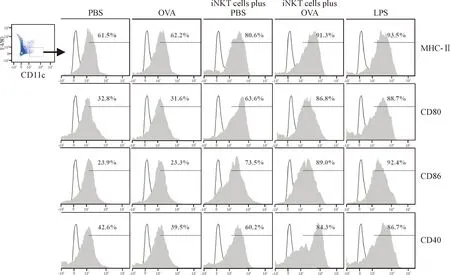
Figure 2. The expression of MHC II, CD80, CD86 and CD40 on BMDCs (CD11c+F4/80-cells) from different BMDC specimens. BMDCs: bone marrow-derived dendritic cells. The percentages on the horizontal lines represent percentages of MHC-II+, CD40+, CD86+and CD80+BMDCs in BMDCs.
图2 各组共培养后BMDCs表面分子表达水平的比较
表1 各组共培养后BMDCs表面分子表达水平的比较
Table 1. The expression of MHC-II, CD80, CD86 and CD40 on BMDCs (CD11c+F4/80-cells) in different BMDC specimens (%. Mean±SD.n=6)

GroupMHC-II+/BMDCsCD80+/BMDCsCD86+/BMDCsCD40+/BMDCsPBS62.6±15.831.9±7.723.2±4.141.0±11.6OVA63.6±16.530.7±7.522.9±4.838.4±10.2LPS94.2±20.1△△∗∗88.8±18.6△△∗∗93.2±21.5△△∗∗89.6±18.3△△∗∗iNKT cells plus PBS80.3±19.4△△62.6±14.5△△74.2±16.7△△59.4±12.8△△iNKT cells plus OVA90.3±21.2△△∗85.5±19.2△△∗∗88.4±20.5△△∗∗82.3±20.1△△∗∗
BMDCs: bone marrow-derived dendritic cells.△△P<0.01vsPBS and OVA group;*P<0.05,**P<0.01vsiNKT cells plus PBS group.
3 各组BMDCs共培养上清液细胞因子水平的比较
以BMDCs体外培养上清液IL-12 p70、IL-6、TNF-α和IL-10的水平表示BMDCs处于功能成熟水平[6]。iNKT细胞联合OVA组BMDCs培养上清液的IL-12 p70、IL-6和TNF-α水平与LPS组比较差异无统计学显著性(P>0.05),但明显高于iNKT细胞联合PBS组、OVA组和PBS组(P<0.01),见表2。iNKT细胞联合PBS组BMDCs培养上清液IL-10水平明显高于iNKT细胞联合OVA组和LPS组(P<0.01),见表2。
4 各组BMDCs与DO11.10 CD4+ T细胞共培养上清液细胞因子水平的比较
以BMDCs与DO11.10 CD4+T细胞共培养上清液IL-4和IFN-γ水平表示iNKT细胞对BMDCs诱导CD4+Th0细胞分化的影响。iNKT细胞联合OVA组BMDCs与DO11.10 CD4+T细胞共培养上清液IL-4水平与LPS组比较差异无统计学显著性(P>0.05),但明显高于iNKT细胞联合PBS组、OVA组和PBS组(P<0.01),见表3。iNKT细胞联合OVA组BMDCs与DO11.10 CD4+T细胞共培养上清液IFN-γ表达水平与LPS组、iNKT细胞联合PBS组、OVA组和PBS组比较差异亦无统计学显著性,见表3。iNKT细胞联合OVA组、iNKT细胞联合PBS组、LPS组、OVA组和PBS组BMDCs培养上清液均未检测到IL-4和IFN-γ。
表2 各组BMDCs共培养上清液细胞因子水平的比较
Table 2. The levels of IL-12 p70, TNF-α, IL-6 and IL-10 in culture supernatants from different BMDC specimens (ng/L. Mean±SD.n=6)

GroupIL-12 p70TNF-αIL-6IL-10PBS0000OVA0000LPS730.5±182.4△△∗∗4 227.4±872.0△△∗∗4 399.5±978.4△△∗∗1 198.4±261.7△△∗∗iNKT cells plus PBS412.3±101.3∗∗1 096.8±271.5∗∗921.6±231.0∗∗3 672.1±878.5∗∗iNKT cells plus OVA694.7±168.7△△∗∗4 016.1±868.4△△∗∗4 411.8±983.5△△∗∗1 032.8±250.2△△∗∗
BMDCs: bone marrow-derived dendritic cells.**P<0.01vsPBS and OVA group;△△P<0.01vsiNKT cells plus PBS group.
表3 各组BMDCs与DO11.10 CD4+T细胞共培养上清液细胞因子水平的比较
Table 3. The concentrations of IL-4 and IFN-γ in culture supernatants from DO11.10 CD4+T cells co-cultured with different BMDC specimens (ng/L. Mean±SD.n=6)
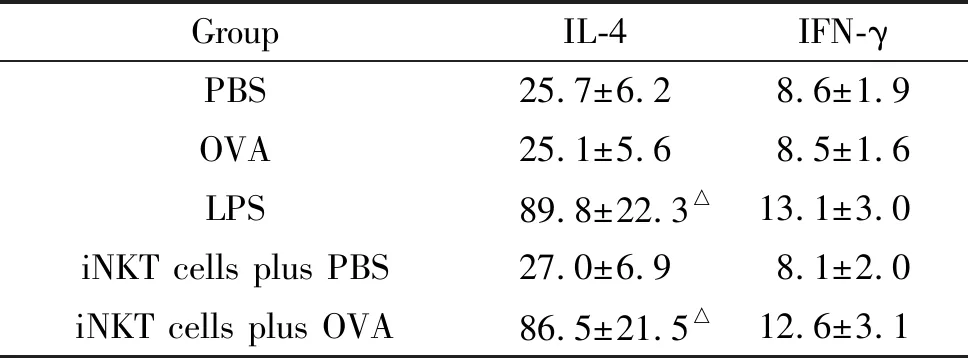
GroupIL-4IFN-γPBS25.7±6.28.6±1.9OVA25.1±5.68.5±1.6LPS89.8±22.3△13.1±3.0iNKT cells plus PBS27.0±6.98.1±2.0iNKT cells plus OVA86.5±21.5△12.6±3.1
BMDCs: bone marrow-derived dendritic cells.△P<0.01vsiNKT cells plus PBS group.
讨 论
iNKT细胞是一群独特的天然淋巴细胞亚群,通过分泌Th1和Th2细胞因子发挥免疫调控功能,在固有免疫系统与获得性免疫系统之间起重要的桥接作用[1]。我们的初步研究显示iNKT细胞可以增强OVA诱导的哮喘小鼠过敏性气道炎症[2],但具体机制尚不清楚。树突状细胞是启动机体免疫应答的关键,在哮喘Th2反应中发挥重要作用[3]。根据表型和功能成熟水平,树突状细胞分为不成熟和成熟树突状细胞[6-7]。树突状细胞表型成熟与其CD80、CD86和CD40等共刺激分子及MHC-II表面分子表达水平有关,而功能成熟与其分泌细胞因子水平和类型有关。成熟树突状细胞高表达MHC-II分子以及CD80、CD86和CD40等共刺激分子,产生IL-12、IL-6和TNF-α等促炎细胞因子,而免疫负相调节因子如IL-10分泌水平下降;成熟树突状细胞可以诱导原始T细胞增殖分化,因此,成熟树突状细胞被认为是免疫原性树突状细胞[6]。与之相反,不成熟树突状细胞表面分子表达水平低,不产生或产生少量促炎细胞因子;不成熟树突状细胞可以诱导T细胞无能。因此,不成熟树突状细胞被认为是耐受原性树突状细胞[6]。机体稳定状态下,树突状细胞数量有限,因此实验研究中经常通过体外诱导小鼠骨髓原代细胞分化获得髓源性树突状细胞并进行其功能和表型研究[4]。本研究通过检测与哮喘小鼠iNKT细胞联合OVA共培养的BMDCs表面分子和细胞因子表达水平及共培养后的BMDCs与DO11.10 CD4+T细胞共培养上清液中IL-4和IFN-γ的分泌水平来探讨iNKT细胞对树突状细胞表型和功能的影响,结果发现存在OVA时,iNKT细胞可以诱导髓源性树突状细胞表型和功能的免疫原性成熟。
本研究发现,野生型小鼠BMDCs与PBS共培养后BMDCs低表达MHC-II、CD80、CD86和CD40等表面分子,培养上清液未检测到IL-12 p70、IL-6、IL-10和TNF-α等细胞因子;同时分选与PBS共培养的BMDCs,与DO11.10 CD4+T细胞共培养,结果发现培养上清液IL-4和IFN-γ水平低下,因此体外诱导的髓源性树突状细胞为不成熟树突状细胞,这与文献报道的结果一致[8-9]。本研究将脂多糖与髓源性树突状细胞共培养作为实验对照组,观察发现LPS组BMDCs高表达表面分子MHC-II、CD80、CD86和CD40,培养上清液中IL-12 p70、IL-6和TNF-α分泌水平升高,与DO11.10 CD4+T细胞共培养后上清液IL-4水平增加,提示脂多糖可以诱导髓源性树突状细胞表型和功能免疫原性成熟。Xu等[10]以脂多糖(1 mg/L)或磷酸盐缓冲液刺激髓源性树突状细胞12 h,结果发现脂多糖刺激的髓源性树突状细胞其表面分子CD80和CD86及培养上清液IL-12 p70、IL-6和TNF-α水平明显高于磷酸盐缓冲液刺激的髓源性树突状细胞,证明脂多糖可以诱导髓源性树突状细胞免疫原性成熟,这与本实验结果一致。本研究观察发现,iNKT细胞联合OVA组BMDCs表面分子MHC-II、CD80、CD86和CD40及培养上清液IL-12 p70、IL-6和TNF-α水平与LPS组比较差异无统计学意义;与DO11.10 CD4+T细胞共培养后上清液IL-4水平与LPS组比较差异亦无统计学显著性,提示iNKT细胞联合OVA共培养的髓源性树突状细胞表型和功能免疫原性成熟。研究中同时发现,iNKT细胞联合PBS组BMDCs表面分子表达水平低于iNKT细胞联合OVA组和LPS组,但高于OVA组、PBS组,同时培养上清液促炎细胞因子水平低而IL-10分泌水平升高;与DO11.10 CD4+T细胞共培养,抑制其产生细胞因子,提示iNKT细胞联合PBS共培养的髓源性树突状细胞耐受性成熟。本研究为排除各组髓源性树突状细胞对其与DO11.10 CD4+T细胞共培养上清液IL-4和IFN-γ表达水平的干扰,分别检测各组BMDCs培养上清液IL-4和IFN-γ的水平,结果发现iNKT细胞联合OVA组、iNKT细胞联合PBS组、LPS组、OVA组和PBS组BMDCs培养上清液均未检测到IL-4和IFN-γ。
综上所述,存在OVA时,iNKT细胞可以诱导髓源性树突状细胞表型和功能免疫原性成熟,而缺乏OVA时,iNKT细胞诱导髓源性树突状细胞耐受原性成熟。Caielli等[11]研究发现,iNKT细胞在存在或不存在“危险因素”时,可以通过激活树突状细胞的不同分子信号诱导树突状细胞免疫原性或耐受原性成熟,从而产生不同的免疫效应,因此iNKT细胞存在功能可塑性。
CD40-CD40L相互作用在树突状细胞成熟过程中发挥重要作用[12]。Caielli 等[11]研究发现,iNKT 细胞在TLR4刺激下与未成熟树突状细胞共培养,可以通过CD40-CD40L相互作用及NF-κB活化诱导树突状细胞免疫原性成熟。因此,iNKT 细胞可能通过CD40-CD40L途径诱导树突状细胞分化成熟。但iNKT细胞与树突状细胞在哮喘发病中的具体相互作用机制仍有待阐述。
本研究证明,iNKT细胞联合OVA可以诱导髓源性树突状细胞表型和功能的免疫原性成熟。树突状细胞是专职的抗原提呈细胞,参与吸入性抗原的摄取、加工和提呈,在哮喘发病的始动、维持阶段均发挥关键作用[3]。因此,我们推测iNKT细胞可能通过诱导树突状细胞表型和功能的免疫原性成熟增强OVA诱导的哮喘小鼠过敏性气道炎症,但需进一步研究。
