黄海西部海域沉积物细菌群落及其对环境因子的响应
2019-08-22黄备邵君波母清林
黄备,邵君波,母清林
浙江省舟山海洋生态环境监测站,浙江 舟山 316021
海洋沉积物是地球上面积最大的覆盖层,约为3.5×108km2,覆盖地球面积的48.6%,是海洋生态系统的重要组成部分,也是地球上最复杂的微生物栖息地。据估计,海底沉积物中的原核生物生物量占全球原核生物生物量的 1/2-5/6,占全球生物总生物量的 1/10-1/3(李涛等,2008)。海洋环境中绝大多数微生物都是处于未可培养的状态,影响了对环境微生物的深入研究(Arakaki et al.,2010)。在众多的微生物中只有不到 1%的微生物能够通过培养的方法分离出来(Gans et al.,2005)。因此,这种传统的平板培养方法只能作为一种辅助工具,需要结合现代生物技术方法才能更客观而全面地反映微生物群落结构的真实信息。
随着近几年分子生物学技术的普及,从 DNA水平研究微生物的多样性已成为当前研究最主要的技术手段,并推动了微生物海洋学的快速发展(Venter et al.,2004)。近年来关于陆架沉积物微生物的研究成为新的热点领域,众多国内学者针对不同区域的海洋沉积物,分别采用不同的分子生物学技术手段开展了研究(Valentina et al.,2018;张东声,2011;杜萍等,2012;王健鑫等,2012;何建瑜等,2013;有小娟等,2013;刘明华等,2015)。
作为西太平洋重要的边缘海,黄海位于中国大陆与朝鲜半岛之间,是一个半封闭的海盆。黄海在全球碳循环和生态系统中起着重要的作用。黄海不仅受到黑潮、东亚季风以及ENSO现象等多种自然气候条件的影响,而且黄海的陆源输入受到长江和黄河的控制,人类活动对长江和黄河的影响也必将给黄海的生态结构造成影响。因此,黄海是研究海洋生态系统演变及其对气候变化和人类活动响应的理想场所。已有研究表明,黄海的海洋生态系统在近几十年发生了很大的变化。由于农业施肥,环境污染,过度捕捞等人类活动的影响,黄海生物多样性减小(刘瑞玉,2004)。近年来不少学者从不同角度对黄海微生物群落开展了调查研究。Zhao et al.(2010)对黄海和东海海域的异养菌数量和初级生产力进行了调查研究,Meng et al.(2011)对黄海西部海域 48个测点的底栖细菌、底栖藻类和微型动物的数量分布及相互关系进行了研究。然而应用现代分子生物学技术手段对黄海沉积物微生物群落组成进行深入调查,并结合沉积物环境因子进行分析研究的相关报道还未曾见到。
本文采用基于Illumina成熟的TruSeq边合成边测序技术的MiSeq高通量测序平台对各站位环境微生物多样性进行了全面深入的调查。并应用多种统计软件等常用群落分析工具,对黄海西部海域微生物群落与环境因子,特别是典型污染物之间的潜在联系进行了深入研究。分析微生物群落的结构和空间差异,发掘与环境的潜在联系,以期为我国黄海沿海地区经济发展与环境管理提供技术支撑。
1 研究方法
1.1 样品采集
在黄海西部海域(124°E以西),设置了19个海域生态监测站位,按纬度从北到南分成A、B、C、和D 4组,每组呈水平分布,各组间隔约纬度1°(图1)。2016年10月利用专业海洋调查船“浙海环监”号,用静力式采泥器采集各站位沉积物。取表层(5 cm层)泥样于灭菌的10 mL冻存管中,-80 ℃冷冻保存并带回实验室。

图1 黄海西部海域采样站位示意图Fig. 1 Sampling sites in the west Yellow Sea
1.2 总DNA提取、测序及序列分析
各站位样品总DNA采用TIANGEN TIANamp Soil DNA Kit试剂盒提取,按标准流程操作。测序样品交由杭州晶佰生物科技有限公司按照16S宏基因组测序标准流程构建环境微生物16S rRNA基因V3-V4可变区(引物序列:341F-CCTACGGGNGG CWGCAG;805R-GACTACHVGGGTATCTAATCC)测序文库并进行相应的质量控制,应用 Illumina MiSeq双末端(250 bp×2)测序平台完成序列测定。测序数据分析、质量控制及相应的生物信息学统计分析参考相关文献方法进行(黄备等,2018)。
1.3 海域底质生态环境监测
海域底质生态环境监测内容包:粒度、石油类、汞、砷、铜、镉、铅、锌、铬、有机碳、总氮、总磷、多氯联笨、多环芳烃、底栖生物生物量和密度。监测采样和分析方法按《海洋监测规范》(GB17378—2007)和《海洋调查规范》(GB12763—2007)进行。
2 结果与讨论
2.1 海域环境因子
按1.3描述的方法开展研究海域环境调查,其中几项主要因子监测结果如表1。
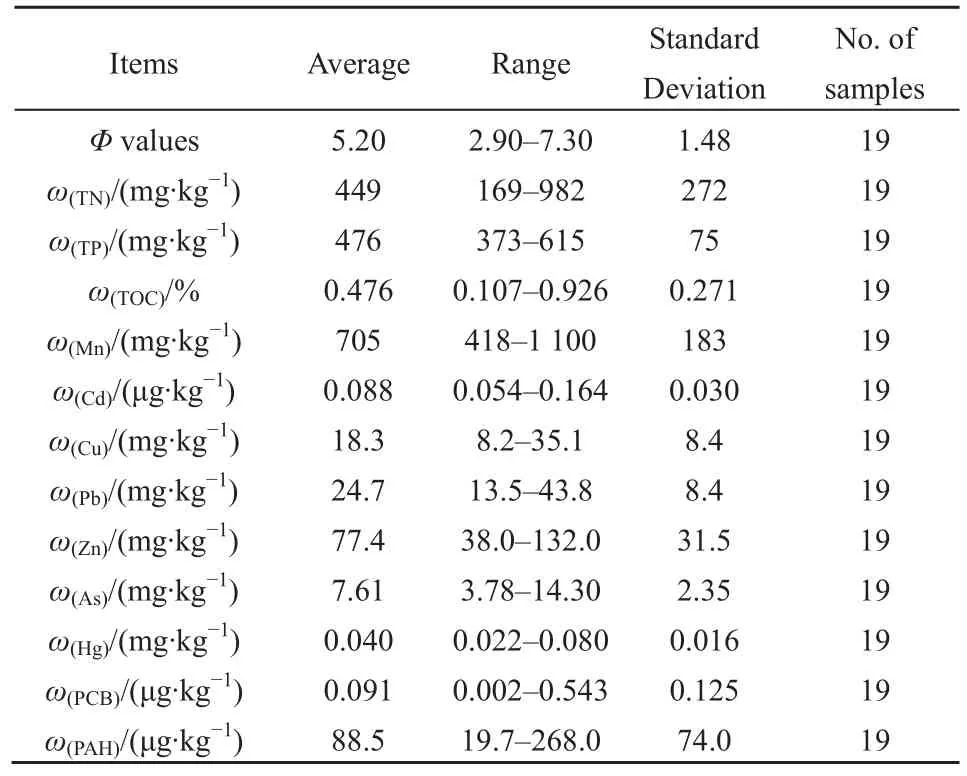
表1 主要环境因子监测结果Table 1 Results of main environmental factors
研究海域沉积物环境因子(粒径、总氮、总磷和总有机碳)的平面分布如图2所示。黄海西部海域沉积物粒径在中央形成明显的细颗粒区,四周离大陆较近的海域沉积物粒径较粗。由于细小颗粒的吸附作用,总氮和 TOC在中央海域形成高值区,沿海海域为低值区。而总磷受沿岸入海排放的影响,在邻近长江口和山东半岛的沿海区域形成两个高值区,在中央海域是总氮的低值区。
黄海西部海域沉积物中多种重金属和有机物的分布图3所示。受沉积物粒径分布的影响,多种重金属和有机物均在黄海中央形成高值区,不过镉和汞在研究海域北部(邻近山东半岛)分别也形成了一个相对高值区,砷和锰在研究海域西侧(邻近江苏沿海)分别形成了另一个高值区。
沉积物中微生物 OTU数量和底栖生物数量分布如图4所示。OTU数量与底栖生物量分布较为相似,均在黄海中央偏南海域形成了高值区,而底栖生物密度在黄海西部和北部海域形成了高值区,东南海域数量较低。
2.2 海域沉积物微生物群落
2.2.1 序列统计
本研究共获得黄海西部海域 19个站位沉积物的微生物原始序列701885对(pair-end reads),站位间序列数介于35200-38866条之间,序列平均长度为422 bp。经质量控制和序列优化,筛选出高质量序列661532条。原始序列通过预处理,按97%序列相似度进行划分,共得到 10925个OTU,其详细分布见表2。
应用 Mothur软件对优化序列进行随机抽样,以抽到的序列数与它们的Chao1指数构建稀释曲线如图5所示。结果显示,各站位曲线均趋向平坦,说明本实验测序数量合理,OTU取样已达到或接近饱和,实验结果基本反映了样品的物种多样性。
2.2.2 微生物种类组成
本研究在黄海西部海域沉积物中鉴定得到古菌和细菌共41门250科442属。从门水平上看,变形菌门(Proteobacteria)在各站位均表现出明显优势,其相对丰度占总数的47%。其它较为丰富的门类包括酸杆菌门(Acidobacteria),放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes),浮霉菌门(Planctomycetes)和疣微菌门(Verrucomicrobia)。各站位门类组成详见图 6。从属水平上看,Gammar变形菌在各站位中均是最主要的优势菌,其它主要种类还有Delta变形菌、拟杆菌(Bacteroides)、黏球菌属(Myxococcus)、黄杆菌属(Flavobacterium)、浮霉菌属(Planctomycetes)和疣微菌属(Verrucomicrobium)等。各站位主要种属组成详见图7。

图4 黄海沉积物中OUT丰度和底栖生物生物量分布Fig. 4 Distribution of microbial OUT abundance and benthos biomass in the west Yellow Sea
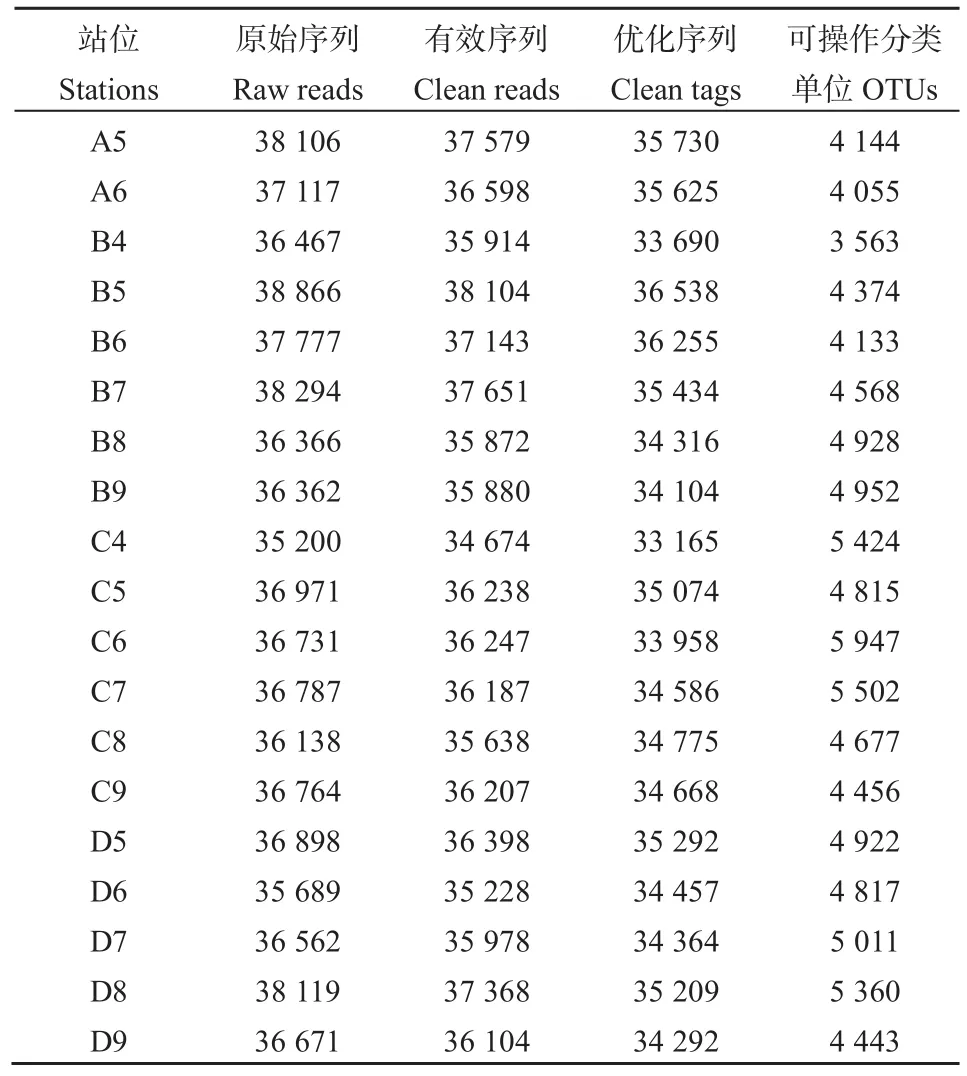
表2 海域沉积物微生物序列信息统计Table 2 Summary of marine sediment microbial sequences
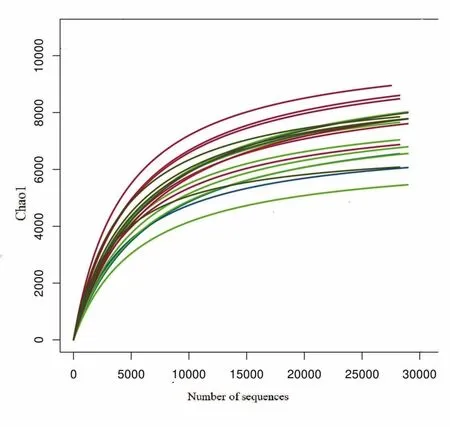
图5 海域沉积物微生物稀释曲线Fig. 5 Rarefaction curves of marine sediment microbes
本文各监测断面呈平行的南北分布,应用属水平的Venn-Diagram图分析各测线微生物群落的差异(图8)。总体上各测线微生物群落比较相似,共有物种占一半以上,共有248个属。4个组均有少数各自特有的物种,其中B组的特有物种最多,共有23属,其次为D组(17属)和C组(8属),A组(4属)相对较少。

图6 海域沉积物微生物种类组成(门水平)Fig. 6 Composition of marine sediment microbes (phylum level)
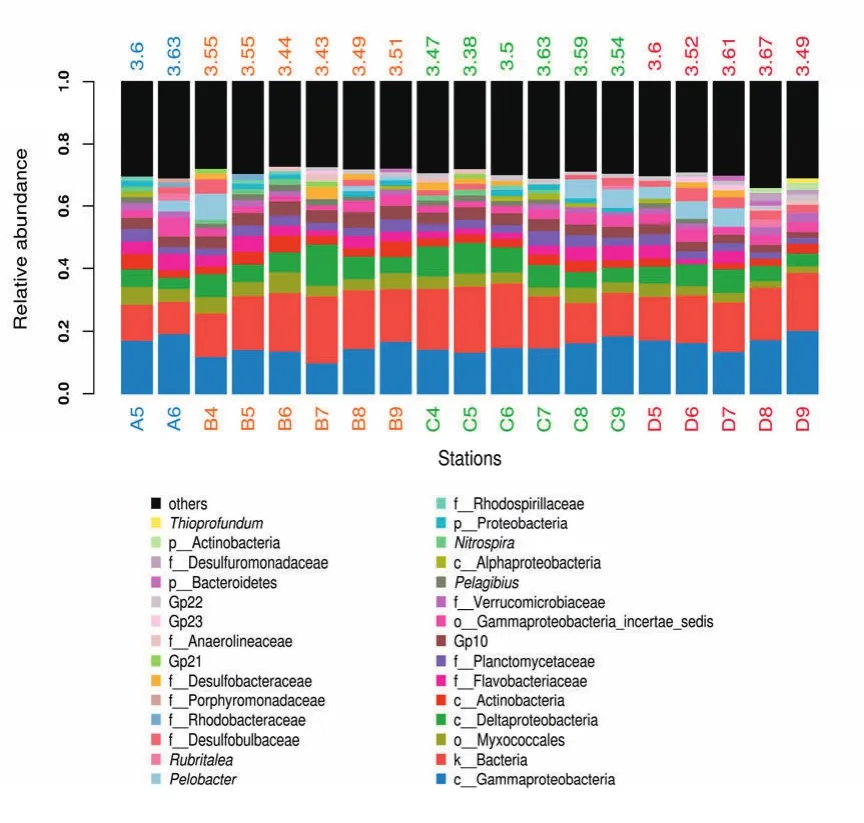
图7 海域沉积物微生物种类组成(属水平)Fig. 7 Composition of marine sediment microbes (genus level)
通过分类树热图来反映研究海域微生物群落组成和物种丰度,图内层是物种分类树,橙色小球表示在各组样品中存在明显差异。在分类树的末端,采用热图的方法,表示样品丰度的大小,颜色越深,丰度越大。如图9所示,变形菌门、拟杆菌门、酸杆菌门和疣微菌门组成了研究海域绝大多数的微生物群落。丰度热图显示各组样品中高丰度微生物组成基本一致,但也有个别例外,如脱硫杆菌(Desulfobulbus)、除硫单胞菌(Desulfuromonadaceae)和火色杆菌(Flammeovirgaceae)的丰度在D组中明显高于其它组;紫单胞菌(Porphyromonadaceae),乳杆菌(Lactobacillus),红小梨形菌(Rhodopirellula)和Dasania在A组中的丰度明显高于其余样品中。
2.2.3 微生物多样性

图8 海域沉积物微生物群落差异分析(属水平)Fig. 8 Differential analysis on sediment microbial community(genus level)
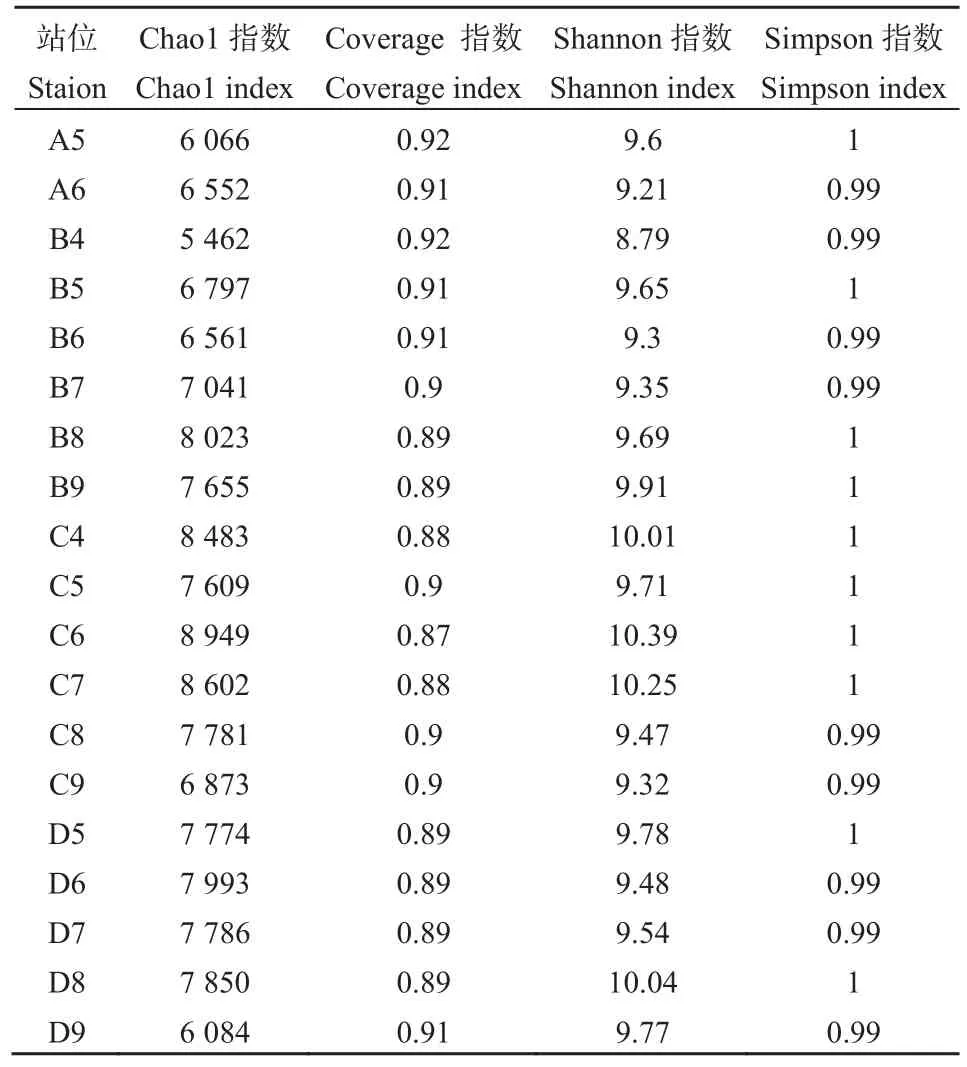
表3 海域沉积物微生物多样性指数Table 3 Biodiversity indices of marine sediment microbes
本研究采用Mothur软件,按97%序列相似水平计算Chao1、Shannon和Simpson多样性指数,并根据Coverage计算结果评估测序深度(表 3)。结果发现,各站位总体菌群丰度指数Chao1指数较高,均值为7365.3,站位间有一定的差异。而反映菌群多样性的 Shannon指数平均为 9.65,Simpson指数平均为 0.995,显示出各站微生物多样性非常高,且站位间差异较大。各站位测序深度指数coverage平均为 0.9,说明各样品文库的覆盖率较高,样本中序列没有被测出的概率极低,进一步证实了稀释曲线的结论。

图9 微生物丰度分类树热图Fig. 9 Taxonomic comparison of microbial abundance by heatmap
PCA分析(Principal Component Analysis),即主成分分析,通过分析不同样品 OTU组成可以反映样品间的差异和距离。从图 10可知,研究海域西侧的D5-D9、A5、B8和C9这几个测点微生物群落比较接近,另外B5-B7微生物群落也非常相似,其余各测点差异相对较大。

图10 海 域沉积物微生物群落PCA图(属水平)Fig. 10 Principal Component Analysis of sediment microbial community(genus level)
2.3 对环境因子的响应
为了直观反映沉积物微生物与环境因子之间的相关关系,本研究应用Past软件,采用CCA分析法进行排序。通过微生物门类多样性与环境因子的相关性进行分析发现,在 CCA排序图中,第一轴和第二轴分别解释了总变异的48%和20.4%(图11),这表明本研究开展的环境因子在较大程度上能够解释沉积物微生物群落的变异。图中圆点代表微生物门类,射线代表环境因子。环境因子的射线越长,表明该因子对研究对象的影响程度越大;而微生物到环境因子垂直距离的长短决定了两者之间的相关性大小,距离越短相关性越大,距离越长相关性越小。从图中可知,总磷和沉积物粒径对微生物门水平的群落分布具有显著性影响。
通过计算微生物门类组成与环境因子间Pearson相关系数并绘制热图分析,发现了总磷、粒径、总氮和 TOC等与一些微生物门类的组成和分布呈现一定的相关关系(图 12)。结果显示,酸杆菌、衣原体(Chlamydiae)和硝化螺旋菌(Nitrospirae)与总磷呈较强的负相关;黏胶球形菌(Lentisphaerae)与铜、锌、多环芳烃、总氮、TOC和粒径呈较强的负相关,硝化螺旋菌与总氮和TOC呈较明显的正相关。反映出这些类群微生物对特征污染物的指示意义,也反映了其对典型污染物的潜在降解或吸附能力。

图11 沉积物微生物组成与环境因子CCA排序Fig. 11 CCA ordination of marine sediment microbial composition and environmental factors
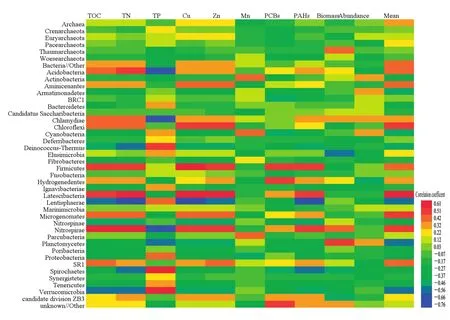
图12 沉积物微生物组成与环境因子Pearson相关系数热图Fig. 12 Pearson correlation of marine sediment microbial composition and environmental factors by heatmap
3 讨论
海洋沉积物是地球上最复杂的微生物栖息地,它是集化学物质和微生物于一体的特殊生态环境,海洋沉积物中蕴藏着丰富的微生物种质和基因资源(秦松等,2006)。作为高压、高盐的特殊生境,沉积物中更可能富集功能特异的微生物类群,有研究表明海洋微生物种类可能高达(Sogin et al.,2006)。海洋沉积物细菌群落是海洋生态系统的重要组成部分,在海洋碳、氮、磷和硫等生源要素的矿化和循环中具有关键作用(Kinghorn et al.,2009)。
众多学者对我国近海沉积物微生物群落进行了研究。孙静(2014)同样利用Illumina Miseq高通量测序技术对我国黄东海近海海域沉积物样品原核微生物群落结构及多样性进行研究。共获得74个门类,变形菌门、浮霉菌门和泉生古菌门所占比例相对较高,分别占总数的44%、11.2%和9%,其中变形菌门在 37个沉积物样品中均是优势类群。更多学者分别利用 PRC-DGGE等相关技术对我国近海海域进行了表层沉积物多样性研究,结果表明变形菌门在黄海、东海、椒江口和胶州湾海域沉积物样品中均是最大的优势类群(宋志刚等,2006;刘欣等,2010;张健等,2010;黄备等,2017)。白洁等(2009)采用16S rDNA文库技术,对黄海西北部海域沉积物不同季节的细菌群落特征进行解析和评价,结果发现沉积物中细菌群落多样性很丰富,包括变形细菌、浮霉菌、拟杆菌、厚壁菌等多个优势细菌门,优势亚群是γ-和δ-变形细菌纲。本研究的结果与上述研究有相似之处,从门水平上看变形菌门在各站位均表现出明显优势,而其它主要门类如酸杆菌门、放线菌门、拟杆菌门和浮霉菌门等在我国近海沉积物微生物群落中均有报道。从属水平上看,Gammar变形菌在各站位中均是最主要的优势菌,这与Liu et al.(2015)对我国北部边缘海沉积物细菌和古菌群落研究的结果一致。Naoki et al.(2009)在Sagami湾研究有机物富集梯度对海洋养殖场沉积物细菌群落的影响时发现:相对污染严重的测点,Gammar变形菌在未受污染影响的测点检出的频率更高;相反地Delta变形菌在受污染测点的相对丰度最高。本研究的测点均位于我国领海基线之外的黄海西部开阔海域,应该说受沿岸影响相对较小,因而Gammar变形菌为最优势的类群,但图2和图3可知,由于多种环境因子的影响,研究海域中央氮、有机碳以及多种重金属和有机物均形成了高值区,黄海西部海域一定程度地受到了沿岸人类活动的影响,Delta变形菌也是微生物群落主要种类之一。
分析海域微生物群落的差异,从属水平的Venn图(图8)可以发现,B组的特有物种最多,共有23属;从海域微生物群落PCA图(图10)可见,B组中B5-B7测点比较接近且与其它测点的距离较远,由此也证实了B组中拥有相对较多的特有物种。众多研究表明,海洋微生物的组成及其多样性与环境温度、季节、深度等环境条件相关(付新华等,2017)。从图2和图3可以发现,B组各测点所在的位置,正好处于多种环境因子(如沉积物粒径、总氮、TOC、镉、铝、锰、铜、锌、多氯联苯和多环芳烃)变化最剧烈的海域。众多环境因子在B组各测点的检测值从低值上升到最高值,特殊的环境条件造成了较为独特的微生物群落。
孙慧等(2016)在余姚滨海采集不同盐碱度的土壤,对土壤微生物群落组成及土壤理化性质的变化规律进行了研究。结果表明:CCA排序表明,全磷对细菌群落的影响程度最大。吴玲等(2017)、钱玮等(2017)采用荧光定量PCR及PCR-DGGE等方法对太湖细菌群落结构进行研究,发现环境中总氮、总磷和总有机质含量是影响水体和沉积物微生物群落丰度的重要因素。与此类似,本研究通过CCA排序分析微生物门类多样性与环境因子的相关性(图 11),研究发现总磷和沉积物粒径对微生物门水平的群落分布具有显著性影响。基于微生物群落与环境因子间Pearson相关系数的热图分析结果呈示(图 12),在研究海域酸杆菌、衣原体和硝化螺旋菌(Nitrospirae)与总磷呈较强的负相关。刘鹄等(2016)在研究水库沉积物营养盐与微生物群落分布状况及迁移转化的相互关系时,通过皮尔逊相关分析发现,Gammar变形菌和Delta变形菌与总磷存在显著的负相关性。这二类微生物正是本次研究最主要的微生物类群,由此也验证本研究关于总磷与多种细菌呈负相关的结果。
4 结论
(1)应用Illumina MiSeq宏基因组高通量测序技术,在黄海西部海域沉积物中鉴定得到古菌和细菌共41门250科442属。其中变形菌门在各站位均表现出明显优势,其相对丰度占总数的47%。其它较为丰富的门类包括酸杆菌门,放线菌门、拟杆菌门,浮霉菌门和疣微菌门。
(2)黄海西部海域一定程度地受到了沿岸人类活动的影响,Delta变形菌成为微生物群落主要种类之一。研究海域中环境因子变化剧烈的区域,拥有较为独特的微生物群落。
(3)通过微生物门类多样性与环境因子的相关性进行分析发现,发现总磷和沉积物粒径对微生物门水平的群落分布具有显著性影响。计算微生物门类组成与环境因子间Pearson相关系数并绘制热图分析,酸杆菌、衣原体和硝化螺旋菌与总磷呈较强的负相关。
