树突状细胞分泌的外泌体对心肌梗死后肝细胞血脂代谢的影响
2019-08-22白英楠李智行张亚琦邵文琦王晓燕刘海波张真中钱三立李冰玉李卓权邹云增钱菊英葛均波
白英楠, 李智行, 张亚琦, 高 微, 邵文琦, 王晓燕, 刘海波, 张真中, 钱三立, 李冰玉, 李卓权, 邹云增, 钱菊英*, 葛均波*
1. 复旦大学附属中山医院心内科,上海市心血管病研究所,上海 200032 2. 同济大学医学院附属东方医院,上海 200120 3. 同济大学医学院,上海 200092
炎性细胞以及造成血管损伤的多种炎性因素已被证明可引发复杂的炎性反应级联,从而产生易损斑块,导致心肌梗死(MI)和卒中等疾病[1-2]。树突状细胞(DCs)是免疫系统的重要部分,参与动脉粥样硬化及其他炎性反应过程[3]。DCs促进早期泡沫细胞的形成,参与脂质代谢的调节和T细胞应答[4]。DCs分泌的细胞外囊泡(EV)分为3种主要类型:内体衍生的外泌体、细胞表面脱落的微泡和凋亡小体;其中,外泌体已成为最受关注的研究对象之一[5]。DCs-外泌体(DEXs)是DCs通过胞吐作用分泌的双膜囊泡,直径为30~100 nm[6]。外泌体含有各种细胞质成分,包括细胞因子、mRNA和microRNA等[7]。研究证明,体内分离的DEXs在注射后会诱发患者的抗肿瘤特异性免疫反应,因此DEXs被认为是由DCs分泌的有益物质,可以产生免疫刺激作用[8]。然而,目前关注DEXs在心血管疾病中作用的研究较少。本课题组前期研究表明,急性心肌梗死(MI)过程中肝脏CD11c+DCs的浸润增加,而梗死心肌中渗入的DEXs会激活CD4+T细胞,并改善MI后的伤口愈合,这为通过DEXs治疗MI提供了新的思路[9]。
另一方面,血脂异常参与动脉粥样硬化和MI的病理机制以及MI后脂质谱的变化也引起了人们的广泛关注。目前普遍认为,高脂血症是动脉粥样硬化发病的关键因素,它可导致包括MI在内的冠状动脉疾病[10]。然而在MI后期,脂质谱的变化相当复杂,MI后血脂异常的机制仍然未知。在肝脏脂质代谢的各种途径中,甾醇调节元件结合蛋白(SREBPs)是涉及脂质合成的转录因子之一[11-12],参与某些疾病的炎性反应过程[13]。SREBPs所涉及的信号转导通路包括受胰岛素信号调节的哺乳动物雷帕霉素靶蛋白(mTOR)-SREBP途径,该途径受到5′-单磷酸腺苷激活的蛋白激酶(AMPK)的抑制[14]。同时,SREBPs在许多疾病的炎性反应中发挥作用,例如Li等发现SREBP-1c在奶牛脂肪肝疾病模型的炎性反应通路过度活化中起重要作用[15];另一项研究表明抑制SREBP通路可通过阻滞炎性反应来抑制肝细胞癌的活动[16]。因此,本课题组设想mTOR-SREBP途径可能参与MI后的血脂异常,即MI后DEXs的存在会导致肝脏中mTOR-SREBP途径改变,从而引起血脂谱的异常,并可能参与心梗后炎性反应。
本研究采用梗死心肌细胞和正常心肌细胞的上清液处理DCs,获取DEXs后用于干预正常肝细胞,然后测量DEXs对肝细胞脂质谱的影响,检测肝细胞中mTOR-SREBP途径的变化,并进一步利用SREBP抑制剂,检测其对肝细胞合成和分泌脂质谱的影响,为未来研究作为潜在治疗靶点的mTOR-SREBP通路提供更多证据。
1 材料与方法
1.1 DEXs的制备和鉴定 雄性C57BL/6小鼠购自上海实验动物研究中心,均以正常饮食喂养,并在清洁条件下饲养。所有动物饲养方案均经复旦大学附属中山医院动物伦理审查委员会批准。首先获取DCs:小鼠骨髓经洗脱后,在含有10 ng/mL粒细胞-巨噬细胞集落刺激因子和1 ng/mL IL-4(美国PeproTech公司)的培养液中培养;48 h后洗去未贴壁的细胞,并每天更换新鲜培养液,在第7天收集DCs用于进一步实验干预。用ExoQuick-TCTM外泌体沉淀溶液(美国System Biosciences Inc.公司)进行DEXs分离:将ExoQuick-TC溶液加入DCs上清液(10 mL,体积比1∶5)后,将混合物在4℃冷藏过夜,并以1 500×g离心30 min;除去上清液后,将沉淀溶于1 mL磷酸盐缓冲液(PBS,美国Invitrogen公司)中,从而获取DCs外泌体(命名为Control-DEX)。所有操作均在无菌条件下进行。通过透射电子显微镜和纳米颗粒跟踪分析仪Nanosight(英国Malvern公司)分别分析外泌体的超微结构和大小分布(图1),采用免疫印迹法测定蛋白质标志物、CD63和Alix等,用于鉴定DEXs。以上实验方案可参见已发表文献[9]。
1.2 模拟MI后心肌细胞微环境 结扎小鼠心脏冠脉左前降支,建立小鼠MI模型。8 h后,在清洁条件下移除小鼠心脏,剪切梗死区及其边缘区组织,PBS溶液洗涤3次以移除血细胞。将该组织继续裁剪,通过Gentle MACS全自动单细胞制备系统(德国Miltenyi Biotec公司)获得单细胞悬浮液,然后离心得细胞上清液,用于模拟MI组中体外心梗的环境。再利用此步骤所得上清液刺激DCs,并按照1.1节实验方案获取心梗特异性DEX(命名为MI-DEX),用于后续研究[9]。

图1 电子显微镜下外泌体的鉴定
1.3 AML12细胞培养并用DEXs干预 α小鼠肝脏12(AML12)细胞系(购自ATCC,编号为CRL-2254TM),由小鼠肝细胞产生。将细胞培养于DMEM培养液和Ham’s F12培养液的1∶1混合物中,所述培养液中含有0.005 mg/mL胰岛素、40 ng/mL地塞米松和10%胎牛血清。使用悬浮于100 μL PBS中的MI-DEX、Control-DEX或MI-DEX+SREBP抑制剂Fatostatin A(HY-14452,美国MedChemExpress公司产品)处理AML12细胞24 h,以进行进一步评估。
1.4 AML12细胞上清液中的脂质谱分析和油红染色 通过自动生化检测仪(Hitachi 7150,日本日立公司产品)、脂质测定试剂盒及酶标测量仪(Tecan酶标仪,Infinite M200 PRO )测量AML12细胞上清液中总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)的浓度。油红O染色评估AML12细胞中的脂质积累。将细胞以2×106个/mL的密度,用4%多聚甲醛溶液固定在载玻片上至少30 min,PBS洗涤并浸入新制备的2%油红O(美国Sigma Aldrich和Merck Millipore公司产品)中,室温下染色25 min。然后将载玻片置于60%异丙醇溶液(美国Invitrogen和Thermo Fisher Scientific公司产品)中洗涤,再用蒸馏水洗涤,最后使用相差显微镜观察染色情况。
1.5 实时荧光定量PCR和蛋白质印迹法分析mTOR-SREBP通路 采用TRIzol试剂[生工生物工程(上海)股份有限公司产品]从AML12细胞中提取总RNA,然后用反转录试剂盒(日本ToYoBo公司产品)将mRNA反转录为cDNA。用SYBR Premix ExTaq试剂盒(日本TaKaRa公司产品)配制实时荧光定量PCR反应体系,然后用ABI 7500实时PCR系统进行测定。小鼠SREBP-1a和SREBP-1c的引物如下:SREBP-1a (Forward) 5′-GGC CGA GAT GTG CGA ACT-3′;SREBP-1a (Reverse) 5′-TTG TTG ATG AGC TGG AGC ATG T-3′;SREBP-1c (Forward) 5′-GGA GCC ATG GAT TGC ACA TT-3′;SREBP-1c (Reverse) 5′-GGC CCG GGA AGT CAC TGT-3′。通过添加有蛋白酶抑制剂混合物(瑞士Roche公司)的RIPA缓冲液裂解AML12细胞,13 680×g离心速度进行离心20 min后,通过SDS-PAGE分离蛋白,然后转移至PVDF膜(美国Bio-Rad公司产品),并与相应一抗和二抗(p-SREBP-1抗体购自美国Cell Signaling Technology公司,mTOR抗体和AMPK抗体购自英国Abcam公司)孵育。通过Quantity One软件计算蛋白质丰度值。将所有结果以相对于GAPDH的表达标准化。

2 结 果
2.1 DEXs干预AML12细胞后的脂质谱变化 结果(表1)表明:与Control-DEX组相比,MI-DEX组肝细胞上清液中LDL-C的水平均明显升高(P=0.047),两组间TC、TG和HDL-C的脂质分布无显著差异(P=0.088,P=0.378,P=0.136)。

表1 DEXs干预后AML12细胞脂质谱的变化 cB/(mmol·L-1)
TG:三酰甘油;TC:胆固醇;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇
2.2 DEXs干预AML12细胞后mTOR-SREBP通路的改变 采用DEXs干预AML12细胞24 h后,通过蛋白质印迹和实时荧光定量PCR分别检测AML12细胞中mTOR、AMPK和p-SREBP-1蛋白的水平(图2A、2B),以及SREBP-1a和SREBP-1c基因的表达(图2C)。结果显示蛋白质印迹和实时荧光定量PCR实验结果相一致:在MI-DEX组中观察到mTOR和p-SREBP-1c蛋白表达水平升高(P<0.05),以及AMPK蛋白表达水平降低(P<0.05),而且SREBP-1a和SREBP-1c基因的表达量均增加(P<0.05)。
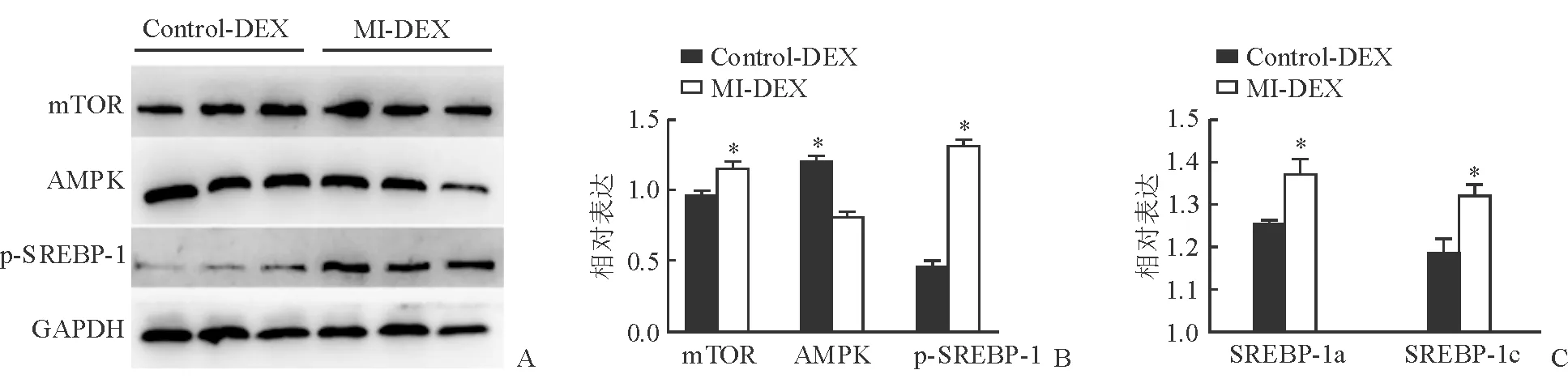
图2 蛋白质印迹法及实时荧光定量PCR检测肝细胞中mTOR、AMPK和p-SREBP-1的表达
A,B:蛋白质印迹法检测肝细胞mTOR-SREBP蛋白表达;C:实时荧光定量PCR测定mTOR-SREBP相关基因表达.*P<0.05与Control-DEX相比
2.3 SREBP抑制剂干预后AML12细胞脂质谱的变化 结果提示:与MI-DEX组相比,加入抑制剂后肝细胞上清液中LDL-C的水平明显降低(P=0.046),而TC、TG和HDL-C的脂质分布没有显著变化(PTC=0.116,PTG=0.092,PHDL-C=0.111)。Control-DEX与Control-DEX+SREBP抑制剂组比较,肝细胞上清液中脂质谱无显著改变(表2)。油红O染色的结果表明,SREBP抑制剂干预不会使肝细胞发生脂肪变性(图3)。

表2 SREBP抑制剂干预后肝细胞脂质谱的变化 cB/(mmol·L-1),
TG:三酰甘油;TC:胆固醇;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇
图3 AML12细胞油红O染色结果
A:Control-DEX处理;B:SREBP抑制剂+Control-DEX处理;C:MI-DEX处理;D:SREBP抑制剂+MI-DEX处理
3 讨 论
本研究发现在不同的脂质谱中,MI-DEX干预肝细胞后其TC和LDL-C合成及分泌功能增强,而mTOR-SREBP信号通路的改变与脂质谱的变化一致,提示这一信号通路可能参与肝脏调节TC的作用。
MI后的血脂异常一直是一个有争议的话题。大多数研究认为,MI后期TC水平会短暂升高[17]。血脂异常,特别是高胆固醇血症和高LDL-C血症,会加重动脉斑块不稳定[18]。因此,研究MI后的脂质谱变化具有重要临床意义。本研究首次发现DEXs可能在MI后血脂异常中发挥作用,其中mTOR-SREBP通路参与调节。本研究的体外实验结果提示,肝细胞内mTOR-SREBP通路异常可能导致MI后高胆固醇血症和高LDL-C血症。因为SREBP与血脂合成有关[19-20],故此通路与小鼠模型中脂质谱的变化紧密相关,未来该途径可能是MI后血脂异常干预的潜在目标。
本课题组前期研究结果表明,DEXs可以激活CD4+T细胞,并改善MI后的心脏功能[9]。然而,本研究结果提示DEXs会导致高胆固醇血症和MI后的高LDL-C血症,这似乎与之前的研究结果相矛盾。本研究结果还提示,MI后的高胆固醇血症可能是通过mTOR-SREBP信号通路来发挥调节作用。因此,DEX引起的MI后血脂异常可能通过抑制mTOR-SREBP途径而改变,从而发挥其保护性作用。对此,本课题组将进行深入研究,如拟在小鼠心梗模型中进一步研究体内MI后脂质谱,以及DEXs干预和SREBP抑制剂对血脂谱的影响等,进一步证明DEXs在MI后脂质谱异常中的作用。总之,本研究为探讨DEXs在MI恢复过程中可能发挥的作用提供了新的视角和研究方向。
本研究仍存在一些局限性。第一,将DEXs视为DC分泌的整体代表,不够严谨。由于DEXs含有各种物质,包括细胞因子、mRNA和microRNA等,因此检测MI-DEXs中各种物质的含量,并找出造成MI后血脂异常的具体因素,有待进一步研究。第二,仅进行了体外细胞实验,缺少动物体内实验等。后续本课题组将进一步行动物体内实验,以证实MI后DEXs在脂质谱变化中的作用,以及mTOR-SREBP途径的变化。
综上所述,本研究发现,来自DCs的外泌体通过调节mTOR-SREBP信号通路,在MI后的高胆固醇血症和高LDL-C血症中发挥重要作用。这为研究DEXs的影响及其对MI后血脂异常的作用机制奠定了一定基础,同时提示mTOR-SREBP信号通路可能作为MI治疗的潜在靶点。
