ERK1/2信号通路的活化与大鼠急性肝衰竭关系的实验研究
2019-08-22孙瑾瑜王盖昊刘亨晶卢利霞翟卫春于晓辉康生朝
孙瑾瑜,王盖昊,郑 英,刘亨晶,李 斌,卢利霞,翟卫春,于晓辉,康生朝
1.中国人民解放军联勤保障部队第九四〇医院消化内科,甘肃 兰州 730050; 2.甘肃中医药大学; 3.中国人民解放军总医院第一医学中心消化内科
急性肝衰竭(acute liver failure,ALF)是由多种因素引起的严重的肝脏损伤,导致肝脏本身的合成、解毒、排泄、生物转化等功能发生严重障碍或失代偿,出现凝血机制障碍、肝性脑病、全身炎症反应综合征,甚至还可迅速发展为严重脑水肿、多发器官衰竭和死亡的一组临床症候群[1]。ALF以起病急、进展快、预后不良为其主要特点,致死率极高,原因之一就是ALF发病机制十分复杂,各种外在或内在因素引发信号通路活化,进而产生炎症级联反应是ALF发生的重要分子机制之一,如糖原合成酶激酶-3β(glycogen synthase kinase 3β,GSK-3β)信号通路[2]、NF-κB信号通路[3]、STAT信号通路[4]等,这些信号通路被活化后均可介导肝细胞发生坏死、变性或凋亡。有研究提示,细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)信号通路参与肝纤维化[5-6]、肝细胞癌[7-8]的发生、发展,也有文献报道,虾青素[9]、黄芩苷[10]及某些蛋白酶[11]可通过下调ERK1/2信号通路发挥减轻肝细胞损伤的作用,间接提示ERK1/2信号通路的活化与肝细胞损伤密切相关。而ALF作为一种严重的急性进展性疾病,大面积的肝细胞坏死是其主要特征,其机制可能与ERK1/2通路的活化有一定关联,故本研究通过检测ALF大鼠肝组织中ERK1/2蛋白和核酸的表达及其磷酸化水平,以深入探讨ALF的发生是否与ERK1/2信号通路的活化存在一定的关系,并为以ERK1/2为靶点治疗ALF新药研发提供一定的实验基础和理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:无特定病原体(SPF)级Wistar雄性大鼠24只,体质量为180~220 g,购自中国人民解放军联勤保障部队第九四〇医院动物中心,饲养在屏障系统中,实行严格的微生物学控制。动物使用许可证号:SYXK(甘)2012-0029。
1.1.2 实验试剂:CCl4溶液(AR级)购自汕头西陇化工厂(批号:20170308);ERK1/2单克隆抗体和磷酸化ERK1/2单克隆抗体均购自美国Cell Signaling Technology公司;Trizol裂解液、反转录试剂盒(RR047A)和qRT-PCR扩增试剂盒(RR820A)购自日本Takara公司。
1.2 实验方法
1.2.1 实验动物分组及一般情况观察:将24只SPF级Wistar雄性大鼠随机分为两组,其中12只为实验组,用CCl4植物油溶液(用麻油1∶1稀释)诱导成ALF模型。另外12只为正常对照组,予同等剂量生理盐水灌胃。期间观察两组大鼠精神状态、活动、饮食、毛发、体质量等。
1.2.2 ALF大鼠模型的建立:Wistar大鼠在动物中心适应性饲养1周,于造模前12 h禁食,正常饮水。按体质量4 ml/kg给予CCl4植物油溶液灌胃诱导建立ALF模型[12],48 h后处死,取肝组织进行病理学观察,依据《肝衰竭诊治指南(2018年版)》关于ALF的病理诊断依据,判断造模是否成功。
1.2.3 标本采集及方法:ALF大鼠造模成功后,于48 h经尾静脉采血1 ml,在低温高速离心机上以3 000 r/min离心15 min,用移液器将上层血清吸出装于EP管中并标记,其后由中国人民解放军联勤保障部队第九四〇医院检验科用速率法检测ALT和AST,用血凝分析仪计算出PTA。其后用10%水合氯醛腹腔麻醉处死大鼠,取肝脏后用生理盐水冲洗干净,一部分迅速在10%甲醛溶液中固定,常规石蜡包埋切片行HE染色,并行病理形态学观察。另一部分立即放入冻存管中,置于-80 ℃的超低温冰箱中冻存,以备用。
1.2.4 检测ALF大鼠肝组织中ERK1/2和pERK1/2蛋白的表达:取ALF大鼠肝组织约100 mg,立即置于1 ml 预冷的组织裂解液,冰浴下充分匀浆,然后于冰上静置30 min,BCA法测定上清液中蛋白浓度。通过Western blotting检测ERK1/2和pERK1/2蛋白的表达,具体操作如下:蛋白上样、电泳(开始80 V,当蛋白Marker电泳至分离胶后调为110 V至蛋白充分分离)、蛋白转膜(PVDF膜),加ERK1/2单克隆抗体工作液(1∶1 000),pERK1/2单克隆抗体工作液(1∶2 000)和GAPDH一抗工作液(1∶2 000)孵育过夜,二抗滴度1∶5 000,室温孵育2 h,TBST漂洗4次,8 min/次,取等量的增强化学发光试剂A液和B液混匀后孵育PVDF膜,压片曝光。
1.2.5 检测ALF大鼠肝组织中ERK1/2 mRNA的表达:将肝组织匀浆,Trizol法抽提总RNA,选用SYBR green混合液,在荧光定量PCR仪上检测ERK1/2的核酸表达水平。根据样品的Ct值,以β-actin为内参,使用qRT-PCR的相对定量法,用RQ值表示ERK1/2 mRNA在组织中的相对表达量。△△Ct值=实验组(ERK1/2基因Ct值-β-actin基因Ct值)-正常对照组(ERK1/2基因Ct值-β-actin基因Ct值),引物序列如表1所示。

表1 ERK1/2引物序列表Tab 1 ERK1/2 primer sequence list
注:PCR反应条件:94 ℃预变性5 min,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 1 min,30个循环后,72 ℃延伸5 min。
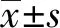
2 结果
2.1 ALF大鼠一般情况正常对照组大鼠精神状态佳,活动和饮食正常,毛发整齐,体质量未降低;实验组大鼠于实验开始时出现精神萎靡、毛发粗糙不整、活动减少、被抓取时无抵抗、不饮食、尿黄、体质量明显下降,甚至伴有口鼻出血,48 h后死亡4只。
2.2 ALF大鼠肝组织大体形态学及病理学观察正常对照组肝脏形态正常,被膜光滑、完整,色泽暗红,质地柔软;实验组肝脏出现明显肿胀、苍白,表面可见散在的点片状出血及散在瘀斑,质地偏脆,易破裂。在显微镜下,正常对照组肝组织中肝细胞未出现变性坏死,窦间隙明显轻微充血,肝细胞沿中央静脉向四周呈放射状排列;实验组肝组织表现为中央静脉周围肝细胞大片坏死,胞界不清,胞质崩解形成深伊红染色、形态不规则的颗粒或小体(↑1);周边部残存的肝细胞水肿体积增大,胞质疏松淡染(↑2)(见图1)。

图1 各组大鼠肝组织病理组织学改变(HE 400×) A: 正常对照组; B: 实验组 Fig 1 Histopathological changes of liver tissue in rats of each group (HE 400×) A: normal control group; B: experimental group
2.3 ALF大鼠血清中ALT、AST和PTA的水平比较ALT:正常对照组为(170.41±58.97)IU/L,实验组为(2 343.66±336.65)IU/L(见图2A)。AST:正常对照组为(166.41±82.91)IU/L,实验组为(1 689.16±379.91)IU/L(见图2B)。PTA:正常对照组为(60.83±7.77)%,实验组为(36.48±2.57)%(见图2C)。以上检测指标,正常对照组与实验组比较,差异均有显著统计学意义(P<0.01)。

注:与正常对照组比较,*P<0.01。
2.4 ALF大鼠肝组织中ERK1/2、pERK1/2蛋白和ERK1/2 mRNA的表达正常对照组ERK1/2蛋白为0.91±0.00,实验组ERK1/2蛋白为0.92±0.00,两组比较,差异无统计学意义(P>0.05)。正常对照组pERK1/2蛋白为0.14±0.02,实验组pERK1/2蛋白为0.54±0.02,两组比较,差异有统计学意义(P<0.01)。正常对照组ERK1/2 mRNA为0.47±0.21,实验组ERK1/2 mRNA为1.39±0.64,两组比较,差异有显著统计学意义(P<0.01)(见图3~4)。

图3 Western blotting方法检测ERK1/2和pERK1/2蛋白的表达Fig 3 The expressions of ERK1/2 and pERK1/2 proteins detected by Western blotting
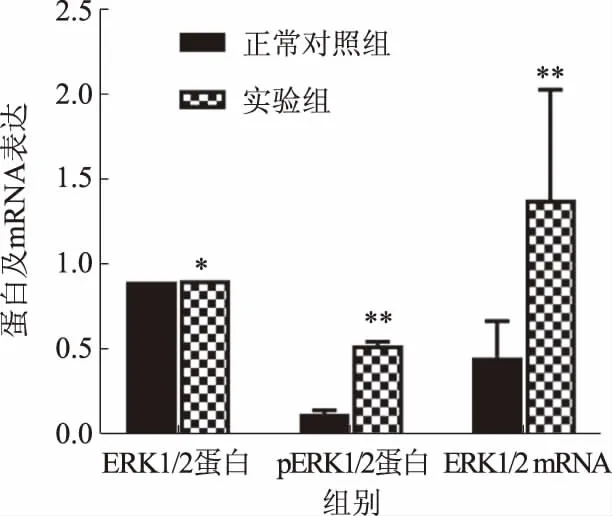
注:与正常对照组比较,*P>0.05, **P<0.01。
3 讨论
ALF作为一种病因多样、进展迅速、预后不佳,甚至导致多器官功能衰竭的重症疾病[13],其复杂的发病机制一直是国内外关注的热点。由各种病因促进相关信号通路的活化,进而引起严重的细胞炎症级联反应诱导的肝细胞坏死是ALF发展的最终结果。其中在各大相关信号通路中ERK1/2信号通路作为丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路中关键的一条亚通路,近年对其研究成为了一大热点,其中有研究发现它的活化在促进细胞受损、坏死、变性或凋亡方面发挥了重要作用[14-15]。有文献报道,牡丹酚[16]可通过ERK1/2信号通路发挥减轻肝细胞受损的作用,从而降低ALF的发生率;白瑞香素[17]可以通过抑制ERK1/2信号通路的活化减轻脂多糖/D-半乳糖胺诱导的ALF;组蛋白去乙酰化酶6的抑制剂ACY-1215[18]可通过抑制TLR4所介导的ERK信号通路的激活保护肝脏,预防ALF的发生。这些研究均提示ERK1/2信号通路的活化可能介导了ALF的发生与发展。
本研究选择SPF级Wistar雄性大鼠,用经典的CCl4植物油溶液灌胃造模方式诱导建立ALF模型,模型建立成功后处死大鼠取肝组织,首先进行ALF的病理学认证,镜下可见实验组肝组织中央静脉周围肝细胞大片坏死,胞界不清,胞质崩解形成深伊红染色、形态不规则的颗粒或小体,周边部残存的肝细胞水肿体积增大,胞质疏松淡染,呈现典型的ALF病理学改变。其次,检测实验组大鼠的肝功能,结果是ALT、AST水平显著上升,PTA水平显著下降,符合ALF的血清学诊断指标,与正常对照组比较,差异有显著统计学意义。最后,检测实验组大鼠肝组织中ERK1/2、pERK1/2和ERK1/2 mRNA的表达水平,结果显示ERK1/2蛋白的表达与正常对照组比较,差异无统计学意义,但pERK1/2蛋白的表达明显增加,与正常对照组比较,差异有显著统计学意义;实验组ERK1/2 mRNA的表达显著上调,明显高于正常对照组。该实验结果提示ERK1/2信号通路无论是在转录水平还是在翻译水平,其磷酸化过程与ALF发生、进展均密切相关。而有文献[19]报道,脐带血血浆蛋白中的脂肪细胞因子在半乳糖醛酸诱导的ALF中是通过激活ERK信号通路发挥保护肝细胞的作用,进而治疗ALF,这进一步说明ERK信号通路的活化与保护肝细胞治疗ALF有关,并非与ALF的发生、发展相关。这与众多研究的实验结果不一致,更加证明了该研究的必要性。
结合文献及本实验结果,我们认为,ERK1/2信号通路的活化与ALF发生、发展密切相关,这不但有助于深入揭示ALF的发病机制,也为以ERK1/2蛋白为靶点的抗炎新药研发建立一定的理论依据,同时也推测ERK1/2通路的活化可能是引起肝细胞炎症级联反应的重要环节,但这还有待于进一步的研究阐明。
