不同肉质颜色萝卜DFR基因表达差异分析
2019-08-21陈发波高健姚启伦
陈发波 高健 姚启伦


摘要:为了探明DFR基因的表达量与萝卜红色素含量之间的关系,以16个色素含量不同的萝卜品种为研究材料,测定肉质根色素含量和DFR基因的表达量,并进行方差分析。结果表明,不同类型萝卜品种间色素含量存在真实的差异,16个萝卜品种间色素含量变幅在0.01‰~25.43‰,平均值为7.40‰。采用RT-PCR法定量分析DFR基因相对表达量,结果表明,DFR基因在16个品种萝卜中的表达差异达到了极显著水平,DFR基因表达量在0.077 9~6.639 3 之间,平均值为1.574 1。对16个萝卜品种的DFR基因表达量与色素含量进行相关分析,结果表明,DFR基因相对表达量与色素含量之间的相关系数为0.89,达到了极显著水平,说明DFR基因的表达量越高,萝卜红色素的含量越高。推测DFR基因可能是萝卜红色素合成的关键基因,可将其作为萝卜或其他作物色素生产基因工程的候选基因。
关键词:红心萝卜;红色素;RT-PCR;DFR基因;表达量;方差分析
中图分类号: S631.101 文献标志码: A 文章编号:1002-1302(2019)12-0182-04
红心萝卜别称胭脂萝卜,是十字花科萝卜属萝卜种中的一个地方品种,在1979年蔬菜品种调查中确认为重庆涪陵特产[1]。红心萝卜具有心皮全红、色泽鲜美的特点,用以制作泡菜、萝卜干等,口感清脆。此外在红心萝卜中提取的红色素不仅可以作为食品添加剂,还具有抗氧化、抗痛风等功效,其应用前景广阔。涪陵红心萝卜在涪陵及周边区县均有栽种,是非常具有地方特色的蔬菜品种。但由于人们长期以来的自繁自种及红心萝卜与其他萝卜品种容易相互授粉,紅心萝卜的一些优良性状已逐步退化,如红心性状普遍退化,亟待人们对其色素合成相关基因展开研究,以保护和利用这一特色农业资源。目前人们对于涪陵红心萝卜的研究主要集中在新品种选育[1-3]、相关性状关系[4-6]与萝卜红色素的提取工艺[7-8]等方面,而关于基因表达量与色素含量之间的关联性分析报告较少。二氢黄酮醇-4-还原酶(DFR)是植物花青素合成途径中的关键酶,它在不同植株间具有高度的同源性。DFR基因为保守基因[9-10],其表达存在时空差异性[11],并且受多种因素的限制,如GA、NaCl、光照和UV-A等[12-14]。尽管DFR基因的相关特性及其在色素合成过程中的重要作用已逐渐为人所知,但其在红心萝卜色素合成中的作用尚不清楚。本研究通过分析DFR基因在不同肉质颜色萝卜中的表达差异,探寻DFR基因与萝卜肉质根颜色形成的关系,从分子水平解析红心萝卜红色素合成的机制,对改善红心萝卜优良性状、提高其利用价值具有重要意义,为通过基因工程手段提高红心萝卜的萝卜红色素含量提供理论依据。
1 材料与方法
1.1 供试材料
试验选用16份来自长江师范学院的不同肉质颜色萝卜品种,材料编号及相关表型性状见表1。
1.2 试验方法
1.2.1 试验设计 于2015年9月至2016年1月在长江师范学院试验地进行田间试验,采用随机区组设计,设置2次重复,每个品种种植3行,每行12株,行距50 cm,株距33 cm。2015年9月23日播种,2015年9月30日出苗,出苗后 100 d,进行色素含量测定和肉质根总RNA的提取,每个处理取中间10株获取数据资料。
1.2.2 萝卜肉质根色素含量的测定 16个不同肉质颜色萝卜品种肉质根的色素含量依照吕发生等提出的方法[15]提取测定,其操作步骤如下:(1)称取柠檬酸16.958 0 g、磷酸二氢钠13.500 0 g配制成pH值为3.0的缓冲液1 000 mL,称取萝卜红色素 0.205 2 g,加入95 %乙醇1 mL为标准品溶液。然后分别吸取标准品溶液1~13 mL并用缓冲液定容至 100 mL,在 520 nm 处测吸光度,绘制标准曲线。(2)将新鲜肉质根清洗、擦干,切成小颗粒充分混匀,立即称取鲜样测定肉质根含水量,余下部分用浆渣自动分离机获取汁液,搅匀之后取8~10 mL汁液在离心机中以 4 000 r/min 离心5 min,离心完成后汲取1 mL上清液,用磷酸二氢钠缓冲液定容到 100 mL,然后在分光光度计中检测520 nm波长下的吸光度。(3)1 000 g新鲜肉质根的萝卜红含量C鲜(‰)=v×y。其中,汁液容积v(mL)=1 000×肉质根含水量(%);汁液浓度y(g/mL)由标准曲线的回归方程计算。
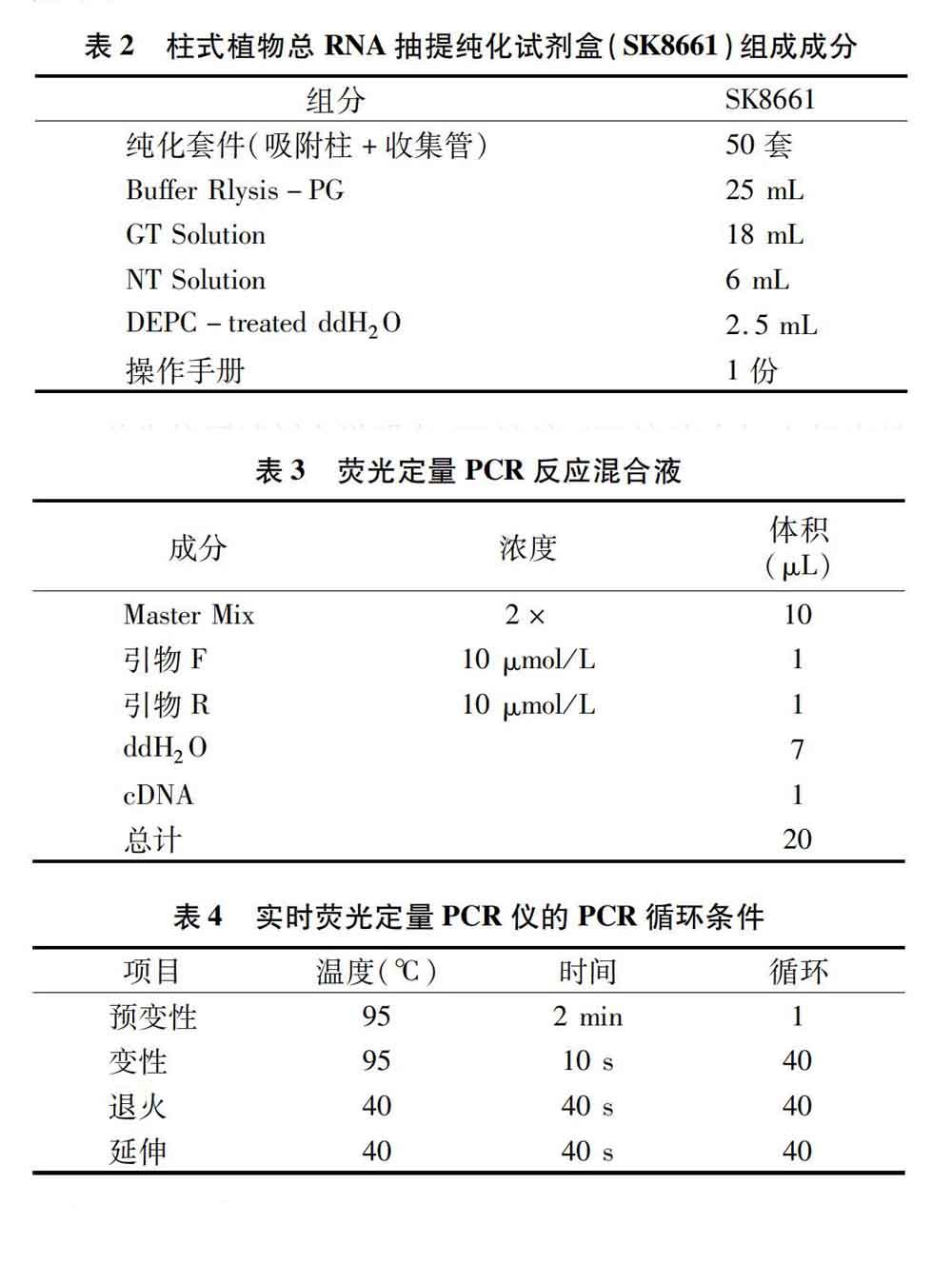
1.2.3 萝卜肉质根总RNA的提取 本次萝卜肉质根总RNA提取方法参照柱式植物总RNA抽提纯化试剂盒(SK8661)提取,试剂盒组成成分(表2)及具体操作步骤如下。
首先按照试剂盒说明在GT溶液、NT溶液中加入相应量的无水乙醇,混合均匀后在室温下密封保存备用,每次使用后注意将瓶盖旋紧,保持GT溶液、NT溶液中的乙醇含量(18 mL GT溶液中加入12 mL无水乙醇,36 mL GT溶液中加入24 mL无水乙醇;6 mL NT溶液中加入24 mL无水乙醇,12 mL NT溶液中加入48 mL无水乙醇)。最后在1.5 mL RNase-free的离心管加入450 μL Buffer Rlysis-PG后备用。
(1)取萝卜肉质根组织25~50 mg于研钵中,加入少许液氮迅速研磨成粉末,并将其全部转移到1.5 mL离心管中,立刻振荡将之混匀,在室温中放置5 min后置于4 ℃离心机中以12 000 r/min离心3 min,将离心后的上清液转移到 1.5 mL RNase-free离心管中,然后加入二分之一体积的无水乙醇,并充分混合均匀。(2)将吸附柱放入收集管中,用移液器将上述离心管中溶液全部加至吸附柱中,静置1 min,在室温下以12 000 r/min离心1 min后将收集管中的废液倒掉;加入500 μL GT溶液,静置1 min,在室温下以10 000 r/min离心1 min后将收集管中的废液倒掉;加入500 μL NT溶液,静置1 min,在室温下以10 000 r/min离心1 min后将收集管中的废液倒掉。(3)将吸附柱放回收集管中,以12 000 r/min离心2 min后将吸附柱取出放入1.5 mL RNase-free离心管中,在吸附柱中间加入30~50 μL DEPC-treated ddH2O,静置2 min后以12 000 r/min离心2 min,将最后得到的RNA溶液置于 -70 ℃ 冰箱中保存或留待后续试验使用。
1.2.4 DFR引物设计 选用Primer 5软件设计目的基因和内参基因的上下引物碱基序列。依据美国国立生物信息网(NCBI)发布的DFR基因碱基序列,设计DFR基因的引物序列:DFR-F:5′-TCATCGGTTCATGGCTCGT-3′ 59.1,DFR-R:5′-CCGTTTATGGCGTCATCGTA-3′,扩增产物全长共184 bp;内参基因(Actin)的引物序列:Actin-F:5′-TATGAGCAAAGAGATCACAGCACT-3′,Actin-R:5′-TGAGGGAAGCAAGAATGGAA-3′,扩增产物全长共113 bp。DFR基因引物和内参基因(Actin)引物由上海生工生物工程股份有限公司合成。
1.2.5 RNA反转录合成第一链cDNA 使用第一链cDNA合成试剂盒合成第一链cDNA,操作流程如下:(1)将以下试剂加入0.2 mL PCR管中:总RNA 5 μL、0.2 μg/μL Random Primer p(dN)1 μL和Rnase-free ddH2O 5 μL;(2)70 ℃温浴5 min;(3)冰浴10 s,将如下试剂加入离心后溶液中:10 U/μL AMV Reverse Transcriptase 2.0 μL、20 U/μL Rnase inhibitor 1.0 μL、10 mmol/L dNTP Mix 2.0 μL、5×Reaction Buffer 4.0 μL,总体积共20.0 μL;(4)37 ℃温浴5 min;(5)42 ℃温浴60 min;(6)70 ℃温水浴10 min后立即终止反应;(7)将上述溶液-20 ℃保存或后续研究使用。
1.2.6 荧光定量PCR测定 将上述合成的cDNA样品稀释8倍作为模板上机检测,然后配置反应混合液(表3)和设置PCR循环条件(表4),完成上述步骤后,将反应混合液加入96孔板后放在RT-PCR仪中开始扩增反应。得到产物的扩增曲线与溶解曲线后,采用2-ΔΔCT法[16]计算DFR基因初始模板数量的相对表达量(以内参基因Actin为标准)。
1.3 数据分析
用DPS数据处理系统对16种不同肉质颜色萝卜的DFR基因表达量(相对定量)和肉质根色素含量进行方差分析,然后将DFR基因表达量与色素含量进行相关分析。
2 结果与分析
2.1 不同萝卜品种色素含量分析
对16个萝卜品种的色素含量进行方差分析,结果(表5)表明,不同类型萝卜品种间色素含量存在真实差异。16个萝卜品种的色素含量和多重比较结果见图1。由图1可知,16个萝卜品种间色素含量变幅在0.01‰~25.43‰,平均值为 7.40‰。其中编号14萝卜品种色素含量最高(25.43‰),编号3和编号4萝卜红色素含量最低(0.01‰);编号14(25.43‰)、编号15(23.48‰)和编号16(22.58‰)萝卜品种色素含量显著高于其他种萝卜品种;编号10、编号11、编号12和编号13萝卜品种色素含量分别为10.58‰、8.68‰、7.26‰ 和8.34‰;编号8萝卜品种色素含量为4.53‰;编号5、编号6、编号7和编号9萝卜品种红色素含量分别为 2.41‰、1.25‰、2.57‰和1.00‰;编号1、编号2、编号3和编号4萝卜肉质根品种几乎不含萝卜红色素。
为进一步分析不同类型萝卜肉质根红色素含量的变化情况,将16个品种的萝卜按照皮和肉质的颜色分为5个类型:白皮白心(编号1、编号2、编号3和编号4),红皮白心(编号5、编号6和编号7),绿皮红心(编号8),红皮花心(编号9、编号10、编号11、编号13、编号15和编号16),红皮红心(编号12和编号14)。方差分析结果(表6)和多重比较结果(图2)表明,5种不同肉质颜色萝卜间肉质根红色素含量存在极显著差异,说明红色素含量与肉质颜色有关。由图2可知,红皮红心萝卜色素含量最高,为22.83‰,其次为红皮花心萝卜(7.172‰)、绿皮花心萝卜(4.530‰)、红皮白心萝卜(2.077‰)和白皮白心萝卜(0.065‰)。
2.2 不同萝卜品种DFR基因表达量分析
以从萝卜肉质根提取的RNA反转录合成的第一链cDNA为模板,以内参基因(Actin)为标准,采用RT-PCR扩增后得到溶解曲线和扩增曲线, 采用2-ΔΔCT法计算16个品种
萝卜的DFR基因表达量(相对定量),并对其进行方差分析(表7)。结果表明,DFR基因在16个品种萝卜中的表达差异达到了极显著差异水平。由图3可知,编号16萝卜品种的DFR基因表达量最高,达到6.639 3,编号1、编号2、编号3、编号4、编号5、编号6、编号7、编号8、编号9、编号10、编号12和编号13萝卜品种DFR基因表达量变幅为0.077 9~1.059,编号11、编号14和编号15萝卜品种的表达量分别为3.049 0、5.309 7和4.222 1。
方差分析结果(表8)表明,5种不同肉质颜色萝卜品种间DFR基因相对表达量存在极显著差异。由图4可知,红皮红心萝卜的DFR基因表达量最高,为5.390 4,红皮花心萝卜基因表达量为1.198 5,白皮白心萝卜的相对定量最低,为 0.091 4,而紅皮白心萝卜和绿皮红心萝卜DFR基因表达量分别为0.674 6和0.632 9。
2.3 不同萝卜品种DFR基因表达量与萝卜红色素含量相关分析
为了探明DFR基因表达量与萝卜肉质根红色素含量的关系,采用DPS数据处理软件对16个萝卜品种的DFR基因表 达量和萝卜肉质根色素含量进行相关分析。结果表明,DFR基因表达量与红色素含量之间的相关系数为0.89,达到了极显著水平,说明DFR基因的表达量越高,红色素的含量越高。
3 结论与讨论
已有研究表明,DFR是植物花色素苷合成途径中的关键酶,大量学者在矮牵牛、金鱼草、拟南芥、三叶草、兰花、非洲菊等多种作物方面进行了研究[13],但是关于涪陵红心萝卜方面的研究却鲜有报道,仅有孙玉燕等研究了DFR基因在白肉萝卜与红肉萝卜在不同发育阶段的表达模式[17],却未对DFR基因与红心萝卜色素含量进行相关分析,而弄清DFR基因的表达量与萝卜红色素含量之间的关联将有利于更好地改善红心萝卜色素含量。本研究中,DFR基因的相对定量与肉质根红色素含量之间的相关系数为0.89,达到了极显著水平,说明DFR基因的表达量越高,红色素的含量越高,DFR基因可能是红色素合成过程中的关键基因。这与文樵夫等的研究结果[18]类似,他们的研究结果表明海棠叶片的DFR基因表达量与叶色密切相关,叶色越红的海棠,其叶片中花色素苷含量和DFR基因的表达量相对较高。此外马春雷等发现不同茶树品种中总儿茶素含量随着LAR和DFR基因表达量增加而增加,而其他基因的表达量多少则与总儿茶素含量变化无关,因此推断出DFR基因可能是茶树黄酮类代谢过程中的重要基因[19]。以上研究结果表明,DFR基因的表达量与色素积累关系密切,在色素合成过程中发挥着重要作用。DFR基因在花色苷合成途径中发挥着关键作用,许多学者将DFR基因作为候选基因,从分子水平上改善植物的色素含量,并且已经取得了一定的成效。宋峰将毛白杨DFR基因转入烟草中,发现外源DFR基因能够改变烟草花瓣的颜色[20]。许志茹等研究发现,使烟草DFR基因过量表达后,花色能够明显加深,而将芜菁的DFR基因RNAi载体遗传转化烟草后观察到花色变浅[13]。由此,笔者认为在今后红心萝卜红色素含量育种中,可以将DFR作为萝卜基因工程育种的候选基因。
在植物色素合成通路中有许多基因都会影响色素的积累,如CHI、CHS和ANS等,然而本研究只对红心萝卜肉质根成色过程中的1个基因DFR进行了初步的分析,今后有待于进一步地深入开展红心萝卜色素合成分子机理研究。
参考文献:
[1]吕发生,谭革新,陶洪英,等. 涪陵红心萝卜新品种胭脂红1号的选育[J]. 中国蔬菜,2012,1(2):104-106.
[2]吕发生,陶洪英,谭革新,等. 杂交红心萝卜胭脂红1号亲本繁育技术规程[J]. 陕西农业科学,2015,61(9):122-123.
[3]秦文斌,戴忠良,张振超,等. 优质,高花青素萝卜胭脂1号的选育与高产栽培技术[J]. 江西农业学报,2012,24(4):75-76.
[4]秦家顺,许明惠,李昌满. 胭脂萝卜农艺性状与肉质根色素产量的多元回归和通径分析[J]. 河南农业科学,2014,43(1):107-109.
[5]陶洪英,吕发生,谭革新,等. 红心萝卜肉质根性状间的关系[J]. 西南农业学报,2015,25(2):605-608.
[6]陈发波,李春明,姚启伦,等. 不同施肥处理对胭脂萝卜主要性状的影响[J]. 安徽农业大学学报,2016(3):441-446.
[7]司 军,李成琼,任雪松,等. 胭脂萝卜红色素提取及其形成机理研究[J]. 西南大学学报(自然科学版),2010,32(6):73-77.
[8]阳 晖,杨呈凤,李昌满,等. 胭脂萝卜废渣中萝卜硫素的提取工艺研究[J]. 食品科技,2016(2):259-264.
[9]潘怡辰,王 坤,王汝茜,等. 三种小麦作物二氢黄酮醇4-还原酶(DFR)基因的生物信息学分析[J]. 中国农学通报,2014,30(6):72-76.
[10]肖继坪,王 琼,郭华春. 彩色马铃薯二氢黄酮醇4-还原酶(DFR)基因的克隆及生物信息学分析[J]. 分子植物育种,2011,9(6):728-735.
[11]褚云霞,陈海荣,潘俊松,等. 矮牵牛DFR-A基因的克隆与表达分析[J]. 中国农学通报,2014,30(10):163-169.
[12]董 洁,王学敏,王 赞,等. 紫花苜蓿二氢黄酮醇还原酶基因(MsDFR)的克隆与分析[J]. 草业学报,2014(4):123-132.
[13]许志茹,刘 通,崔国新,等. 芜菁二氢黄酮醇4-还原酶基因的克隆与功能鉴定[J]. 园艺学报,2014,41(4):687-700.
[14]Wu H X,Jia H M,Ma X W,et al. Transcriptome and proteomic analysis of mango(Mangifera indica L.) fruits[J]. Journal of Proteomics,2014,105(6):19-30.
[15]吕发生,何晓蓉,罗永统,等. 红心萝卜肉质根色素含量的测定[J]. 西南农业学报,2004,17(6):763-765.
[16]Pfaffl M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Research,2001,29(9):e45.
[17]孙玉燕,张晓辉,邱 杨,等. 二氢黄酮醇还原酶基因在红肉萝卜和白肉萝卜中的序列变异和表达差异[J]. 植物遺传资源学报,2014,15(3):554-560.
[18]文樵夫,沈红香,姚允聪,等. 苹果属观赏海棠McDFR的克隆及不同叶色品种间的表达差异[J]. 林业科学,2010,46(11):16-24.
[19]马春雷,乔小燕,陈 亮. 茶树无色花色素还原酶基因克隆及表达分析[J]. 茶叶科学,2010,30(1):27-36.
[20]宋 峰. 毛白杨二氢黄酮醇4-还原酶(DFR)基因在烟草中的功能验证[D]. 重庆:西南大学,2010.
