五加科植物鲨烯合酶核苷酸及其编码氨基酸序列的生物信息学分析
2019-08-21魏磊常霞全彦涛
魏磊 常霞 全彦涛

摘要:鲨烯合酶(squalene synthase,EC2.5.1.21,简称SQS)是三萜类化合物生物合成通路的关键酶之一。采用生物信息学方法对13种五加科植物的SQS核苷酸及其编码氨基酸序列的结构、理化性质、磷酸化位点、亲/疏水性、信号肽、导肽、跨膜结构域、亚细胞定位、二级结构、功能域、三级结构及进化关系进行初步预测和分析,并构建SQS蛋白家族的系统进化树。结果表明,13种五加科植物的SQS氨基酸序列结构与理化性质基本一致,均表现出亲水性,没有信号肽,具有跨膜结构域;亚细胞定位分析显示,除Panax sokpayensis定位于内质网膜上,其余均定位于质膜上。α螺旋和无规则卷曲为SQS二级结构中最主要的结构元件,保守区包括底物结合区、镁离子结合位点、活性位点残基盖、催化残基和2个天冬氨酸富集区,具有典型的多聚异戊二烯基合成酶活性结构域和鲨烯/八氢番茄红素合成酶活性结构域。分析结果可为SQS的酶学特性及三萜类化合物生物合成的分子机制研究提供理论基础。
关键词:五加科;生物信息学;鲨烯合酶;三萜生物合成
中图分类号:S188 文献标志码: A 文章编号:1002-1302(2019)12-0057-06
三萜类化合物由6个异戊二烯结构单元组成,以共同前体鲨烯(squalene)为底物,在不同三萜合酶的催化下形成的C30类萜类化合物,广泛分布于植物、动物和微生物中。在植物界,三萜类化合物在五加科、豆科、大戟科、卫矛科等科属中广泛存在,且具有抗癌、解热、抗炎、镇痛、溶血、抗菌、抗病毒等重要的药理活性[1]。在植物三萜合成通路(图1)中,鲨烯合酶(squalene synthase,简称SQS)处于法尼基焦磷酸(FPP)到其他产物(二萜、四萜等)的分支点上,催化2分子FPP缩合生成1分子鲨烯,而鲨烯是三萜、甾醇等萜烯类物质生物合成的共同前体,因此,SQS是三萜类化合物生物合成通路中的关键酶[2]。
至今,多种植物的SQS已经或正在被深入研究,包括银杏(Ginkgo biloba,GeneBank:APB03419.1)、紫杉(Taxus cuspidata,GenBank:ABI14439.1)等裸子植物及以烟草(Nicotiana tabacum,GeneBank:AAB08578.1)、拟南芥(Arabidopsis thaliana,GeneBank:AAD00296.1)为代表的被子植物。Floressánchez等用果胶处理猫掌树悬浮细胞,使得SQS活性提高了3倍以上,进而增加了萜烯类物质产量[3];Han等通过诱导睡茄鲨烯合酶的表达,能够提高植物甾醇的含量[4];而张毅等反义抑制烟草SQS,降低了植物甾醇的生物合成[5];Patel等抑制人参鲨烯合酶的表达,可使三萜皂苷的生成量降低[6]。以上研究均表明,对植物SQS进行调控可改变后续产物的产量。
五加科(Araliaceae)植物多为古老而又名贵的药用植物,通常其体内三萜类化合物含量丰富,活性显著,广泛应用于医药和食品行业,如具有大补元气、固脱、生津、安神和益智功效的人参(Panax ginseng)[7],活血止血、消肿定痛、金刀跌伤的三七(P. notoginseng)[8],补气安神、强精滋肾、祛风除湿、活血止痛的楤木(Aralia elata)[9]等。目前,已从五加科人参、三七、楤木、刺五加(Eleutherococcus senticosus)、西洋参(P. quinquefolius)等中药材中克隆到了SQS的基因。鲨烯合酶作为植物三萜类化合物生物合成过程中的一个关键酶,受到越来越多的关注,本研究利用生物信息学方法,筛选出五加科植物中已被克隆的13个SQS蛋白,对其核苷酸及编码的氨基酸序列的组成、理化性质、磷酸化位点、亲/疏水性、信号肽、导肽、跨膜结构域、亚细胞定位、二级结构、结构域、三级结构和进化关系进行预测和分析,以期为更多物种SQS蛋白结构和功能的深入研究提供理论依据。
1 材料与方法
1.1 材料
从美国国立生物技术信息中心(National Center of Biotechnology Information,简称NCBI)下载并筛选出了五加科植物人参、三七、西洋参、刺五加、竹节参(Panax japonicus)、楤木和P. sokpayensis的13种完整的SQS核苷酸和氨基酸序列(表1)。
1.2 方法
2 结果与分析
2.1 五加科植物SQS核苷酸及其编码氨基酸序列的结构和理化性质
利用ORF Finder和ProtParam在线网站对13种五加科植物SQS核苷酸及其编码氨基酸序列进行理化性质分析。由表2可知,SQS核苷酸序列的起始密码子均为ATG,终止密码子均为TGA;氨基酸残基数(amino acids,aa)在414~446个之间;各蛋白相对分子质量在46 923.26~51 063.97 ku 之间,中位值为47 067.53 ku;理论等电点范围为5.96~6.67,平均为6.28,说明SQS为酸性蛋白。从氨基酸组成可以看出,13种SQS蛋白所含酸性氨基酸残基比例均高于碱性氨基酸,进一步说明SQS为酸性蛋白。各种植物SQS蛋白中,含量最丰富的氨基酸残基主要集中在亮氨酸(Leu)、丙氨酸(Ala)、丝氨酸(Ser)、赖氨酸(Lys)和异亮氨酸(Ile)上。除P. sokpayensis外,其余12种五加科植物总原子数和消光系数基本一致。人参2、人参3、西洋参1、西洋参3、刺五加1、刺五加2不稳定系数低于40,为稳定蛋白,其余均为不稳定蛋白。
2.2 五加科植物SQS蛋白的磷酸化位点
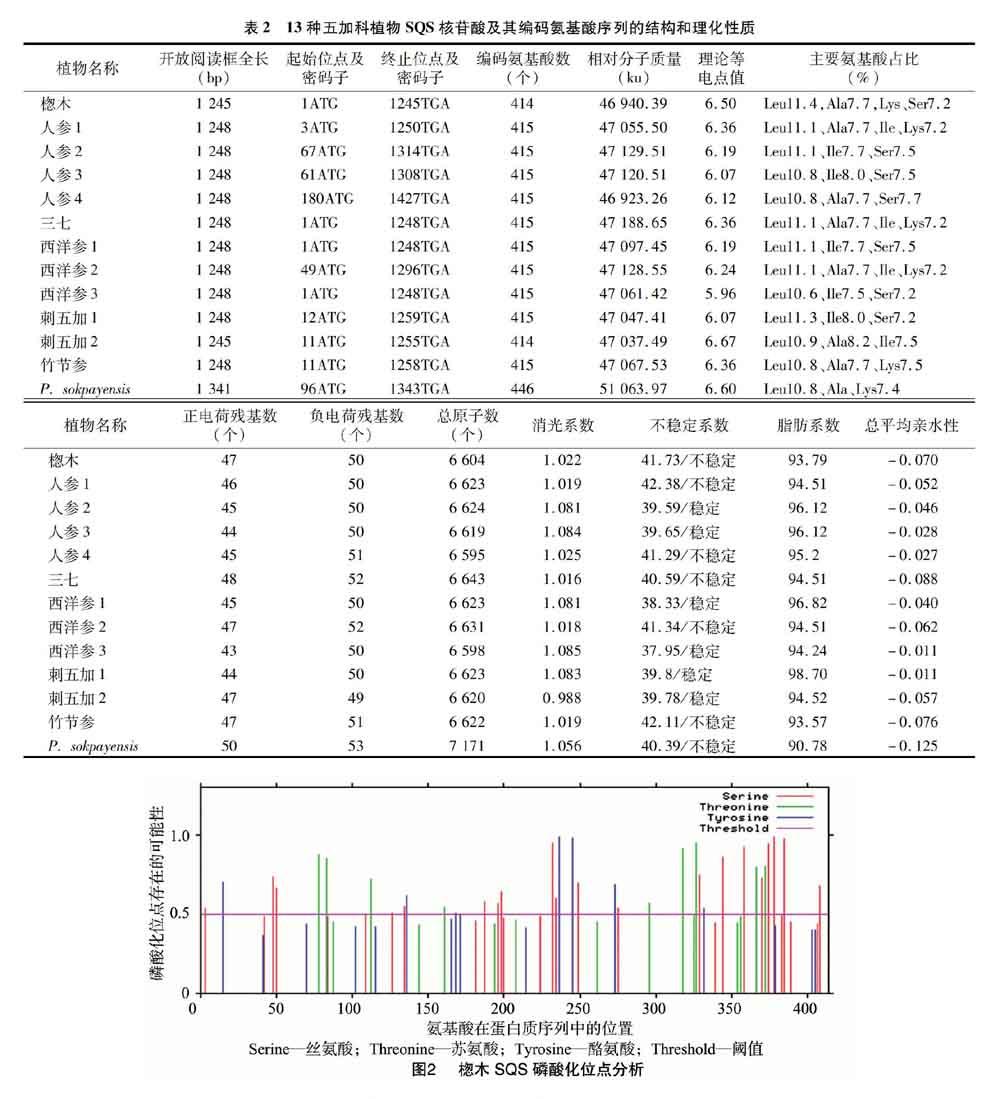
利用NetPhos 3.1 Server對13种五加科植物SQS蛋白磷酸化位点进行预测,磷酸化位点在17~20个之间。以楤木SQS蛋白为例,超过阈值(Threshold)0.5判定为磷酸化位点,共有36个磷酸化位点(图2),其中丝氨酸磷酸化位点20个,分别为S3、S48、S50、S126、S134、S187、S196、S198、S232、S234、S249、S215、S329、S344、S358、S370、S374、S378、S385、S408;苏氨酸磷酸化位点9个,分别为T78、T83、T112、T161、T296、T318、T327、T366、T372;酪氨酸磷酸化位点7个,分别为Y15、Y136、Y168、Y236、Y245、Y273、Y332。除个别位点以外,其余植物SQS蛋白磷酸化位点与楤木基本一致。
2.3 五加科植物SQS的亲/疏水性、信号肽、导肽、跨膜结构域和亚细胞定位特征
2.3.1 蛋白亲/疏水性的预测 蛋白质亲/疏水性氨基酸组成是蛋白质折叠的主要驱动力[10],利用Protscale在线预测亲疏水性,以楤木SQS为例,其多肽链中第351位氨基酸有最低的亲水性分值-2.433,位于395和398位的氨基酸有最高的疏水性分值3.567。其中,亲、疏水性氨基酸分别占55.4%和 44.6%,推测折叠的蛋白为亲水性蛋白。此外,肽链两端为亲水性氨基酸,中间有2段疏水性氨基酸,这与跨膜结构的预测结果相吻合。其余12种SQS的亲/疏水性分析结果都与楤木相似。
2.3.2 信号肽的预测和分析 信号肽是新合成的多肽链中用于指导蛋白质跨膜转移(定位)的N-末端的氨基酸序列,一般由16~26个氨基酸组成,在信号肽的引导下,新合成的蛋白质进入内质网腔,而信号肽自身的序列在信号肽酶的作用下被切除[11]。利用在线工具Signal P 4.1 Server的神经网络算法对13种五加科植物的SQS蛋白进行信号肽的预测,结果表明均不存在信号肽。
2.3.3 导肽的预测和分析 导肽又称转运肽,大约18~20个氨基酸长度,位于新合成蛋白质的N端,其含有丰富的碱性氨基酸,这些氨基酸对于蛋白质的定位具有重要的作用[12],能将肽链准确地定位于细胞的某一个细胞器或组织上[13]。因此,对导肽的预测分析有助于蛋白质的功能和作用机制研究。通过在线预测工具TargetP 1.1 Server,对五加科植物SQS序列进行预测。以楤木SQS蛋白为例,预测可靠性为Ⅲ级,其叶绿体转运肽、线粒体靶位肽、分泌途径信号肽及其他的分值分别为0.065、0.237、0.061、0.743,并且不存在导肽分裂位点。因此,无法确定楤木SQS是否具有导肽。其他11种五加科植物的SQS预测分析结果与楤木完全一致。但P. sokpayensis的SQS蛋白预测可靠性为Ⅳ级,可能含有较低相似度的分泌途径信号肽,但不存在导肽分裂位点。
2.3.4 跨膜结构域特征 跨膜结构域一般由20个左右的疏水性氨基酸残基组成,主要形成α螺旋,常由跨膜蛋白的效应区域展现[14]。利用在线工具TMHMM Server v.2.0对13种五加科植物SQS蛋白跨膜结构进行预测可知,SQS蛋白均具有跨膜结构域,P. sokpayensis有1个,其余五加科植物均有2个。跨膜区域位于C端的疏水序列,用于锚定在生物膜上。
2.3.5 亚细胞定位特征 蛋白质在细胞中合成后被转运到特定的细胞器发挥作用,蛋白质亚细胞定位分析及预测能极大地加速蛋白质结构和功能的研究[15]。采用PSORT Prediction在线工具对13种五加科植物的SQS进行亚细胞定位。由表3可知,P. sokpayensis SQS位于内质网膜上的可能性为0.850,其余植物SQS位于质膜上的可能性均大于0.640。因此判断SQS P. sokpayensis定位于内质网膜上,其余植物SQS定位于质膜上。
2.4 五加科植物SQS二级结构预测
蛋白质二级结构是指借助于氢键沿一维方向排列成具有周期性结构的构象,是多肽链局部的空间结构(构象),它们是构成蛋白质高级结构的基本要素。利用SOPMA对13种五加科植物SQS二级结构进行预测。结果显示,五加科SQS中均有α螺旋、无规则卷曲、延伸链和β折叠。以楤木SQS为例,由表4可知,其主要结构元件是α螺旋(68.36%)、β折叠(5.31%)、无规则卷曲(20.05%)和延伸链(6.28%)。其余蛋白二级结构的主要结构元件与比例与楤木SQS基本一致。
2.5 蛋白质功能结构域的预测和分析
结构域是蛋白质分子中介于二级与三级结构之间的一种结构层次,是指蛋白质亚基结构中明显分开的紧密球状结构区域,是蛋白质三级结构内的独立折叠单元,具有特定的生物学功能,结构域通常也是蛋白质的功能域[16]。采用NCBI在线软件Conserved domains对楤木SQS蛋白的氨基酸序列进行保守区和功能域的预测分析,结果表明,楤木SQS蛋白保守区域包括底物结合区、镁离子结合位点、活性位点残基盖、催化殘基和2个天冬氨酸富集区,具有典型的多聚异戊二烯基合成酶活性结构域和鲨烯/八氢番茄红素合成酶活性结构域,属于Isoprenoid-Biosyn-C1超家族(图3)。其余SQS蛋白均存在上述结构域,为类异戊二烯生物合成酶。
x2.6 五加科植物SQS蛋白三级结构的预测和分析
蛋白质的三级结构是在二级结构的基础上进一步盘绕、折叠形成的天然构象,主要依靠氨基酸侧链之间的疏水相互作用、氢键、二硫键、范德华力和静电作用维持。蛋白质的功能与其三级结构密切相关,对蛋白质三级结构的预测和分析,有助于理解蛋白质结构与功能之间的相关性[17]。利用同源建模工具 SWISS-MODEL对楤木SQS蛋白进行三级结构预
测和分析,找到模板蛋白(ACCESSION:3wef.2.A;Sequence Identity:47.73%;GMQE:0.63),再用Swiss Pdb-Viewer工具显示楤木SQS结构域的3D结构。结果显示,楤木SQS为单体蛋白结构,活性中心主要由几个α螺旋围绕形成1个穴状活性中心结构,其20个磷酸化位点位于蛋白质表面。主要结构单元为螺旋结构,伴有折叠、无规则卷曲和延伸链结构(图4),与二级结构预测结果一致。
2.7 SQS蛋白的系统进化树分析
来源于同一祖先的不同植物在进化过程中的关系可以通过进化树来描述,通过构建植物进化树,可以了解一种植物在进化过程中的地位[18]。用MEGA 7.0软件对包括五加科在内的28种有代表性的SQS蛋白构建系统进化树。结果显示,来源于裸子植物、被子植物、动物、细菌、真菌的SQS按照不同类群分为5群,在进化遗传学上亲缘越近的物种,在SQS的分子系统进化树上距离越近(图5)。基于氨基酸序列重建的系统进化树,虽不能完全客观地反映出植物系统分类学关系和漫长历史长河中的自然演化进程,但其结果对判断不同植物之间的亲缘关系仍具有一定的借鉴意义[19]。
3 结论与讨论
植物萜类化合物的生物合成途径包括2种:一种是甲戊二羟酸(MVA)途径,也称细胞质途径,主要合成倍半萜、三萜和甾醇等化合物;一种是脱氧木酮糖磷酸酯(DXP)途经,又称质体途径,主要合成单萜、二萜、类胡萝卜素等化合物[20-21]。虽然2种途径在细胞的不同区域独立进行,但许多证据表明2种途径有着密切的联系,细胞质和质体之间存在某些中间产物交换现象。由于SQS竞争利用FPP来合成三萜及甾醇,会影响单萜、二萜类物质的合成[22],因此SQS含量和活性决定了相关物质的产量。
蛋白一级结构预测分析结果表明,SQS蛋白为酸性的亲水性蛋白,部分不稳定,部分稳定,具有明显的疏水区和亲水区,不具有信号肽,可推测SQS不是分泌性蛋白,这与其属于细胞质中的MVA途径关键酶相一致;都具有2个跨膜结构域,无法确定是否具有导肽,也未发现导肽的分裂位点;亚细胞定位预测分析表明其可能定位在质膜、内质网膜或高尔基体上。SQS蛋白的二级结构均以α螺旋、β折叠、无规则卷曲和延伸链分布于整个肽链结构中。所有五加科SQS蛋白氨基酸序列中都含有多聚异戊二烯基合成酶的活性结构域和底物结合位点结构域,属于Isoprenoid-Biosyn-C1超家族,为类异戊二烯生物合成酶。
利用生物信息学的方法对五加科植物SQS氨基酸序列的生理生化特性进行预测和分析,可以为SQS蛋白及其编码基因的克隆提供可靠的依据;对其序列结构的预测和分析,可为其蛋白表达与修饰提供指导;并为更多物种SQS蛋白及其编码基因的克隆提供可靠的依据。对其二级及高级结构的预测和分析有利于深入探讨该酶结构和功能之间的关系、作用机制和代谢过程。
参考文献:
[1]刘江亭,蒋海强. 三萜类化合物药理作用研究进展[J]. 中国中医药咨讯,2011,3(10):321.
[2]Goldstein J L,Brown M S. Regulation of the mevalonate pathway[J]. Nature,1990,343(6257):425.
[3]Floressánchez I J,Ortegalópez J,Ramosvaldivia A C. Biosynthesis of
sterols and triterpenes in cell suspension cultures of Uncaria tomentosa[J]. Plant & Cell Physiology,2002,43(12):1502.
[4]Han J Y,In J G,Kwon Y S,et al. Regulation of ginsenoside and phytosterol biosynthesis by RNA interferences of squalene epoxidase gene in Panax ginseng[J]. Phytochemistry,2010,71(1):36-46.
[5]張 毅,刘 彦,王 红,等. 转青蒿反义鲨烯合酶基因对烟草鲨烯合酶基因表达的影响[J]. 农业生物技术学报,2005,13(4):416-422.
[6]Patel N,Patel P,Kendurkar S V,et al. Overexpression of squalene synthase in Withania somnifera,leads to enhanced withanolide biosynthesis[J]. Plant Cell Tissue & Organ Culture,2015,122(2):409-420.
[7]王 月,翟华强,鲁利娜,等. 人参的本草考证及现代研究综述[J]. 世界中医药,2017,12(2):470-473.
[8]孙千惠,刘海娇,杨小玉,等. 三七本草考证[J]. 中医药信息,2017,34(5):113-117.
[9]赵俊男,谭玉婷,姜天童,等. 龙牙楤木药理作用研究进展[J]. 吉林中医药,2016(2):207-210.
[10]张 弢. 不同植物查尔酮合成酶CHS基因的生物信息学分析[J]. 江西农业学报,2012,24(6):5-8.
[11]翟中和,王喜忠,丁明孝. 细胞生物学[M]. 北京:高等教育出版社,2000:191.
[12]强 毅. 植物蔗糖磷酸合成酶的生物信息学分析[J]. 现代生物医学进展,2007,7(4):557-560,570.
[13]金元昌,向育君,李景鹏. 重组人促性腺激素释放激素及导肽的分离纯化与活性分析[J]. 生物技术通报,2008(3):87-90,94.
[14]董 娇,周 军,辛培尧,等. 不同植物LDOX/ANS基因的生物信息学分析[J]. 基因组学与应用生物学,2010,29(5):815-822.
[15]Herr D. Secretion of cellulase and β-glucosidase by Trichoderma viride ITCC-1433 in submerged culture on different substrates[J]. Biotechnology & Bioengineering,2010,21(8):1361-1371.
[16]王镜岩,朱圣庚,徐长法. 生物化学[M]. 北京:高等教育出版社,2002:533.
[17]蔡娜娜,陈月辉,李 伟. 基于神经网络的蛋白质三级结构预测[J]. 计算机工程,2010,36(9):176-177.
[18]于 剑,叶 齐,宁书菊,等. 马蓝等79种植物分支酸合成酶的生物信息学分析[J]. 中国中药杂志,2018,43(4):721-730.
[19]吴春太,李维国,高新生,等. 植物DNA甲基转移酶的生物信息学分析[J]. 西南大学学报(自然科学版),2010,32(4):83-89.
[20]Bouvier F,Rahier A,Camara B. Biogenesis,molecular regulation and function of plant isoprenoids[J]. Progress in Lipid Research,2005,44(6):357-429.
[21]Liao P,Hemmerlin A,Bach T J,et al. The potential of the mevalonate pathway for enhanced isoprenoid production[J]. Biotechnology Advances,2016,34(5):697-713.
[22]Shechter I. The road to squalene synthase[J]. Biochemical & Biophysical Research Communications,2002,292(5):1261-1266.杨旭颖,安丽君. 拟南芥细胞周期调控因子KRP2的原核表达及蛋白纯化[J]. 江苏农业科学,2019,47(12):63-65.
