基于多成分含量测定及色谱指纹图谱技术提升白术药材质量标准△
2019-08-21刘青申洁肖苏萍郭凯何春年王继永
刘青,申洁,肖苏萍,郭凯,何春年*,王继永*
1.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;2.教育部中草药物质基础与资源利用重点实验室,北京 100193;3.中国中药有限公司,北京 100195
白术药材来源于菊科植物白术AtractylodesmacrocephalaKoidz.的干燥根茎,其味苦、甘,性温,归脾、胃经,具有健脾益气、燥湿利水、止汗、安胎的功效,常用于治疗脾虚、腹胀、胎动不安等病症[1]。始载于《神农本草经》,为上品药材,是著名的道地药材“浙八味”之一。在我国,白术的主要产区为浙江、四川、安徽、湖北、湖南等地,以栽培为主,其中浙江於潜所产白术的品质最佳,故又称其为“於术”[2]。目前,从白术中分离出超过79种化学成分,包含倍半萜类、三萜类、多糖类、黄酮苷类以及多炔类等化合物[3],其中倍半萜类是白术最重要的一类化合物,以挥发性成分白术内酯Ⅰ、Ⅱ、Ⅲ以及苍术酮为主[4]。现代药理学研究表明,白术具有多种药理作用,如改善胃肠功能[5]、利尿、抗炎症[6-7]、抗抑郁[8]、抗肿瘤[9]、增强免疫功能[10]等活性,其中白术内酯类是其药理活性作用的重要成分。
白术为常用中药材,具有广泛的应用,但迄今其质量标准尚不完善。《中华人民共和国药典》2015版中,仅从显微鉴别、薄层色谱、色度、水分、总灰分以及二氧化硫等方面对白术药材质量进行控制[1],并没有规定含量测定和指纹图谱两项。虽然已有白术含量测定和指纹图谱的研究报道[11-13],但并没有明确提出白术内酯等指标成分的含量限度和建立特征图谱。本研究系统地收集主要产区7个省市共38批白术药材,建立了白术药材的含量测定和化学色谱指纹图谱评价方法,提出其主要活性成分白术内酯I~Ⅲ的含量限度以及白术药材特征色谱峰,为白术药材质量标准的提升和完善提供参考。
1 材料
1.1 仪器
Agilent 1200 HPLC(G1322A型在线脱气机、G1311A型液相泵、G1329A自动进样器、G1316A柱温箱、G1315B型DAD检测器、Agilent色谱工作站);AL204型梅特勒-托利多万分之一电子天平;超纯水仪(Millipore公司);KQ5200DE型超声波清洗仪(江苏省金坛市宏凯仪器厂)。
1.2 试药
白术内酯Ⅰ、Ⅱ、Ⅲ(中国食品药品检定研究院,纯度均为99.9%,ID分别为3YQB-LYKQ、XQS8-HYPC、AVAL-RVEQ);乙醇、甲醇(分析纯,北京化工厂);超纯水(Millipore);乙腈(色谱纯,Honeywell)。
38份白术药材粉末来源于浙江、湖南、湖北、四川等多个产地。
2 方法与结果
2.1 对照品溶液的制备
称取白术内酯Ⅰ、Ⅱ、Ⅲ对照品各约10 mg,精密称定,置于10 mL的容量瓶中,乙醇溶解并定容至刻度,得白术内酯储备液,其中白术内酯Ⅰ、Ⅱ、Ⅲ质量浓度分别为1.02、1.04、1.05 mg·mL-1。分别取上述白术内酯储备液各1 mL,置于10 mL的容量瓶中,加入乙醇定容,即得白术内酯的混标溶液,备用。
2.2 供试品溶液的制备
称取白术药材(批号:DC7131)粉末约1 g,精密称定,置于50 mL的容量瓶中,加入40 mL甲醇,摇匀,在35 ℃下,超声提取30 min,放至室温,用甲醇定容,摇匀,用0.45 μm微孔滤膜过滤,取续滤液,即得到供试品溶液。
2.3 色谱条件
色谱柱:Agilent Eclipse XDB-C18(250 mm×4.6 mm,5 μm),流动相为水(A)-乙腈(B),梯度洗脱,洗脱程序为0~5 min,5%~60%B;5~20 min,60%~80%B;20~25 min,80%~95%B;25~30 min,95%~100%B;30~35 min,100%B。流速为1 mL·min-1,进样量为20 μL,柱温为35 ℃,检测波长为220、280 nm,对照品及白术药材HPLC图见图1。
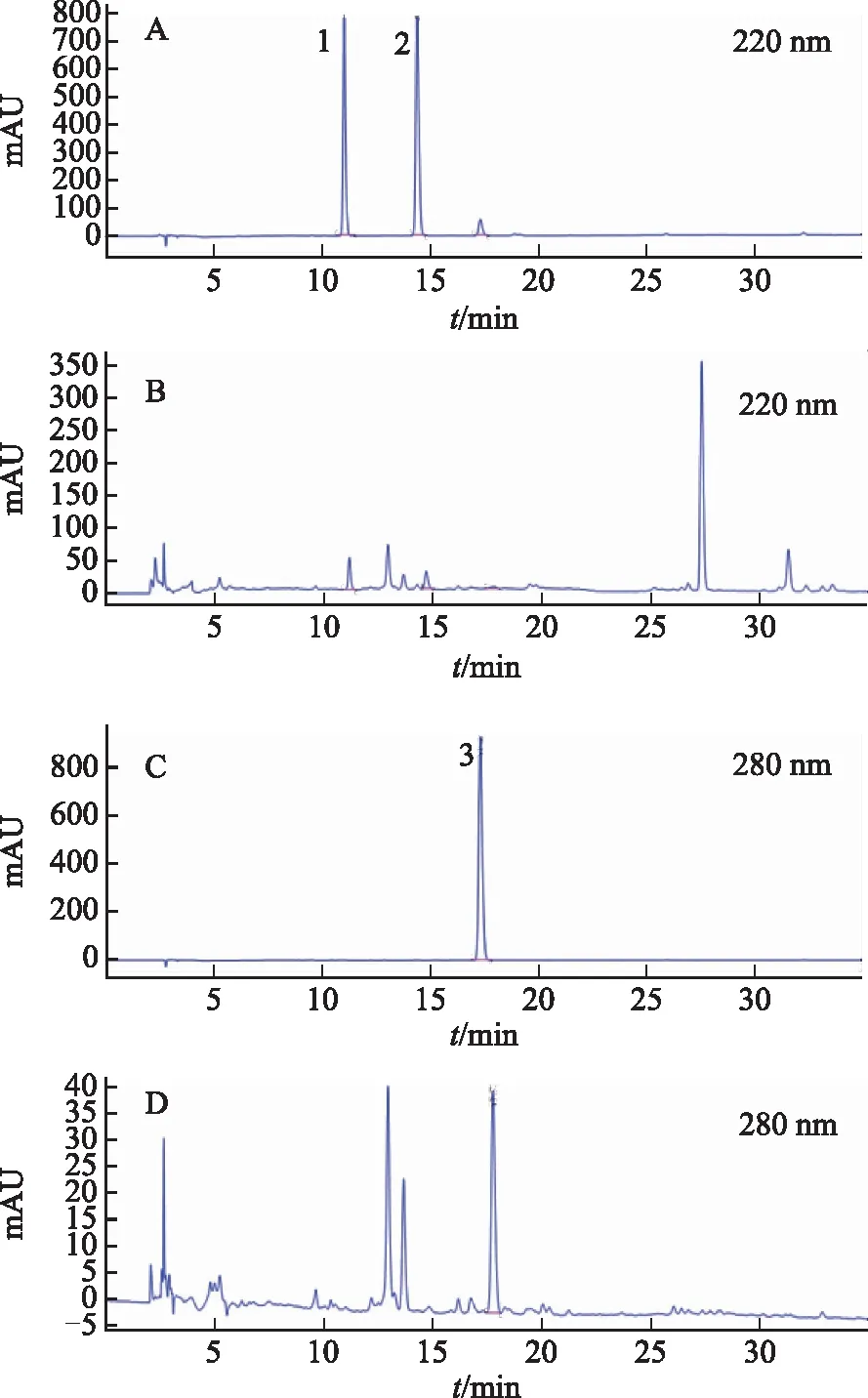
注:A、C.对照品;B、D.白术药材;1.白术内酯Ⅲ;2.白术内酯Ⅰ;3.白术内酯Ⅱ。图1 白术内酯对照品及白术药材HPLC图
2.4 方法学考察
2.4.1 线性范围 将白术内酯的混标溶液用乙醇按不同的倍数稀释,得到6份不同质量浓度的混标溶液,其中白术内酯I的质量浓度分别为4.08、8.16、16.32、26.52、51、81.6 μg·mL-1;白术内酯Ⅱ的质量浓度分别为4.16、8.32、16.64、27.04、52、83.2 μg·mL-1;白术内酯Ⅲ的质量浓度分别为4.2、8.4、16.8、27.3、52.5、84 μg·mL-1。上述6份混标溶液按2.3项的色谱条件进行检测,并以色谱峰面积对白术内酯的浓度进行线性关系分析。白术内酯 Ⅰ:Y=83.073X+16.271,r=0.999 4;白术内酯 Ⅱ:Y=95.97X-47.587,r=0.999 3;白术内酯 Ⅲ:Y=52.241X+30.499,r=0.999 7。结果表明,白术内酯Ⅰ、Ⅱ、Ⅲ在4.0~84.0 μg·mL-1线性关系良好。
2.4.2 检测限与定量限 将混标溶液用乙醇进一步稀释,按2.3项的色谱条件进行检测,计算不同浓度下的信噪比(S/N)。信噪比(S/N)为3时,用于检测限的考察;信噪比(S/N)为10时,用于定量限的考察。白术内酯Ⅰ、Ⅱ、Ⅲ的检测限分别为0.089、0.104、0.168 μg·mL-1;定量限分别为0.163、0.208、0.263 μg·mL-1。
2.4.3 精密度试验 按2.2项下制备供试品溶液,并按2.3项的色谱条件检测,连续进样6次。结果显示,白术内酯Ⅰ、Ⅱ、Ⅲ峰面积的RSD值分别为1.50%、1.51%、1.23%;保留时间的RSD值分别为0.6%、0.74%、0.62%,可见仪器的精密度良好。
2.4.4 稳定性试验 按2.2项制备供试品溶液,分别于0、1、5、12、18、24 h,6个不同的时间点进样检测,结果白术内酯Ⅰ、Ⅱ、Ⅲ峰面积的RSD值分别为1.39%、1.94%、1.39%,可见24 h内白术供试品溶液较为稳定。
2.4.5 重复性试验 取同一批次(批号:DC7131)的白术样品粉末6份,按2.2项制备供试品溶液,并分别按2.3项的色谱条件进行检测。白术内酯Ⅰ、Ⅱ、Ⅲ峰面积的RSD值分别为0.97%、2.08%、1.33%,结果表明测定方法具有良好的重复性。
2.4.6 加样回收率试验 称取白术样品粉末(批号:DC7131)约0.5 g,精密称定,置于25 mL的容量瓶中,称取6份;分别精密加入白术内酯I溶液(102 μg·mL-1)1.3 mL;白术内酯Ⅱ溶液(104 μg·mL-1)0.8 mL;白术内酯Ⅲ溶液(105 μg·mL-1)1.6 mL。按上述测定方法进行分析,计算加样回收率,结果白术内酯Ⅰ、Ⅱ、Ⅲ的平均加样回收率分别为101.9%(RSD=3.34%)、107.55%(RSD=3.95%)、105.3%(RSD=3.50%),符合《中华人民共和国药典》2015版中对加样回收率的要求。
2.5 样品含量测定
采用2.2项供试品溶液的制备方法与2.3项的色谱检测条件对自不同产地的38份白术样品进行提取与检测,计算白术内酯Ⅰ、Ⅱ、Ⅲ的含量,测定结果见表1。白术内酯Ⅰ平均质量分数为(0.101±0.044)%,以湖南和四川产较高,安徽产最低;白术内酯Ⅱ平均质量分数为(0.028±0.021)%,以湖南产最高,河北产最低;白术内酯Ⅲ平均质量分数为(0.041±0.045)%,以湖南和四川产较高,安徽、河北和浙江产均较低。其中湖南和四川两个产地的3种内酯成分含量均较高,而道地产区浙江白术的含量居于中等或较低。
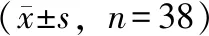
表1 白术药材含量测定结果及方差分析 %
注:a、b、c为Duncan表示值,字母不同表示差异有统计学意义(P<0.05)。
2.5.1 基于3种白术内酯含量的PCA分析 对浙江、四川等不同产地的38份白术中3种白术内酯含量数据进行PCA分析,结果表明,不同产地的白术具有较好的分离趋势(R2X=0.858,Q2=0.148),见图2A。表明不同产地来源的白术药材具有较明显的分离趋势,提示不同产地的白术质量具有一定的差异性,其中传统道地产区浙江产白术较为稳定。
注:A.3种白术内酯含量的PCA得分图;B.系统聚类图。图2 3种白术内酯含量的PCA得分图及系统聚类图
2.5.2 基于3种白术内酯含量的聚类分析 以3种白术内酯含量为变量,采用组间联接的聚类方法,以平方欧氏距离为测量方法,获得38份白术样品的聚类分析图,见图2B。系统聚类分析结果与PCA分析较为一致,浙江产地的白术除S7号样品外,其余样品与河北S16、S18号,湖南S13号以及湖北S14、S17号样品同时聚为一类。安徽4份样品与河北S17号、湖北S35号以及广西S38号样品聚为一类。四川与湖南产地的样品之间交叉聚类,其中四川产地的S28、S32与湖南S11、S12、S23、S24号样品聚为一类,而湖南S25号样品与其余四川样品聚为一类。
2.6 指纹图谱分析
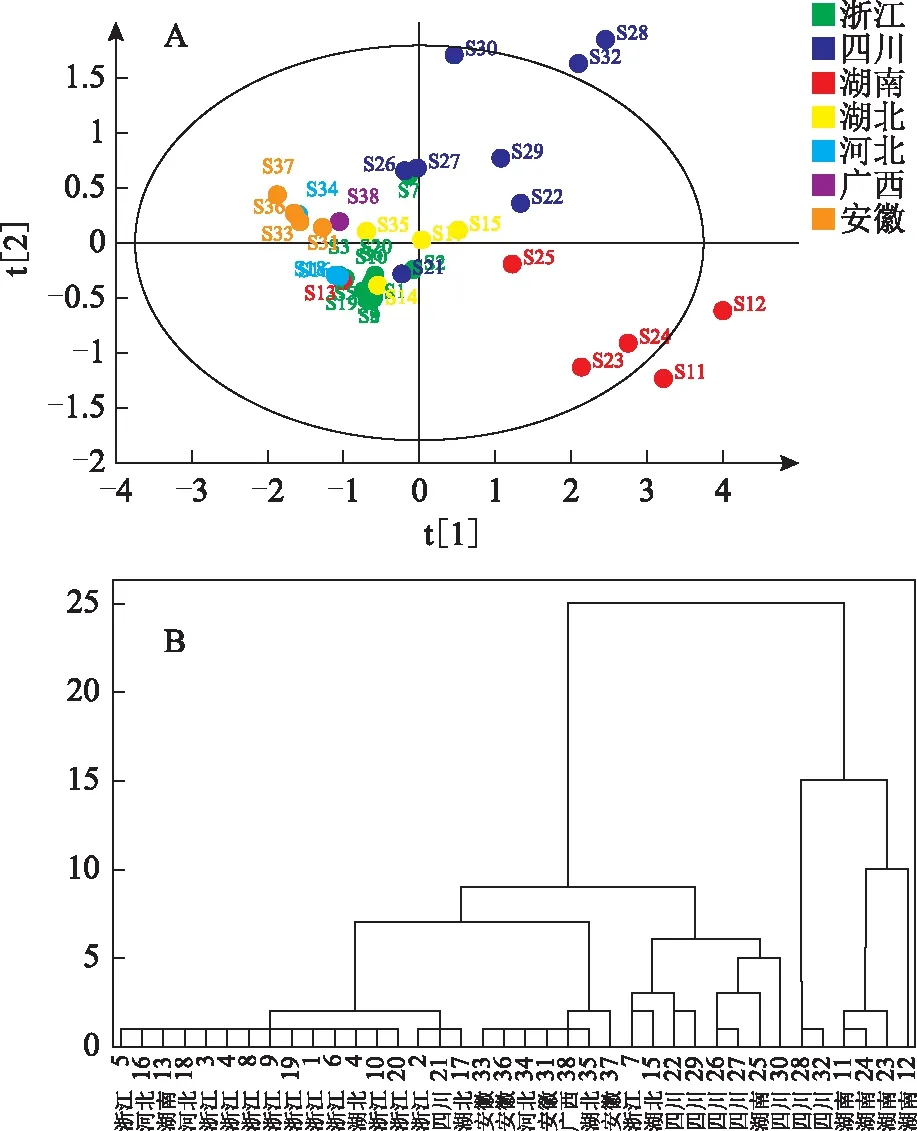
将220 nm下检测的数据结果以AIA格式导入《中药色谱指纹图谱相似度评价系统》(2004 A版),选定S1号样品为参照色谱图,采用平均数法,时间窗为0.1,经多点校正、图谱自动匹配,以校正保留时间,使色谱峰对齐,生成对照指纹色谱图,38份白术药材的指纹图谱叠加图及对照指纹图谱见图3。从匹配结果中可以看出有21个共有峰。对比38份白术药材的HPLC图可发现,不同批次药材的峰容量基本相似;由表2中峰面积RSD值可知,不同批次药材共有峰的峰面积差异较大。根据各共有峰的峰形、保留时间、分离情况以及峰高等信息,本次研究选定以1、2、3、4、5、6、7、8、9、10号色谱峰为白术药材的特征峰。与对照品比较可知,1号色谱峰为白术内酯Ⅲ,5号色谱峰为白术内酯I,再根据出峰时间、峰高及参考文献[15]等信息暂可确定9号峰为苍术酮。由于9号色谱峰的对称性好、峰较高,且与相邻色谱峰达到基线分离,故选定9号色谱峰为参照峰(S),分别计算对照指纹色谱图中各共有峰的相对保留时间以及相对峰面积,其中,保留时间与峰面积数据均由《中药色谱指纹图谱相似度评价系统》(2004 A版)导出,结果见表2。
注:A.HPLC指纹图谱叠加图;B.对照指纹图谱。图3 38份白术样品HPLC指纹图谱叠加图及对照指纹图谱
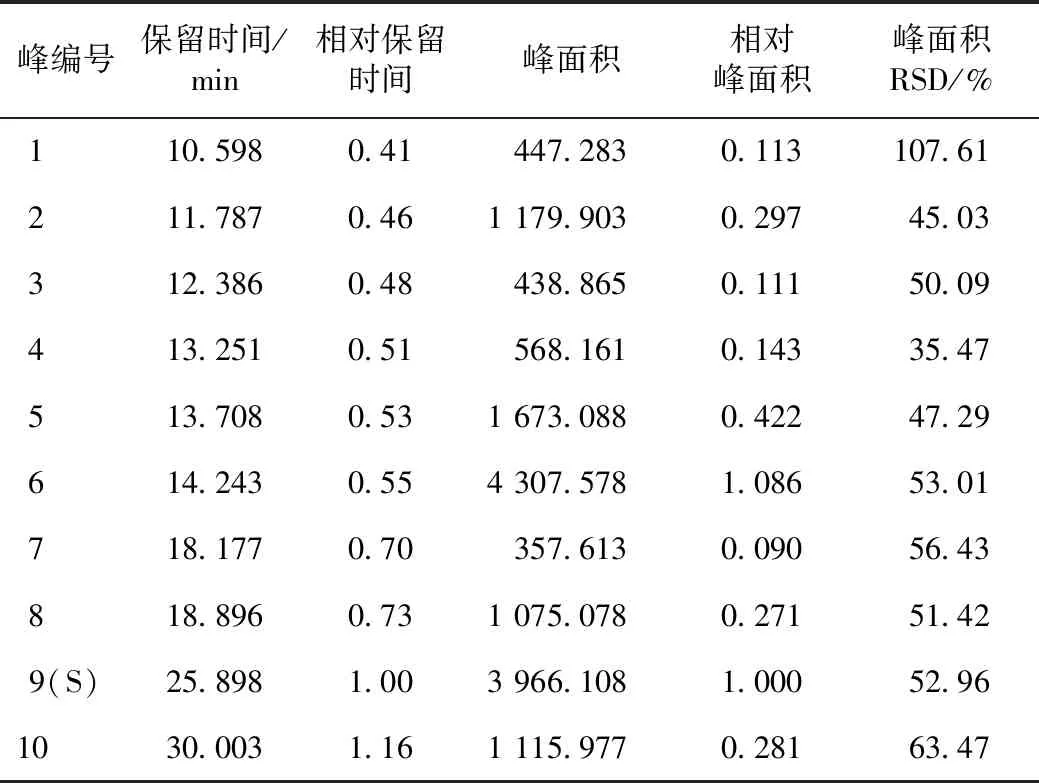
表2 白术样品特征图谱共有峰的保留时间及峰面积
2.6.1 相似度分析 由中药色谱指纹图谱相似度评价系统(2004 A版)计算38份样品的指纹图谱的相似度,与对照指纹图谱相比较,其相似度介于0.677~0.994。浙江白术的相似度除S4号样品外,其余样品相似度均大于0.95,进一步表明浙江产白术的稳定性较高。四川与湖南产地白术的相似度均低于0.95,四川白术相似度介于0.667~0.926,表明四川与湖南产地的白术差异性较大,可能与其白术内酯I、Ⅲ含量偏高有关,其中,S30号样品的相似度最低,仅为0.667,可能是由7、8号色谱峰较低所引起。
2.6.2 不同产地白术的PCA分析 以共有峰的峰面积为变量,对38份不同产地的白术进行PCA分析,多个产地的白术大致分为3个区域(R2X=0.765,Q2=0.424),见图4A。湖南为一个区域,浙江与湖北为一个区域,四川与安徽为一个区域。湖南白术中S13、S15号样品与其他样品分离,二者相似度分别处于湖南白术相似度的两个极值,S13样品的相似度为0.942,与浙江样品相似。湖北样品除35号(相似度为0.899)外,其余3份样品与浙江样品相近。四川与安徽样品之间相互交叉,表明两产地白术具有较高的相似性。
2.6.3 不同产地白术的系统聚类分析 以共有峰的峰面积为变量,采用组间联接的聚类方法,以平方欧氏距离为测量方法,获得38份白术样品的聚类分析图,见图4B。从聚类分析图可看出,38份样品被聚为2大类,一类主要包含四川与安徽产白术,另一类主要是浙江、湖南产白术。从系统聚类分析结果可看出,不同产地的白术药材具有一定的地域性差异。整体来看,浙江样品基本上聚为一类,表明浙江产白术内在质量的一致性较好。
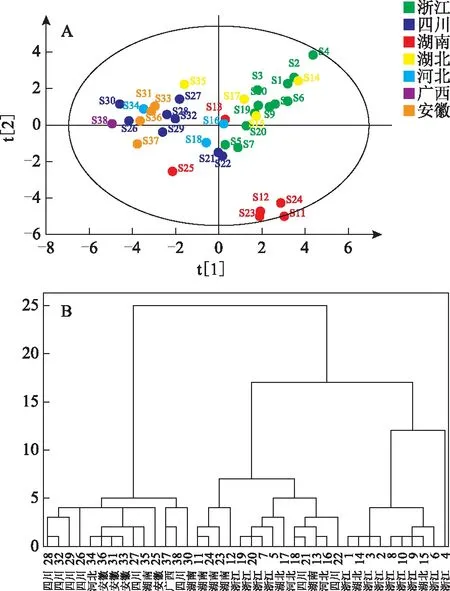
注:A.共有峰峰面积的PCA得分图;B.聚类分析图。图4 不同产地白术共有峰峰面积的PCA得分图及聚类分析图
4 讨论
本文建立了简便、快速的测定白术药材3种内酯类成分的含量测定方法和指纹图谱,能够较好地评价和控制白术药材的质量。本研究对提取溶剂及用量进行考察,比较了不同体积的甲醇、70%乙醇以及乙醇溶剂的提取效果,确定以50 mL甲醇超声提取一次为样品提取方法。相比参考文献[14]使用70%乙醇溶液提取两次,方便快捷。
指纹图谱与含量测定方法是中药材常用的质量控制方法。本实验测定了白术药材中的3种白术内酯含量,同时建立了白术药材的特征图谱。38份白术药材的指纹图谱中有21个共有峰,根据色谱峰的峰形、分离情况等选定其中10个峰作为白术的特征峰,为白术药材的鉴别和质量稳定性提供评判依据。从含量测定结果中可看出,白术内酯Ⅲ的含量较低且差异性较大,若以《香港中药材标准》白术内酯Ⅲ的含量限度(不低于0.019%)为检测标准时,则本实验的38份样品中有20份是不合格的,即便是道地产区浙江白术也仅有1份样品的白术内酯Ⅲ高于0.019%,显然,以白术内酯Ⅲ不低于0.019%为标准控制白术质量是值得商榷的,有待进一步研究。
为了更充分地反映不同来源白术内在质量差异性,本文以38份白术药材中3种白术内酯含量和指纹图谱共有峰数据为因子,采用多元统计分析(聚类分析与PCA分析)进一步比较。结果均显示,产地是影响白术药材内在质量差异的重要因素,不同来源白术药材内在质量差异较大,所建立的含量测定方法和指纹图谱技术能够较准确反映药材质量,且两者结果较为一致。从统计分析可看出浙江产区的白术具有较好的一致性,且浙江为白术的道地产区,故选用浙江产地的白术样品对3种白术内酯的最低含量限度进行探讨。以每种成分平均质量分数的80%作为最低含量限度。浙江白术样品共12份,其白术内酯Ⅰ、Ⅱ、Ⅲ的平均质量分数分别为0.103%、0.017%、0.014%,计算得出白术内酯Ⅰ、Ⅱ、Ⅲ的最低质量分数限度分别为0.082%、0.014%、0.013%。12份样品的白术内酯Ⅰ质量分数均高于0.082%,10份样品的白术内酯Ⅱ质量分数高于0.014%,由于白术内酯Ⅲ质量分数差异性较大,仅有3份样品的白术内酯Ⅲ质量分数高于0.013%,故白术内酯Ⅲ最低含量限度仍需进一步探讨,其中0.013%可为进一步的研究提供参考。
