人参水煎煮的科学性探索
——水煎煮引发人参皂苷化学结构的转化△
2019-08-21杨秀伟张雷
杨秀伟,张雷
北京大学 药学院 天然药物学系/天然药物及仿生药物国家重点实验室,北京 100191
传统中药人参(Ginseng Radix et Rhizoma)系五加科多年生草本植物人参PanaxginsengC.A.Mey.的干燥根和根茎,驰名中外,获誉“百草之王”。早在远古皇帝时代,有关人参的神奇功效就已为人所知,人参已有4000多年的应用历史;为了满足需要,西晋末年,已经开始栽培人参,距今已有1600多年的历史。有关人参的记载,见于春秋时期越国宰相范蠡著《范子计然》一书,书中有“人参出上党,状类人形者善”的描述。我国最早的药学典籍《神农本草经》记载“人参味甘,主补五脏、安精神、定魂魄、止惊悸、除邪气、明目、开心、益智,久服轻身延年”。东汉时期名医张仲景所著《伤寒论》一书中共有113个成方,其中含有人参的配方达21个,并论述人参具有“温补、滋润、强壮、强精、保温、增强视力、安定精神”等作用。从古至今,人参或以“独参汤”形式药物应用,或以“配方”形式药物应用,民间作为补品煲汤饮用。自1963年科学家从人参中分离鉴定出人参皂苷(ginsenoside,G)[1-2]以来,现代科学研究已充分证明,人参皂苷几乎反映了人参的全部药理学作用。由于人参为水煎剂形式用药,本文探讨人参水煎煮的科学性——水煎煮引发人参皂苷化学结构的转化。
1 仪器与材料
1.1 仪器
岛津LCMS-8050超高效液相色谱-质谱联用仪,包括Nexera X2 UFLC液相系统:LC-30AD二元泵、SIL-30AC自动进样器、SPD-M30A检测器、CTO-20AC柱温箱;8050型三重四级杆定量质谱:配备ESI离子源和LabSolution工作站;Mettler XS105DU十万分之一电子天平(METTLER TOLEDO,Zurich,Switzerland);AR4120型万分之一电子天平[奥豪斯国际贸易(上海)有限公司];KQ5200超声波清洗仪(昆山市超声仪器有限公司,功率:200 W,频率:40 kHz)。
1.2 材料
人参饮片(批号:PG-Y-201606)购自河北安国药材市场,经本文作者之一杨秀伟教授鉴定为PanaxginsengC.A.Mey.的干燥根和根茎。
对照品人参皂苷G-Re(1)、G-Rb1(2)、20(S)-G-Rh1(3)、20(S)-G-Rg2(4)、20(R)-G-Rg2(5)、G-Rc(6)、20(R)-G-Rh1(7)、G-Rb2(8)、G-Rb3(9)、G-Rd(10)、G-Rg6(11)、G-F4(12)、G-Rk3(13)、G-Rh4(14)、20(S)-G-Rg3(15)、20(R)-G-Rg3(16)、20(S)-PPT(17)、20(R)-PPT(18)、G-Rk1(19)、G-Rg5(20)、20(S)-G-Rh2(21)、20(R)-G-Rh2(22)、20(S)-PPD(23)、20(R)-PPD(24),系本课题组从生晒参[3]、红参[4]、人参茎叶[5]或人参茎叶总皂苷酸水解产物[6]中分离制备,纯度经LC-MS验证均大于98%。以上24个对照品的结构式见图3~4。
LC-MS级别乙腈和甲醇购自Fisher Scientific Inc.(Pittsburgh,PA,USA);色谱纯级别乙腈、甲醇为天津西华特种试剂厂产品;超纯水(18 MΩ·cm-1)为本实验室用Milli-Q Advantage A10(Millipore,Billerica,USA)制水机自制;HPLC级别醋酸铵购自Sigma-Aldrich(Lot#BCBK6717V,Sigma-Aldrich,Co.,MO,USA)。
2 实验条件和方法
2.1 实验条件
液质分析C18色谱柱为Waters ACQUITY UPLC©BEH Shield RP18(100 mm×2.1 mm,1.7 μm,Part#186002854,Ser# 01603514816023,Made in Ireland);配有相同填料预柱Waters ACQUITY UPLC©BEH Shield RP18VanGuardTM Pre-Column(5 mm×2.1 mm,1.7 μm,Part#186003977,Lot#0158351601,Made in Ireland)。流动相为0.5 mmol·L-1醋酸铵水溶液(流动相A)和乙腈(流动相B)。采用梯度洗脱方式,梯度洗脱程序:0~3 min,20%~22%B;3~5 min,22%~30%B;5~9 min,30%~33%B;9~11 min,33%~35%B;11~13 min,35%~42%B;13~23 min,42%~47%B;23~24 min,47%~52%B;24~29 min,52%~55%B;29~29.1 min,55%~60%B;29.1~34 min,60%~65%B;34~36 min,65%~95%B。流速设为0.4 mL·min-1,柱温控制在30 ℃,进样体积为1 μL。
质谱参数优化结果如下:雾化气流速:3 L·min-1;干燥气流速:10 L·min-1;加热气流速:10 L·min-1;接口加热器温度:300 ℃;脱溶剂管温度:250 ℃;接口电压:-3.0 kV;检测器电压:1.80 kV。电离源为电喷雾离子源,扫描方式为多反应监测,扫描模式为负离子模式。
2.2 混合对照品溶液的配制
精密称取各对照品适量,溶解于质谱级别甲醇中,制成质量浓度为1.0 mg·mL-1的对照品储备液,分别移取适量储备液混合并稀释制成混合对照品母液。连续稀释混合对照品母液得到一系列混合对照品线性工作液。
2.3 分析样品的制备
2.3.1 水超声提取 人参饮片粉碎过40目筛,准确称取1 g加入40 mL水,常温下超声提取两次,每次1 h,过滤,即得25 mg·mL-1(以生药计)样品溶液。再次用水稀释至0.5 mg·mL-1(以生药计),平行制备两份样品。
2.3.2 水回流提取 称取人参饮片5 g,加入275 mL蒸馏水,水回流提取2 h,过滤。滤渣再次加入275 mL蒸馏水回流2 h,过滤后合并两次滤液,水浴蒸至约50 mL,加入100 mL乙醇使醇浓度约为65%,4 ℃静置过夜,在3000 r·min-1离心10 min,收集上清。上清减压浓缩除去乙醇后冷冻干燥,称质量,密封保存。分析前分别称取适量提取物溶解于甲醇制成25、0.5 mg·mL-1(以生药计)的样品溶液,平行制备两份样品。
3 结果与讨论
在本课题组前期[7]对人参皂苷UFLC-MS/MS研究的基础上,本研究发现,所有分析物均在负离子模式下有最大的响应。各分析物优化得到的保留时间、离子对信息、Q1能量、碰撞能量、Q3能量和滞留时间信息见表1。
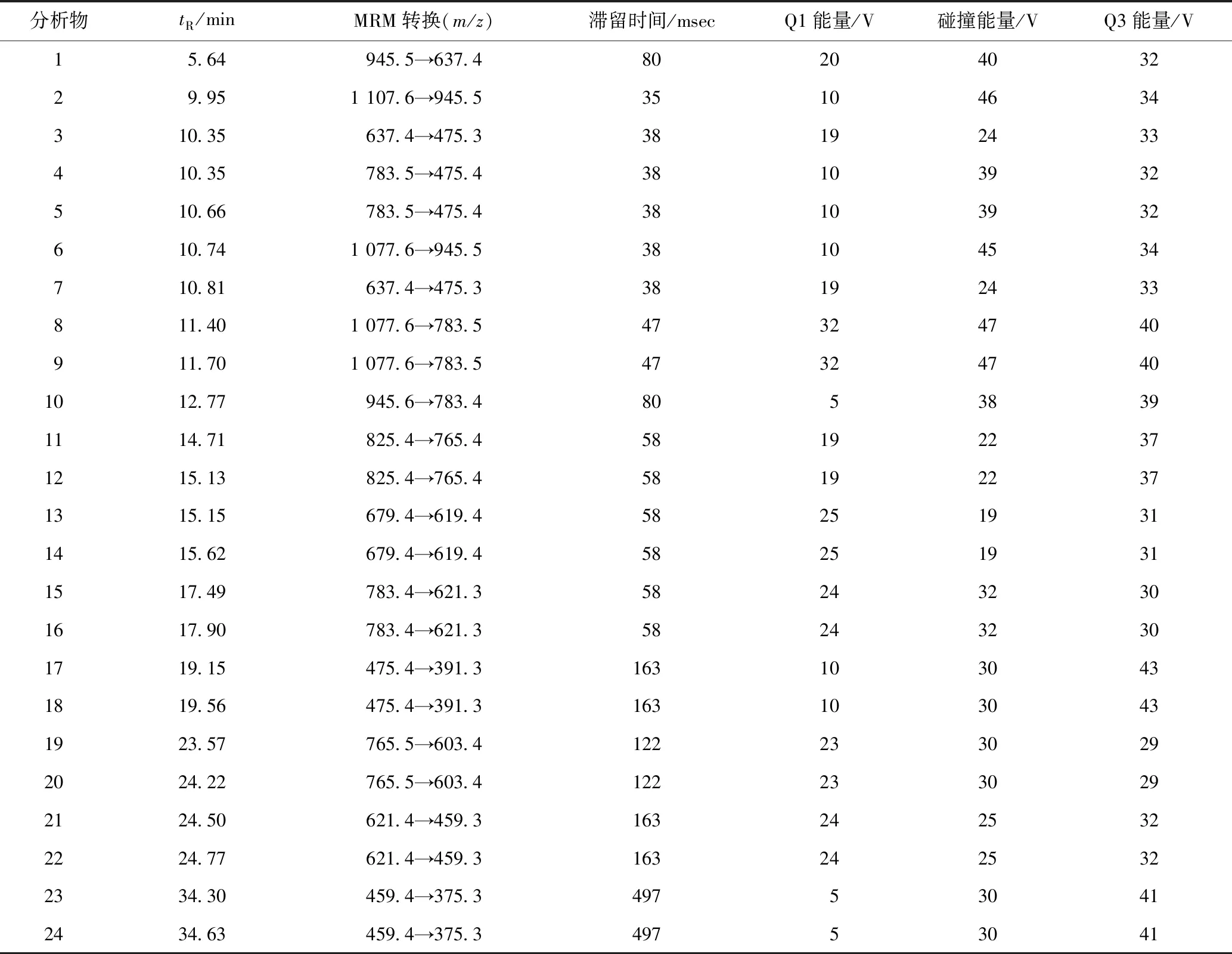
表1 24个分析物保留时间及最优离子化参数
分别对分析方法的专属性、系统适用性、线性、定量下限和检测下限、重复性、提取回收率和稳定性进行了方法学考察,结果表明,该方法能够用于上述24个分析物的含量测定[8]。(数据略)。
图1为水超声法提取人参饮片得到的MRM叠加图,图2为水回流提取人参饮片得到的MRM叠加图,根据建立的UFLC-MS/MS对两种提取物的定量分析结果总结见表2。

图1 水超声提取样品中24个分析物的MRM叠加图

图2 水回流提取样品中24个分析物的MRM叠加图
常规上,如果将中药粉末置于水中在常温下提取,获得的基本上是天然的原形化合物;而热水回流提取可能得到人工产物。一般来说,人参中的原人参二醇型(protopanaxadiol,PPD)达玛烷四环三萜在C-3或C-20结合糖链,天然者的手性C-20呈S型;原人参三醇型(protopanaxatriol,PPT)达玛烷四环三萜在C-6或C-20结合糖链,天然者的手性C-20呈S型。表2定量分析结果表明,室温下超声提取,人参饮片中化合物3[20(S)-G-Rh1]、4[20(S)-G-Rg2]等收率较低,但热回流的情况下其收率上扬。同时也可以观察到,人参饮片中不含有它们的C-20差向异构体(epimer),即化合物5[20(R)-G-Rg2]和7[20(R)-G-Rh1],但在热回流的情况下出现了化合物5和7,此已被许多研究所证实,即在人参加热提取或煎煮处理中,天然的20(S)型PPD和/或PPT达玛烷四环三萜易向20(R)型差向异构体转化,这种转化的结果不仅表现在它们溶解度上的改变,而且对其生物活性具有很大影响[2],如表3所示的某些达玛烷四环三萜对肿瘤细胞的细胞毒活性。

表2 不同提取方法人参提取物中人参皂苷的含量 mg·g-1
注:—表示未检测到。

表3 某些达玛烷四环三萜对肿瘤细胞的细胞毒活性 μmol·L-1
表2结果显示,化合物5、7、11~24不存在于人参饮片中,但在热回流处理人参饮片的情况下,这些化合物出现了。化合物1(G-Re)、2(G-Rb1)、6(G-Rc)、8(G-Rb2)、9(G-Rb3)和10(G-Rd)是生晒参中普通化合物[1,9-10],除G-Rd外,它们应该是人参中的天然化合物,G-Rd很可能是天然人参皂苷生物合成的中间体或降解产物,有待研究证实。根据表2的检测结果和化合物的化学结构特性,推测PPD型人参皂苷可能通过热致活化水提供的能量促进糖苷键断裂,发生非酶促反应,产生一系列降解产物,见图3。G-Rb1、G-Rb2、G-Rb3、G-Rc等作为起始物逐级降解,产生结构多样性的降解产物。
从表2结果也可看出,随着煎煮,G-Rb1、G-Rb2、G-Rb3、G-Rc等的收量也在提高,可能来源于G-Ra1、G-Ra2、G-Ra3、G-Rs1、G-Rs2、G-Rs3[1],丙二酰基人参皂苷(malonylginsenoside,MG)Rb1、Rb2、Rc等。作为PPT型人参皂苷可能通过热致活化水提供的能量促进糖苷键断裂,发生非酶促反应,产生一系列降解产物,见图4。典型的降解反应,如从G-Re开始等,产生少糖基的稀有人参皂苷(rare ginsenoside)。

图3 水煎煮所致PPD型人参皂苷的可能降解途径

图4 煎煮所致PPT型人参皂苷的可能降解途径
4 讨论
人参中的G-Rb1、Rb2、Rb3、Rc、Re、Rg1等称之为普通人参皂苷,存在于生晒参中。而目前将它们的降解、少糖基产物称之为稀有人参皂苷,如G-Rg5、Rh1、Rh2、Rh3、Rh4、Rk1、Rk2、Rk3等。由于稀有人参皂苷较普通人参皂苷的糖基少,脂溶性相对增强,相对易于渗透组织器官或细胞,容易到达“靶点”发挥作用。在SIRT1(silent information regulator two homologue 1)模型研究中,以G-Rb1为例,在10、20 μmol·L-1对SIRT1活性无激活作用,而其降解产物稀有人参皂苷20(S)-G-Rg3、20(R)-G-Rg3、G-Rg5[11]以及20(S)-PPD和20(R)-PPD[12]具有较强的SIRT1激活作用;在PPT型皂苷中,以G-Re为例,在10、20 μmol·L-1对SIRT1活性无激活作用,而其降解产物稀有人参皂苷G-F4、G-Rh4[11]以及20(S)-PPT和20(R)-PPT[12]具有较强的SIRT1激活作用,且有不同的药代动力学行为[13-15],无论是PPD型还是PPT型人参皂苷,总体趋势是糖基越少SIRT1激活活性越强。现代研究表明,SIRT1尤其是SIRT3与线粒体的能量代谢密切相关,此与人参传统功效的“大补元气”一致,提示其可能是人参延缓衰老的作用物质。普通人参皂苷向稀有人参皂苷的转化,改变了普通人参皂苷的活性[16]。如在临床上,更善于用红参治疗癌症。人参经过煎煮,G-Rg3含量大幅上升,G-Rg3已应用于临床治疗癌症。
稀有人参皂苷的作用也是多方面的,但近年在癌症、心脑血管疾病、肺纤维化疾病以及延缓衰老等方面的研究相对较多[2,17-21],有了相关的抗癌产品。构效关系研究[22-23]表明,某些稀有人参皂苷的抗癌细胞增殖大致有如下趋势:G-Rk2≈G-Rh3>G-Rh2>G-Rk1≈G-Rg5>G-Rg3>G-Rh1,而Δ20,21PPD≈Δ20,22PPD>Δ20,21PPT≈Δ20,22PPT。有关不同稀有人参皂苷抗不同癌细胞增殖,资料公布的上海药明康德合同研究组织(Contract Research Organization;CRO)测试结果见表4,具有一定的先导性。对人参地上部分化学物质的研究[12,22,24-27]提示含有更丰富的稀有人参皂苷。
人参方药热水煎煮,由水分子提供的活化能使人参皂苷化学结构发生变化,产生的稀有人参皂苷化学结构多样性更丰富,体现了人参生物活性的多样性。从对红参化学成分的研究[4,7,21],也佐证了人参水煎煮的科学内涵,而与用70%乙醇水溶液提取具有明显的区别[28]。
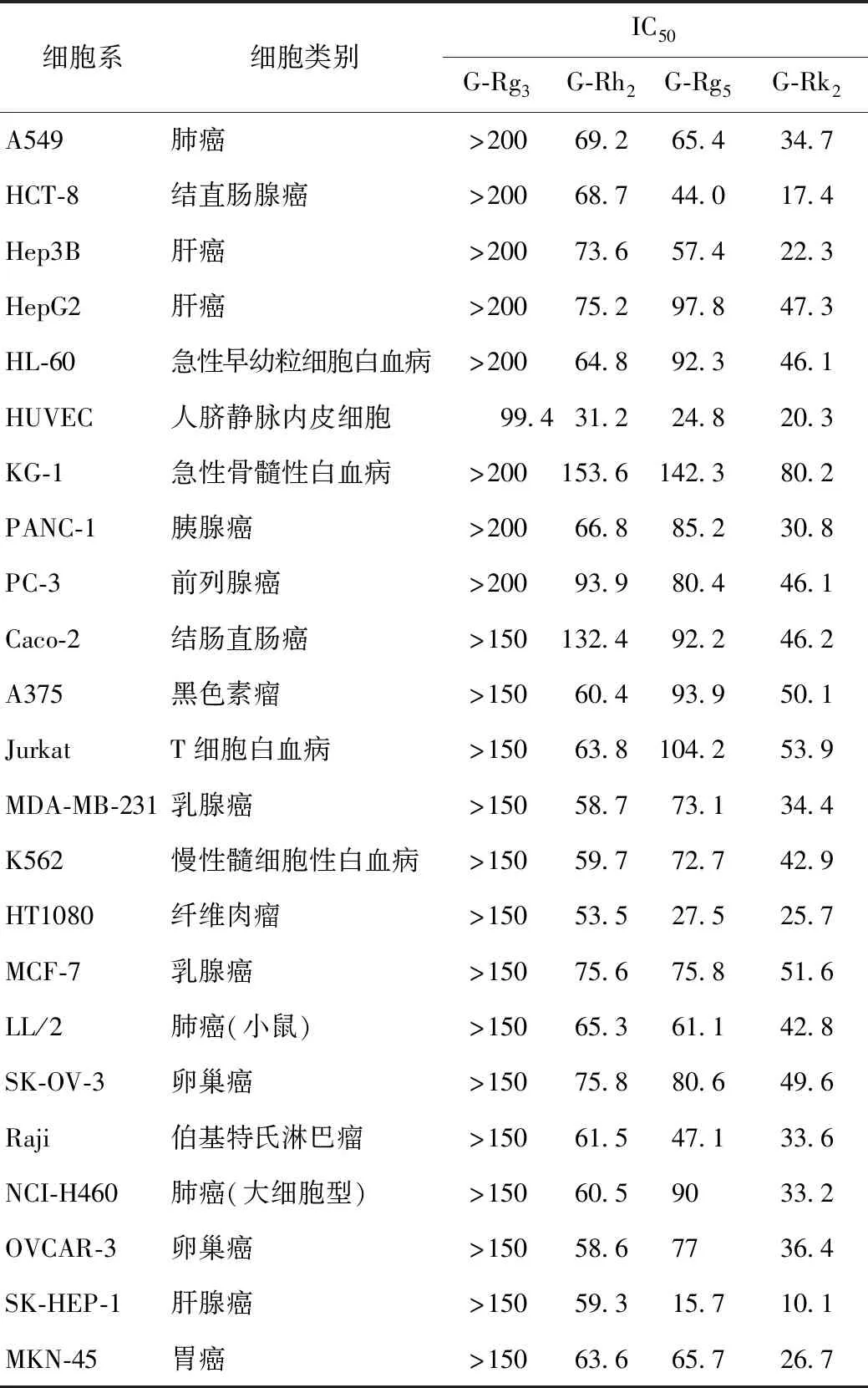
表4 上海药明康德CRO测试的某些稀有人参皂苷的细胞毒活性结果 μmol·L-1
