不同种植模式下丹参根际土壤微生物群落结构变化
2019-08-20杨贝贝杨如意
王 悦,杨贝贝,王 浩,杨 程,张 菊,朱 濛,杨如意
1 安徽师范大学环境科学与工程学院, 芜湖 241002 2 安徽省水土污染治理与修复工程实验室, 芜湖 241002
丹参(SalviamiltiorrhizaBunge)是唇形科(Lamiaceae)鼠尾草属的一种多年生草本植物,以干燥的根和根状茎入药(Danshen)。丹参是一味常用的传统中药材,对冠心病、心胶痛、心肌梗死和高血压等心血管系统疾病具有显著疗效[1],其植株浸提液还具有抗菌、抗氧化、抗肿瘤和抗炎症等功能[2- 5]。丹参属大宗中药材,市场需求量大,但野生资源稀缺,适宜人工栽培的道地产区也非常有限,导致其栽培地重茬连作现象十分普遍。长期连作造成丹参枯萎病、根腐病、根结线虫病加剧,生长势减弱,黄苗、死苗、裂根等现象严重,有效成分含量和商品率逐年下降,产生连作障碍(continuous cropping obstacles)[6]。连作障碍在人参(PanaxginsengC. A. Meyer)、地黄(Rehmanniaglutinosa(Gaetn.) Libosch. ex Fisch. et Mey.)、三七(Panaxnotoginseng(Burk.) F.H. Chen)、黄芩(ScutellariabaicalensisGeorgi)、当归(Angelicasinensis(Oliv.) Diels)等其他中药材栽培过程中也普遍存在,且影响非常严重。因此,研究连作障碍的发生机理对于提出合理有效的消减措施,保障中药材生产的可持续发展和药材资源供应的安全性具有重要的理论和现实意义。
丹参连作障碍的发生机理十分复杂,包括化感自毒作用、根际理化环境失衡,以及微生物区系的变化[7- 8]等。近年来,从植物-土壤-微生物组成的根际微生态系统探讨连作障碍的成因和消减措施已成为一个新的研究思路和重要的发展趋势[9- 11]。丹参根际次生代谢物的产生与释放,以及在环境介质中的迁移、转化、降解等过程与根际微生物之间存在密切的相互作用。研究发现,蜡状芽孢杆菌(Bacilluscereus)、丛枝菌根真菌(Glomusmosseae)和内生菌等不仅能够促进丹参根系的生长,而且会诱导其产生更多丹参酮和丹酚酸B[12- 14]。但是,连作条件下大量次生代谢物的积累将改变土壤中微生物的群落结构,使根际微生态系统失衡,从而对植物产生负反馈[15]。已有研究证实,丹参酮和丹酚酸B等均具有很强的抑菌作用[2,16],会导致根际放线菌和真菌群落结构发生明显变化[8],有益微生物数量减少,致病菌增加,使丹参更易受病原菌侵染,抗逆性降低[9, 17]。在农林生产实践中,轮作、间作、套作可以有效缓解连作障碍,这与植物根系之间的地下化学作用有关[18],但相关的微生态机理尚不清楚。
安徽省亳州市是国家科技部批准建立的中药特色产业基地,具有多年从事丹参栽培和加工的历史。本课题组于2016年6月调研发现,连作两年以上丹参即出现黄苗和枯萎现象(枯苗率10%—20%),产量和品质严重下降,与玄参(ScrophularianingpoensisHemsl.)、桔梗(Platycodonisradix)等其他根类药材实行轮作方可缓解(枯苗率<5%)。本研究通过高通量测序对比分析了轮作、连作、套作3种栽种模式下丹参根际微生物群落的变化,尝试从微生态系统的变化阐明丹参连作障碍的发生机理,为缓解这一重大生产难题,加快建立道地中药材生产质量管理规范化(Good Agricultural Practice, GAP)基地提供科学依据。
1 材料与方法
1.1 采样点概况和样品采集
本研究采样点位于安徽省亳州市谯城区十八里镇的一处中药材种植基地(33°52′48″N, 115°46′12″E)。该地位于皖豫交界处,地势平坦,属于暖温半湿润季风性气候,雨热同季,年均降水量约821.3 mm,年均气温约14.9℃,年均日照约2184 h。土壤质地属沙质或沙淤两合土质,种植有丹参、白芍(PaeonialactifloraPall.)、桑(MorusalbaL.)、桔梗、亳菊(Chrysanthemummorifoliumcv. Boju)等中药材,种植历史悠久。
本研究采集的丹参包括3种种植模式:即与桔梗轮作1年(rotation cropping monoculture, RCMO),连作2年(continuous cropping monoculture, CCMO)和与白芍连续套作2年(intercropping mix-culture, ICMI)。轮作或连作丹参的密度约为112500—120000株/hm2,套作丹参的密度约为60000株/hm2,白芍密度约为45000株/hm2。白芍种植时间为10月,次年3—4月套作丹参。
每种种植模式随机选取3个面积为2 m×2 m的样方,将样方内的丹参整株取出,采用抖根法收集根际土壤,同一样方内的土样混合均匀作为一个混合样,所有土壤样品立即带回实验室,4℃冰箱保存。混匀的土样一部分风干保存,测定土壤理化性质,另一部分新鲜土壤用于提取微生物总DNA进行高通量测序。
1.2 实验方法
1.2.1土壤理化性质测定
称取过1 mm筛孔的风干土10 g,加入1 mol/L的KCl溶液25 mL(土水比为1∶2.5),摇匀30 min后用pH计测定土壤pH。土壤氧化还原电位(oxidation reduction potential, ORP)采用铂电极法测定。土壤有机质采用K2Cr2O7-H2SO4稀释热法测定[19]。土壤全磷和速效磷浓度分别采用H2SO4-HClO4消解和HCl-H2SO4浸提,钼铵蓝比色法进行测定[19]。同时,称量100 g新鲜土壤在105℃烘箱干燥8小时计算土壤含水率。
1.2.2细菌宏基因组16S rDNA测序
利用土壤基因组DNA提取试剂盒(E.Z.N.ATMMag-Bind Soil DNA Kit, OMEGA)提取细菌总DNA。总DNA用琼脂糖凝胶检测DNA完整性,然后用于 PCR扩增。利用Qubit2.0 DNA检测试剂盒对基因组DNA精确定量,以确定PCR反应加入的DNA量。PCR所用的引物已经融合了Miseq测序平台的V3—V4通用引物(341F/805R)。
PCR体系包括2×Taq master Mix 15 μL、Bar-PCR primer F (10 μmol/L) 1 μL、primer R (10 μmol/L) 1 μL、Genomic DNA 10—20 ng,补充无菌水至30 μL。PCR扩增条件为:94℃预变性3 min;94℃变性30 s,45℃退火20 s、65℃延伸30 s,共5个循环;94℃变性20 s,55℃退火30 s、72℃延伸30 s,共20个循环;最后72℃延伸5 min。PCR结束后,引入Illumina桥式PCR兼容引物进行第二轮扩增。PCR体系包括2×Taq master Mix 15 μL、primer F (10 μmol/L) 1 μL、primer R (10 μmol/L) 1 μL、Genomic DNA 20 ng,补充无菌水至30 μL。PCR扩增条件为:95℃预变性30 s;95℃变性15 s,55℃退火15 s,72℃延伸30 s,共5个循环;最后72度延伸5 min。PCR结束后对扩增产物进行琼脂糖电泳,并对DNA进行回收。回收产物用Qubit2.0 DNA检测试剂盒定量,根据测得的DNA浓度,将所有样品按照1∶1的比例进行混合,混合后充分震荡均匀。等量混合时,每个样品DNA量取10 ng,最终测序浓度为20 pmol。该混合样品由上海生工生物工程有限公司进行后续的样品建库与宏基因测序。
1.2.3真菌宏基因组18S rDNA测序
真菌总DNA提取、检测方法与细菌相同,18S V4区通用引物为V43NDF/Euk_V4_R。
PCR体系包括10×PCR buffer 5 μL、dNTP (10 mmol/L each) 0.5 μL、Genomic DNA10 ng、Bar-PCR primer F(50 μmol/L) 0.5 μL、primer R (50 μmol/L) 0.5 μL、Plantium Taq (5 U/μL) 0.5 μL,补充无菌水至50 μL。PCR扩增条件为:94℃预变性3 min;94℃变性30 s,45℃退火20 s、65℃延伸30 s,共5个循环;94℃变性20 s,55℃退火30 s、72℃延伸30 s,共20个循环;最后72℃延伸5 min。PCR结束后,引入Illumina桥式PCR兼容引物进行第二轮扩增。PCR体系包括10×PCR buffer 5 μL、dNTP (10 mmol/L each) 0.5 μL、DNA 20 ng、primer F (50 μmol/L) 0.5 μL、primer R (50 μmol/L) 0.5 μL、Plantium Taq (5 U/μL) 0.5 μL,补充无菌水至50 μL。PCR扩增条件为:95℃预变性30 s;95℃变性15 s,55℃退火15 s,72℃延伸30 s,共5个循环;最后72℃延伸5 min。真菌PCR扩增产物的后续检测、回收、混合、建库、测序等处理与细菌的方法相同。
1.2.4丛枝菌根真菌侵染率测定
将新鲜丹参的须根剪下,用自来水将根部土壤冲洗干净,然后放置在FAA固定液(甲醛∶醋酸∶50%酒精=5∶ 5∶90)中固定,洗净固定液,加入10%的KOH溶液,90℃下水浴加热10 min,之后在10%的盐酸中酸化15 min,最后用酸性品红染色过夜。将须根剪成约2 cm的小段,用十字交叉法计算侵染率[20]。
1.3 分析方法
1.3.1数据分析
使用SPSS 17.0对土壤理化性质数据进行统计分析(SPSS, Inc., Chicago, IL),先进行正态分布和方差齐性检验(Normal distribution and homogeneity of variance test),然后做单因素方差分析(One way ANOVA)。不同处理的均值在5%的显著性水平下做LSD(Least significant difference)多重比较。
1.3.2微生物多样性、网络及相互作用分析
将多条序列按其序列间的距离进行聚类,根据序列之间的相似性作为域值分成操作分类单元(Operational taxonomic unit, OTU),序列相似性域值设为0.97。采用uclust软件(v1.1.579)对OTU进行聚类,uclust首先筛选出序列中最长的reads作为种子序列,找出所有与该序列的相似度在阈值范围内的序列,并归为一个类,而后依次执行此步骤,直到所有序列均完成聚类,每一个类作为一个OTU。
微生物Alpha多样性指标包括ACE指数、Chao1指数、香农-威纳指数(Shannon-Wiener index)、丰富度指数(richness)、均匀度和覆盖度,各指数的计算方法参见邵宗圆等人的方法[21]。
细菌群落Beta多样性可以用来比较多组样本之间的差别,本研究利用Fast UniFrac软件进行主坐标分析(Principal co-ordinates analysis, PCoA)。
选取丰富度高于1%或丰富度排序在前100位的物种,利用QIIME(v1.8.0)和SparCC软件(v1.0.0)分别进行网络(network)分析和微生物之间相互作用关系分析。
1.3.3基于Canoco软件的冗余分析(RDA)
利用Canoco(v 4.5, Centre for Biometry, Wageningen, The Netherlands)软件分析土壤理化因子和细菌群落之间的关系。首先,对丹参根际土壤细菌群落做降趋势对应分析(Detrended correspondence analysis, DCA)。结果显示,细菌的第一排序轴长度为0.594,真菌的第一排序轴长度为0.783,均小于3,因此本研究选择基于线性模型的冗余分析(Reundancy analysis, RDA)进行排序[22]。
蒙特卡罗置换检验(Monte Carlo permutation)用以检验限制性排序模型的显著性,置换次数选择默认值499次。预筛选(Forward selections)可以检验哪种环境因子对微生物群落组成有显著性的影响。根据预筛选的结果,通过偏冗余分析(partial RDA)的variation partitioning能够确定具有显著性影响的各因子的贡献率[22]。
2 结果
2.1 土壤理化性质
土壤理化性质见表1。结果显示,所有土壤均属于酸性土,不同样点的酸度有显著差异(P<0.05),其中连作两年的土壤pH最低,而轮作土壤pH最高。土壤呈氧化状态,轮作和连作土壤的ORP无显著差异,但套作土壤的ORP明显低于其他两种种植模式。土壤有机质在12.92—21.51 g/kg之间,含量较高,且呈现轮作<连作<套作的规律。连作两年的丹参根际土壤总磷和总钾均最低,但有效磷和有效钾的变化趋势与总磷和总钾有所不同。3种种植模式下,丹参根际土壤微生物量(以DNA含量计)没有明显差异,但呈现连作<套作<轮作的趋势。
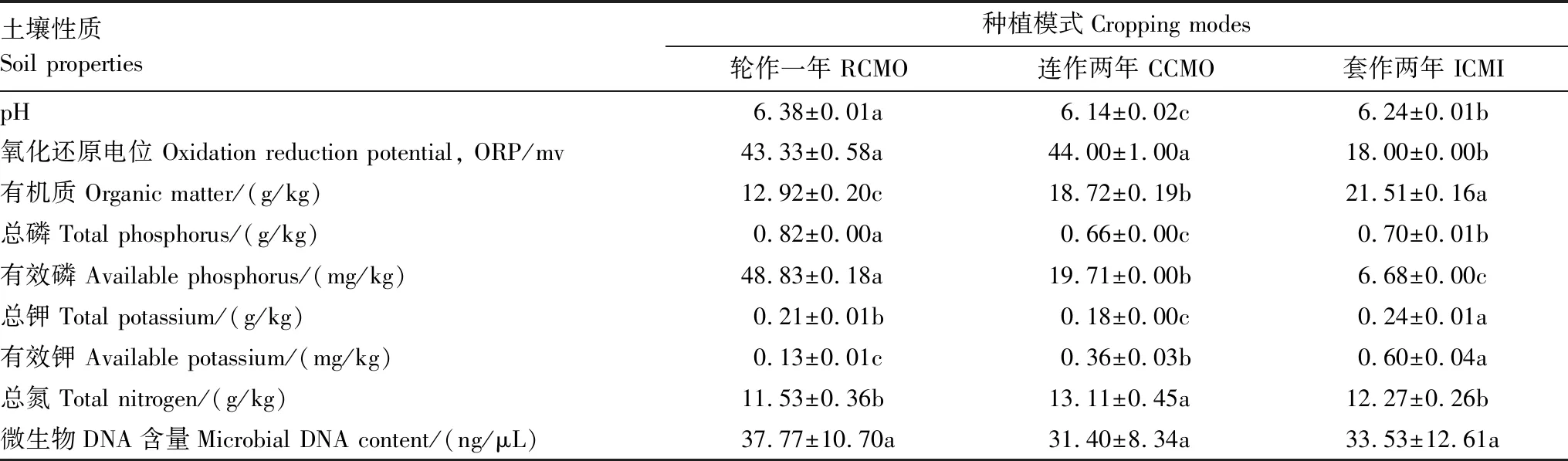
表1 土壤理化性质
表中数据为平均值±标准偏差, 不同字母标记的数值表示在5%的显著性水平下有显著性差异; RCMO: 轮作, Rotation cropping monoculture; CCMO: 连作, Continuous cropping monoculture; ICMI: 套作, Intercropping mix-culture
2.2 丹参根部AMF真菌的侵染率
本研究未单独分析丹参根际AMF的群落变化,仅测定了其侵染率。从表2可以看出,3种种植模式下丹参根部AMF真菌的侵染率有明显差异(P<0.05),其中连作两年的丹参根部AMF侵染率最低,仅为23.57%,而轮作丹参的侵染率最高,达44.67%。

表2 3种种植模式下丛枝菌根真菌对丹参的侵染率/%
2.3 丹参根际细菌群落结构变化
2.3.1细菌群落Alpha多样性
3种种植模式下测序文库的覆盖度均达到97%以上,说明绝大部分细菌的序列可以被测出,测序结果有较好的代表性。细菌丰富度指数通过OTU的个数来计算,可以衡量细菌的物种数,数量均在5000条以上,表明细菌丰富度非常高。轮作条件下,丹参根际细菌群落的香农-威纳指数显著高于连作和套作(P<0.05,表3),其他Alpha多样性指数在3种种植模式之间均无显著差异,但均呈现轮作>套作>连作的变化趋势。虽然都是种植两年,但套作丹参根际的细菌多样性明显好于连作。

表3 土壤细菌Alpha多样性指标
2.3.2细菌主要类群及分布
3种种植模式下,相对丰富度排名前10的优势细菌所占比例均达到94%以上,尽管排序有所差异,但前10个优势细菌门在3种种植模式中是相同的(图1),包括Proteobacteria(变形菌门)、Acidobacteria(酸杆菌门)、Gemmatimonadetes(芽单胞菌门)、Planctomycetes(浮霉菌门)、Actinobacteria(放线菌门)、Bacteroidetes(拟杆菌门)、Verrucomicrobia(疣微菌门)、Unclassified(未分类门)、Firmicutes(厚壁菌门)和Chloroflexi(绿弯菌门)。芽单胞菌门在轮作模式下占比仅为5.01%,与连作和套作相比明显下降(P<0.05)。其他细菌门在3种种植模式之间无明显差异,但是浮霉菌门和拟杆菌门在连作模式下的相对丰富度均低于其他两种模式。

图1 3种种植模式下主要细菌类群相对丰度Fig.1 Relative abundance of the major bacterial phylogenetic groups under three cropping modesRCMO: 轮作, Rotation cropping monoculture; CCMO: 连作, Continuous cropping monoculture; ICMI: 套作, Intercropping mix-culture
2.3.3细菌群落PCoA分析
由图2可见,3种种植模式中3 个重复并不聚类于同一象限,表明组内变异较大,3种种植模式之间细菌群落没有发生明显的分化。PCoA分析结果表明,细菌群落结构的变异受 8 个主坐标成分的控制(累积解释的总方差达100%),主坐标成分的特征值均大于0.769,其中前两个主坐标成分影响最大,分别能够解释 15.08%和 13.97%的变异,累积解释能力达 29.05%。但是,所有主坐标成分的特征值相差不大,说明本研究中影响土壤细菌群落结构的主导因子并不明显。

图2 3种种植模式下细菌群落PCoA聚类分析 Fig.2 Principal coordinates analysis (PCoA) of bacterial communities under three cropping modes
2.4 丹参根际真菌群落结构变化
2.4.1真菌群落 Alpha多样性
真菌群落的丰富度均在600条以上,数量显著低于细菌。由于数量相对较少,3种种植模式下测序文库的覆盖度均达到100%,表明测序结果有较好的代表性。真菌群落的所有Alpha多样性指数在3种种植模式之间均无明显差异(P>0.05,表4),但是除了覆盖度和辛普生指数以外,均呈现轮作>套作>连作的变化趋势。

表4 土壤真菌Alpha多样性指标
2.4.2真菌的主要类群及分布
共发现9个真菌门,其中未分类门相对丰富度最高,除此之外其他所有真菌门的相对丰富度在31.96%—51.48%,说明土壤中已知真菌类群较少,尤其是连作模式(图3)。已知真菌主要包括Ascomycota(子囊菌门)、Basidiomycota(担子菌门)、Zygomycota(接合菌门)、Chytridiomycota(壶菌门)、Neocallimastigomycota(新丽鞭毛菌门)、Glomeromycota(球囊菌门)、Fungi_Incertae_Sedis(未知菌门)和Blastocladiomycota(芽枝霉菌门)等。除未分类门以外,子囊菌门在所有种植模式中的相对丰富度最高,但是套作(15.22%)显著高于连作(9.31%)。同样,轮作模式下接合菌门和壶菌门的相对丰富度也显著高于连作模式(P<0.05)。
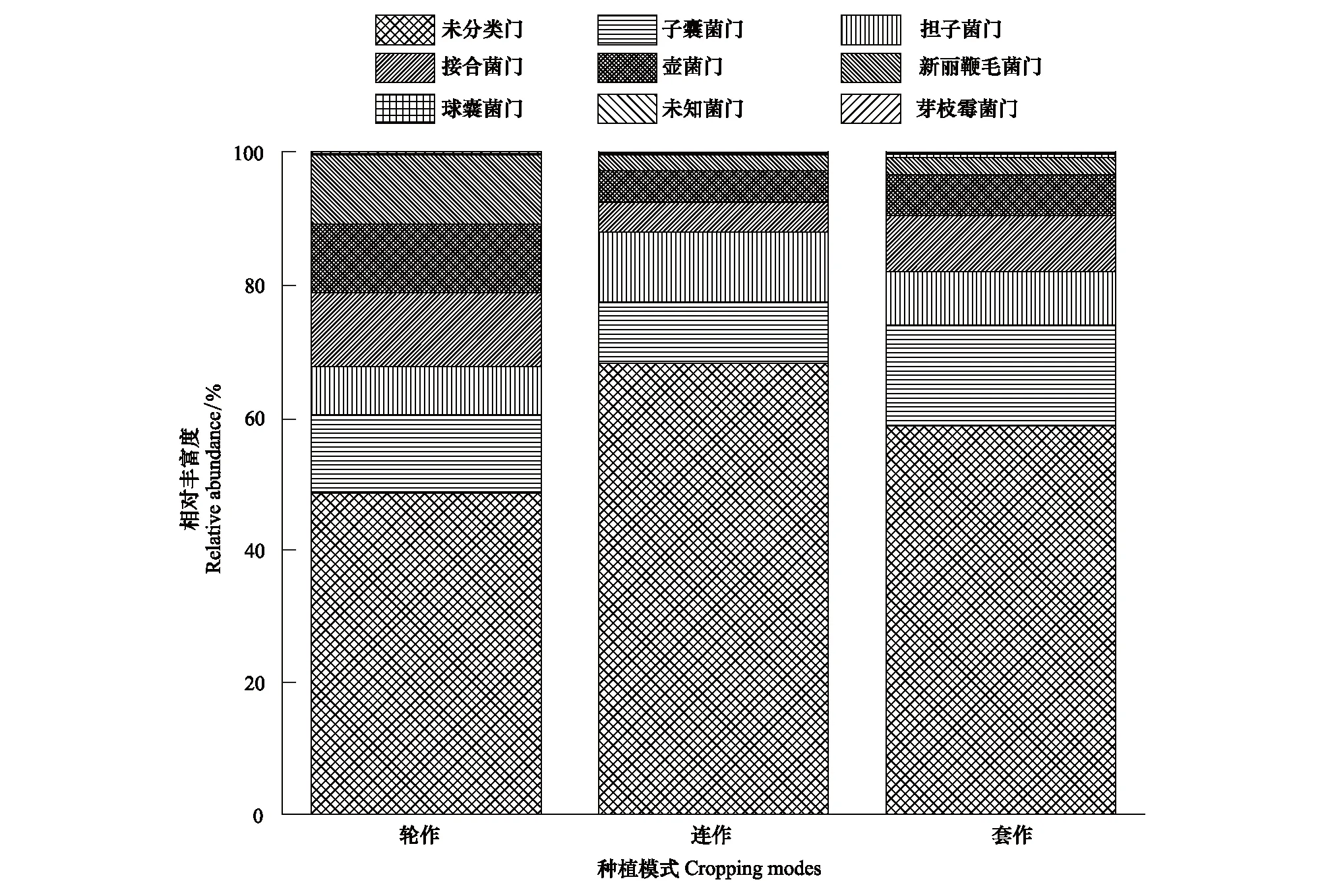
图3 3种种植模式下主要真菌类群相对丰富度Fig.3 Relative abundance of the major fungi phylogenetic groups under three cropping modes
2.4.3真菌群落PCoA分析
与细菌群落类似,3种种植模式中真菌群落的3个重复也较分散,种植模式之间没有明显分化。PCoA分析结果表明,真菌群落组成的变异受8个主坐标成分的控制,主坐标成分的特征值均大于0.890,其中前两个主坐标成分影响最大,分别能够解释14.12%和13.63%的变异,累积解释能力达27.75%(图4)。但是,所有主坐标成分的特征值相差不大,说明本研究中影响土壤真菌群落结构的主导因子并不明显。

图4 3种种植模式下真菌群落PCoA聚类分析 Fig.4 Principal coordinates analysis (PCoA) of fungi communities under three cropping modes
2.5 土壤微生物群落网络分析和相互作用关系
网络分析表明,优势细菌门在3种种植模式之间变化不大,只有芽单胞菌门在轮作模式下的丰富度显著低于连作和套作(P<0.05);而非优势细菌门的变化较大,尤其是热脱硫杆菌门(Thermodesulfobacteria),但其变化趋势与芽单胞菌门刚好相反(P<0.01)。连作模式下Ignavibacteriae门和Deinococcus-Thermus门之间存在显著的负相互作用(P<0.05),而套作和轮作模式下只有正相互作用,如变形菌门、酸杆菌门和硝化螺旋菌门(Nitrospirae)(套作,P<0.05),衣原体门(Chlamydiae)和蓝藻门(Cyanobacteria/Chloroplast)(轮作,P<0.01)。但是,未发现细菌门之间的相互作用关系在不同种植模式下发生明显转变的情况。
套作模式下球囊菌门和子囊菌门的优势度较高,而轮作模式下新丽鞭毛菌门、壶菌门和接合菌门占优势,但连作模式下未发现优势真菌门。虽然真菌门数量很少,它们之间的相互作用却更加复杂。连作模式下球囊菌门与子囊菌门、未知菌门均有负相互作用,但在轮作模式下球囊菌门与子囊菌门之间转变为正相互作用(P<0.01);套作模式下未知菌门与接合菌门、新丽鞭毛菌门有负相互作用,但在轮作模式下均转变为正相互作用(P<0.01)。
2.6 土壤细菌群落与环境因子之间的关系
蒙特卡罗置换检验结果显示,第一典范轴P值为0.087(F=0.487),所有典范轴的P值为0.027(F=1.458),表明该排序模型的解释变量(即土壤环境因子)可以很好地解释响应变量(即土壤细菌群落结构)的变化,但第一典范轴的影响不显著。丹参根际土壤细菌群落与根际土壤环境因子的冗余分析结果见表5,其中RDA前两个排序轴的特征值分别为0.328和0.133,分别解释了32.8%和13.3%的细菌群落变化。本文所选的8个土壤环境因子共解释了86.2%的总特征值,说明对丹参根际土壤细菌群落有显著影响。
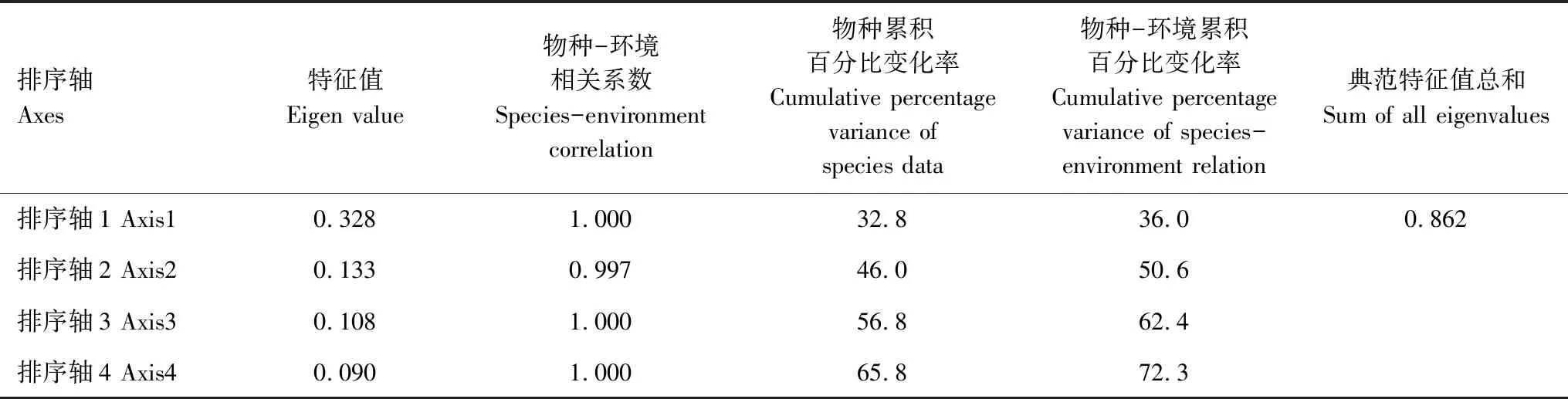
表5 土壤细菌群落冗余分析

图5 3种种植模式下细菌群落和土壤理化因子间的RDA双序图Fig.5 The RDA biplots generated from bacterial communities under three cropping modes and soil physicochemical properties图中黑线和实心箭头表示显著性因子, 黑线和空心箭头表示非显著性因子;OM: 有机质, Organic matter; TP: 总磷, Total phosphorus; AP: 有效磷, Available phosphorus; TN: 总氮, Total nitrogen; TK: 总钾, Total potassium; AK: 有效钾, Available potassium; ORP: 氧化还原电位, Oxidation reduction potential
为了研究影响丹参根际细菌群落结构的主导因素,对8个土壤理化因子进行预筛选。结果表明,只有土壤总钾(TK,P=0.034,F=2.24)对细菌群落的构建有显著性影响(P<0.05)。RDA双序图(图5)显示,TK对套作模式下丹参根际细菌群落有正向影响,相反对连作模式下的细菌群落不利。
2.7 土壤真菌群落与环境因子之间的关系
蒙特卡罗置换检验结果显示,第一典范轴P值为0.332(F=0.961),所有典范轴的P值为0.604(F=0.979),表明该排序模型的解释变量(即土壤环境因子)与响应变量(即土壤真菌群落结构)的变化关系不大。丹参根际土壤真菌群落与土壤环境因子的冗余分析结果见表6,其中RDA前两个排序轴的特征值分别为0.490和0.239,分别解释了49.0%和23.9%的真菌物种变化。本文所选的8个土壤环境因子共解释了87.3%的总特征值,对丹参根际土壤真菌群落有显著影响。
偏冗余分析的结果表明,8个土壤因子中只有有效钾(AK)和ORP对真菌群落的构建有显著性影响(表7,P<0.05),分别可以解释19.7%和4.40%的真菌群落变化。从双序图中可以看出,影响真菌群落结构的关键土壤因子在不同种植模式下有明显差异,套作丹参根际真菌群落主要受AK影响,而轮作和连作主要受ORP影响(图6)。

表7 土壤环境因子偏冗余分析(pRDAs)

图6 3种种植模式下真菌群落和土壤理化因子间的RDA双序图Fig.6 The RDA biplots generated from fungi communities under three cropping modes and soil physicochemical properties
3 讨论
根际土壤微生物对植物的生长繁殖、营养物质的吸收运输和残体分解等方面具有重要影响,它们与植物之间存在着十分紧密的相互作用,也是环境土壤学研究的热点问题之一。植物在连作后其根系分泌物、残根和凋落物的质与量会发生显著变化,从而对根际土壤微生物产生明显的影响[23-24]。
3.1 不同种植模式下丹参根际微生物群落的变化
本研究利用高通量测序法对丹参根际土壤中的微生物群落进行了测序和分析。从种植时间上来看,细菌的丰富度、香农-威纳指数、ACE指数、Chao1指数和Simpson指数随丹参种植年限增加而降低,其中香农-威纳指数显著降低。但是,真菌的Alpha多样性指数均无显著变化,变化规律与细菌相似。真菌Simpson指数虽然随种植年限增加呈上升趋势,但变异主要来自组内。从种植模式而言,套作在一定程度上能够提高土壤微生物群落多样性,因为大多数Alpha多样性指标都高于连作。由于亳州地区丹参连作障碍非常严重,因此很少连作两年以上,这可能是多数微生物群落多样性指标没有发生显著变化的原因之一。相比而言,新疆的棉花连作时间可长达30年,根际细菌群落多样性的变化要明显的多[23]。除连作时间的影响以外,土壤性质和丹参品种也可能导致土壤微生物群落多样性的变化有所差异。Tang等发现,四川中江县的丹参连作1—3年,其根际真菌群落的丰富度和香农-威纳指数与未耕作地相比均显著降低[8]。
从根际微生物聚类分析的结果来看,无论细菌还是真菌群落在3种种植模式之间均没有发生显著分化。但是,出现这种现象可能与各种种植模式组内差异较大有关,微生物群落组成的细微差别,以及由此造成的根际微生物与丹参相互作用关系的变化仍然值得关注。由于微生物,尤其是细菌的种类较多,本研究从门这一较高的分类单元进行了统计和分析。芽单胞菌门在轮作模式下的相对丰富度显著低于连作和套作,表明该门的细菌对连作环境的耐受性较强,有可能成为连作模式下的优势菌。与此相反,轮作和套作时浮霉菌门和拟杆菌门的相对丰富度则高于连作,说明这两个门的细菌对连作环境较为敏感,保持根际微环境的多样性对它们有利。真菌的数量远小于细菌,套作模式下占优势的子囊菌门的相对丰富度显著高于连作。与此类似,轮作模式下接合菌门和壶菌门的相对丰富度也显著高于连作模式。
AMF是一种普遍存在的专性内共生真菌,可以通过侵染植物根系和植物形成共生体系。AMF需要依靠宿主获得C源,同时能够增强植物获取P等矿质营养的能力,从而实现互利共生。被AMF真菌侵染可以提高植物的抗逆性、抗病虫害等能力,促进植物的生长,提高作物的质量和产量[25]。研究发现,AMF不仅可以改善连作丹参的生长,而且能够增加丹酚酸B、丹参酮的产量和对铁、锰等微量元素的积累[13, 26]。本研究表明,随着种植年限的增加,无论是连作还是套作,AMF真菌对丹参根部的侵染率均显著下降。另外,与套作相比,连作丹参的AMF真菌侵染率降低,但未达到显著水平。
3.2 丹参根际微生物群落变化的原因及与连作障碍的关系
大量研究结果表明,陆地生态系统中地上的植物多样性,以及土地利用方式或耕作方式的变化是驱动地下微生物群落多样性、代谢类型多样性变化的重要因素[18, 23, 27-28]。丹参连作会导致土壤酸化,团聚体结构破坏,土壤营养失衡等现象[6]。本研究结果表明,轮作和套作不仅提高了土壤pH,降低了ORP,改善了部分土壤矿质营养,而且能够在一定程度上影响丹参根际的微生物群落组成,从而可能对缓解连作障碍起到积极作用。微生物群落结构受8个主坐标成分的影响,但前两个主坐标成分的综合解释能力均小于30%,表明没有显著的主导因子。本研究将8个土壤环境因子通过冗余分析投影成4个典范轴。结果表明,土壤性质的变化对细菌群落的影响较大,但对真菌群落的影响不明显。因此,真菌群落变化的主导因素并非土壤理化性质。研究表明,植物根际分泌物可以直接或间接影响微生物群落[8, 23- 24],但由于丹参根际分泌物组成复杂本研究未将此因子纳入冗余分析。总钾和有效钾可以提高套作模式下细菌和真菌群落的多样性,说明丹参和白芍套作形成的根际微环境更适合喜钾微生物的生长。而轮作和连作模式下的真菌群落与此刚好相反,它们更适应低钾和高ORP的环境。
研究表明,在低P环境下AMF对宿主的侵染率较高[29- 30]。但本研究发现,连作条件下丹参根际土壤的总磷和有效磷均低于轮作。因此,土壤营养条件的变化可能不是导致AMF侵染率下降的主要原因。由于丹参是根类药材,根际分泌物将随着种植时间的增加在土壤中发生积累,并引起土壤微生物群落结构的显著变化[8, 23- 24],这可能是导致AMF侵染率下降的潜在原因之一,但具体机制还要进一步的研究来证实。AMF侵染率的下降可能会造成连作丹参的品质和产量降低[13, 26],抗病能力下降,进一步加剧连作障碍。镰刀菌属(Fusariumgenus)是丹参枯萎病和根腐病的主要病原菌。虽然该属在真菌中的相对丰富度很低(0.01%),但间作和套作两种模式下均未发现该菌,仅在连作模式下有检出。另外,有研究发现枯草杆菌属(Bacillusgenus)和AMF可以有效控制枯萎病的发生[31-32],属有益菌。但本研究发现,连作模式下枯草杆菌属的相对丰富度(0.18%)低于套作(0.22%)和轮作(0.26%),AMF的侵染率也同样显著下降。微生物组成和功能群的变化会影响根际有机质的代谢和循环,改变根际微环境,以及微生物与植物之间的关系,这也可能是导致连作障碍的重要原因之一[33]。此外,本研究表明,不同的丹参种植模式下微生物之间的相互关系有明显差异。细菌在轮作和套作模式下均表现为正相互作用,但在连作模式下存在负相互作用,而轮作甚至还会造成真菌之间的相互关系发生逆转。这种现象与丹参连作障碍是否有关值得进一步深入研究
本研究的结果仅基于一次性取样,只能表征一个时间断面上的变化。未来应开展不同种植模式下丹参根际微生态环境的动态监测,这对于揭示连作障碍发生机理和探索应对策略具有重要意义。
