肝脏特异性Pten基因敲除小鼠模型的制备及鉴定
2019-08-18刘宏扬张昆丽翁长江杨玉莹
刘宏扬 黄 丽 张昆丽 翁长江* 杨玉莹
(1.长江大学 动物科学学院,湖北荆州 434025;2.中国农业科学院哈尔滨兽医研究所 基础免疫创新团队/兽医生物技术国家重点实验室,黑龙江哈尔滨 150069)
Pten,又称为MMACI基因或者TEP1[1],是一个重要的抑癌基因,该基因具有脂质磷酸酶活性和蛋白磷酸酶活性。Pten基因定位于染色体10q23,基因编码403个氨基酸,由N端180个氨基酸的催化区、中部165个氨基酸的C2区和C端50个氨基酸的尾区组成[2-5]。Pten基因在体内几乎所有组织器官中广泛表达,参与了机体内的多种生理功能。Pten与多种蛋白结合对PIP3、MAPK及FAK等通路有调控作用。Pten通过调控PIP3的去磷酸化影响细胞增殖与凋亡[6];通过调控黏着斑激酶(FAK)的磷酸化作用抑制肿瘤的转移和侵袭[7]。有研究表明,Pten通过抑制促细胞分裂素激活的蛋白激酶(MAPK)信号转导抑制细胞的生长和分化[8,9]。
Pten基因异常表达与人类多种疾病的发生密切相关[10]。Pten失活导致细胞增殖和凋亡失衡,使肿瘤细胞失控性的生长、增殖、浸润和转移[11]。Yu等研究发现肝癌组织中Pten的表达显著低于非肿瘤组织[12]。最近研究表明,肝癌组织中Pten基因的缺失或失活与肝癌的发生、发展和转移等功能密切相关[4,13]。
本课题利用Cre/Loxp条件基因敲除技术构建肝脏内特异性敲除Pten基因的小鼠模型,为在体内研究Pten基因在肝脏相关疾病中所起的作用提供研究模型。
1 材料与方法
1.1 材料
1.1.1 实验动物
C57BL/6J品系的Ptenflox/flox小鼠来自于军事医学科学院生物工程研究所杨晓教授,肝脏特异表达Cre重组酶的工具鼠购买自南京大学模式动物研究所。所有的动物饲养繁殖在中国农业科学院哈尔滨兽医研究所实验动物中心(SPF级)进行。所有小鼠均饲养于12h/12 h 光照/黑暗条件下,自由采食和饮水,所有操作均符合实验动物伦理学要求。

图1 肝脏特异性Pten基因敲除小鼠模型的打靶策略(1A)与流程图(1B)
1.1.2 主要试剂
NaCl、EDTA、Tris base、SDS、琼脂糖粉等化学试剂购自sigma公司;Proteinase K购自Thermo Fisher公司;2 × Ex Taq PCR Mix酶、DNA maker DL2000 购自宝生物工程(大连)有限公司;SYBR Premix EX Taq II、PrimeScriptTMRT reagent kit逆转录试剂盒购自Takara公司;GAPDH单克隆抗体,Pten多克隆抗体购自武汉三鹰公司;Anti-Mouse IgG(H+L)DyLight™ 800-Labeled(042-07-18-06)购自美国KPL公司。
1.1.3 主要仪器设备
低温高速离心机购于Beckman公司;小型台式离心机购于Eppendorf公司;细胞培养箱购于Thermo公司;恒温水浴锅购于Thermo公司;荧光定量PCR仪Aligent Mx3005P购自美国Aligent公司;红外扫膜仪购自美国Licor公司。
1.2 方法
1.2.1 肝脏特异性Pten基因敲除小鼠模型构建策略
Ptenflox/flox小鼠打靶策略如图1A所示,在Pten基因的4号和5号外显子两端插入Loxp位点。基于Cre/Loxp系统原理,Ptenflox/flox小鼠与肝脏特异性表达Cre重组酶小鼠(Alb-Cre)交配,Cre重组酶特异性识别Loxp位点,通过同源重组实现靶基因在肝脏内特异性敲除。具体流程为:首先将Ptenflox/flox小鼠与Alb-Cre小鼠进行交配,筛选出F1代,基因型为Ptenflox/+/Alb-Cre小鼠。F1与Ptenflox/flox小鼠交配,筛选出F2代基因型为Ptenflox/flox/Alb-Cre小鼠。F2代小鼠与Ptenflox/flox小鼠交配,获得F3代基因型为Ptenflox/flox/Alb-Cre小鼠(肝脏特异性基因敲除小鼠)和Ptenflox/flox小鼠(实验对照组小鼠)(图1B)。
1.2.2 肝脏特异性Pten基因敲除小鼠的基因型鉴定
对5周龄左右的小鼠进行耳标标记,对应耳标号剪下约2 mm左右的鼠尾,置于1.5 ml EP管内,加入500 µl组织裂解液(1 M Tris-HCL pH 8.0,0.5 M EDTA pH 8.0,3 M NaCl,10% SDS)和1µl蛋白酶K(10 mg/mL)。56 ℃水浴消化过夜。第二天将样品室温放置10 min,12000 rpm/min离心15 min,取上清400 µl加入等量异丙醇上下反复颠倒混匀,待析出白色絮状沉淀后,12000 rpm/min离心,弃上清,75%酒精洗一遍后,加双蒸水溶解。依据打靶策略设计的基因型鉴定引物(表1)进行PCR扩增。PCR扩增反应体系(20 µl):Ex Taq Mix 10µl,引物各1 µl,模板1 µl,ddH2O 7 µl。Cre基因PCR扩增条件:98℃ 2 min,98℃ 30 s,58℃30 s,72℃ 30 s,(35 Cycle),72℃ 5 min。Flox基因扩增条件:98 ℃ 2 min,98℃ 30 s,60℃ 30 s,72℃ 30 s,(35 Cycle),72℃ 5 min。取PCR反应终产物10 µL进行1.2% 琼脂糖凝胶核酸电泳鉴定肝脏特异性Pten基因敲除小鼠基因型。
1.2.3 RNA提取及Real-Time PCR检测

图2 Pten基因敲除小鼠基因型鉴定

图3 小鼠肝脏、肺脏以及肾脏组织中Pten基因 mRNA水平检测
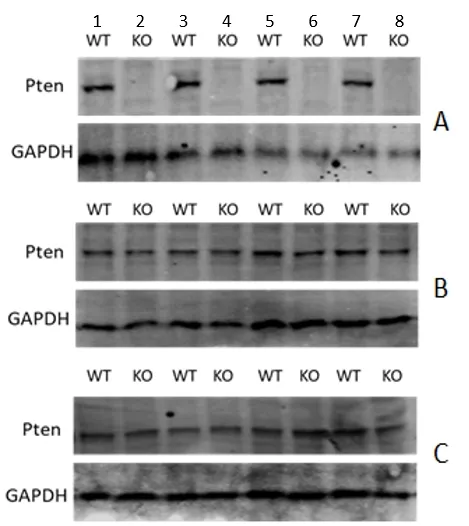
图4 小鼠肝脏、肺脏以及肾脏组织中Pten蛋白表达水平鉴定
选取6周龄小鼠,依据Trizol法提取RNA的步骤进行小鼠肝脏、肺脏以及肾脏总RNA的提取,将浓度稀释成50 ng/µl的RNA进行反转录反应,制备成20µl体系的DNA样本,作为 荧光定量PCR反应模板,用于检测肝脏组织中Pten基因的mRNA的转录水平,鉴定敲除效率。Real-Time PCR 使用的Pten基因上游引物为:5'-CAGCCAAGTCTGTGACTTGCCGTAC-3',下游引物为:5'-CCGCTCGAGCAGTCGCTGCAACCATCCA-3'。内参GAPDH上游引物为:5- AAATGGTGAAGGTCGGTGTGAAC-3,下游引物为:5- CAACAATCTCCACTTTGCCACTG -3。反应体系(20 µl):2× SYBR Premix EX Taq Ⅱ 10 µl,PCR Forward Primer(10 µm)1 µl,PCR Reverse Primer(10 µM)1 µl,DNA 模板2 µl,灭菌蒸馏水6 µl。反应条件:Step1,95 ℃ 30 s;Step2,95℃ 5 s;60℃ 30 s,72 ℃ 30 s,(35 Cycle);Step3:Melt Curve。
1.2.4 小鼠组织总蛋白提取及Western Blot检测
选取经过PCR验证后的6周龄Ptenflox/flox/Alb-Cre小鼠与Ptenflox/flox小鼠,取其不同组织。使用强RIPA组织裂解液提取小鼠肝脏、肺、肾脏组织总蛋白。取大约100mg组织于研钵中,边加液氮边研磨至粉末状,转移至1.5ml EP管中加入1 ml RIPA裂解液,冰上裂解30min,12000 rpm/min 4℃ 离心20min,吸取裂解上清,使用BCA法测定蛋白浓度。加入5 × SDS-PAGE Loading Buffer,100℃煮沸10 min,样品经SDS-PAGE凝胶电泳分离后,湿转至NC膜上;5 %脱脂乳室温封闭,分别以抗Pten或抗GAPDH mAb(1:1 000)为一抗,以羊抗鼠Goat anti-rabbit IgG(H+L)(1∶2 0000)作为二抗,通过红外扫膜仪进行扫描。
2 结果
2.1 Ptenflox/ flox/Alb-Cre小鼠基因型鉴定
提取Ptenflox/flox/Alb-Cre小鼠与Ptenflox/flox小鼠交配产生的7只子代小鼠的基因组DNA,分别使用 Flox基因和Cre基因特异性引物对小鼠的基因型进行PCR鉴定。结果如图2所示,从第2、3、5、6、7只小鼠的基因组DNA中扩增出512bp 的 Cre 基因 片段(图2A),7只小鼠的基因组DNA中均扩增出300 bp 的 flox基因 片段(图2B)。由此判定,第2、3、5、6、7只小鼠为Ptenflox/flox/Alb-Cre小鼠,而第1和第4只小鼠为Ptenflox/flox小鼠。

表1 基因型鉴定的引物信息2
2.2 mRNA水平检测
分别提取Ptenflox/flox/Alb-Cre和Ptenflox/flox基因敲除小鼠的肝脏、肺脏、肾脏总RNA,用Real-time PCR方法检测这三个组织中Pten的mRNA水平。结果如图3所示,与Ptenflox/flox小鼠相比,Ptenflox/flox/Alb-Cre小鼠肝组织中Pten mRNA水平显著降低(P<0.0001);而肺脏和肾脏组织中Pten的mRNA水平没有明显变化。
2.3 蛋白水平鉴定
分别提取Ptenflox/flox/Alb-Cre和Ptenflox/flox的肝脏、肺脏、肾脏组织总蛋白,用Western Blot方法检测Pten的蛋白水平。结果如图4所示,与Ptenflox/flox小鼠相比,Ptenflox/flox/Alb-Cre小鼠肝脏中Pten蛋白的表达量显著降低,而 Ptenflox/flox/Alb-Cre小鼠与Ptenflox/flox小鼠的肺及肾脏中Pten蛋白表达量无差异,由此说明 Pten基因仅在肝脏组织中被敲除。
3 讨论
最近几年来,基因敲除技术迅速发展,基因敲除模型被广泛应用于生物学领域[14]。但是基因敲除小鼠的某些基因缺失可能造成生长发育或生殖功能障碍,不易获得纯合型后代[15]。因此构建条件基因敲除小鼠模型,使某段基因在动物体内的特定组织器官内失活,是研究该基因在特定组织器官内功能最为有效的方法。条件性基因敲除是通过把两个LoxP位点插入到目的基因的一个或几个重要外显子的两端以制备出有两个LoxP位点Knockout-floxed小鼠[16],Knockout-floxed小鼠与组织特异性表达Cre酶的小鼠进行杂交后,可以在特定的组织或细胞中敲除该基因,而该基因在其它组织或细胞表达正常[17]。
利用Cre-Loxp基因敲除系统,在Pten基因的4号和5号外显子外侧插入了Loxp位点,得到Ptenflox/flox小鼠并与特异性表达Cre酶的工具鼠交配,经过多代次的繁育,成功获得Pten基因敲除小鼠Ptenflox/flox/Alb-Cre。
通过对肝脏特异性Pten基因条件敲除小鼠的生长繁殖情况的观察,我们发现Pten基因条件敲除小鼠的生长情况与对照组相比并无显著差异,小鼠繁殖能力良好,子代生长发育情况正常。采用Genotyping的方法对5周左右的小鼠进行基因型鉴定,成功筛选出Ptenflox/flox/Alb-Cre和Ptenflox/flox小鼠。与Ptenflox/flox小鼠相比。Ptenflox/flox/Alb-Cre 小鼠肝脏组织中Pten的mRNA水平及蛋白质水平均有显著降低,表明我们成功得到Pten 肝脏特异性条件基因敲除小鼠,为探究Pten基因在肝脏疾病中的的作用提供了重要动物模型。
