序贯和同步曲妥珠单抗联合蒽环类方案对人表皮生长因子受体-2阳性乳腺癌患者新辅助化疗效果及安全性的影响
2019-08-17刘志
刘志
(河南省许昌市中心医院 肿瘤科,河南 许昌 461000)
序贯和同步曲妥珠单抗联合蒽环类方案对人表皮生长因子受体-2 曲妥珠单抗联合蒽环类抗肿瘤药物新辅助化疗目前已成为HER-2 阳性乳腺癌患者综合治疗重要组成部分,且该方案在提高手术根治切除效果和提高远期生存率方面优势明显;但曲妥珠单抗与蒽环类同步应用可能增加相关不良反应特别是心脏毒性水平,导致患者耐受性下降[1],但序贯方案应用能否在提高安全性同时保证更佳新辅助化疗受益仍存在较大争议。本文旨在探讨序贯和同步曲妥珠单抗和蒽环类方案对人表皮生长因子受体-2 (human epidermal growth factor receptor 2,HER-2)阳性乳腺癌患者新辅助化疗疗效及安全性的影响,现报道如下。
1 资料与方法
1.1 临床资料
选取本院2013年 3月至 2016年 3月收治的HER-2 阳性乳腺癌患者共110 例,纳入标准:①符合《中国抗癌协会乳腺癌诊治指南与规范:2011版》乳腺癌诊断及分期标准[2];②经免疫组化(immunohistochemistry,IHC) 和 荧 光 原 位 杂 交(fluorescencein situhybridization,FISH)证实HER-2 过表达;③具有可测量病灶;④年龄18~75 岁;⑤方案经院伦理委员会批准(XJ201202),且患者及家属签署知情同意书。排除标准:①既往接受过曲妥珠单抗及放化疗方案治疗;②存在远处转移;③左心室射血分数(left ventricular ejection fraction,LVEF)<50%;④合并其他系统恶性肿瘤。入选患者以随机数字表法分为序贯组和同期组,每组各55 例;序贯组患者年龄33~69 岁,平均(55.63±7.06)岁;基线卡氏功能状态(Karnofsky performance status,KPS)评分 73~92 分,平均基线KPS 评分为(87.33±5.80)分,根据TNM 临床分期划分,II 期17 例,III 期38 例;同期组患者年龄 34~67 岁,平均(54.98±6.90)岁;基线KPS评 分 75~90 分 , 平 均 基 线 KPS 评 分 为(87.09±5.74)分,根据TNM 临床分期划分,II 期19 例,III 期36 例。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
序贯组患者术前给予曲妥珠单抗+蒽环类序贯联合新辅助化疗,包括:①注射用曲妥珠单抗首剂量4 mg/kg,继而每3 周给予2 mg/kg;②盐酸表柔比星注射液75 mg/m2,一日1 次,每3 周为一疗程;③注射用盐酸吡柔比星55 mg/m2,一日1 次,每3 周为一疗程;④多西他赛注射液75 mg/ m2,一日1 次,每3 周为一疗程;连用4 周期后停用蒽环类药物,继续给予多西他赛(75 mg/m2)+曲妥珠单抗(2 mg/kg),以每3 周为一疗程,再行2~4 疗程;同期组患者给予曲妥珠单抗+蒽环类同步联合新辅助化疗,即表柔比星(60 mg/m2)+多西他赛(60 mg/m2),均以3 周为一疗程;曲妥珠单抗首剂量为4 mg/kg,后8 周给予2 mg/kg,药物生产厂家、国药准字及规格同序贯组。两组患者在新辅助化疗后均行乳腺改良根治术或保乳手术治疗。
1.3 观察指标
①临床疗效评价指标包括临床完全缓解率、临床客观缓解率及病理完全缓解率[2];其中完全缓解是指目标病灶消失;客观缓解是指目标病灶长径减少30%以上或消失;②血管内皮生长因子和乳腺组织凋亡分子检测采用酶联免疫吸附法;③采用德国Siemens 公司生产Acuson S2000 型超声诊断仪对LVEF 水平进行检测。
1.4 统计学方法
采用SPSS 24.0 软件进行数据分析。计量资料以均数±标准差(±s)表示,计量资料组间比较采用t检验;计数资料以百分比(%)表示,计数资料组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较
序贯组患者临床完全缓解率、临床客观缓解率及病理完全缓解率分别为 72.73% (40/55),83.64%(46/55),41.82%(23/55);同期组患者临床完全缓解率、临床客观缓解率及病理完全缓解率分别为89.09% (49/55), 94.55% (52/55),54.55%(30/55);同期组患者临床完全缓解率、临床客观缓解率及病理完全缓解率均显著高于序贯组(均P<0.05)。
2.2 两组患者治疗前后血管内皮生长因子水平比较
同期组患者治疗后血管内皮生长因子(vascular endothelial growth factor,VEGF) A、VEGFB 及VEGFC 水平均显著低于序贯组、治疗前(均P<0.05)。见表1。
2.3 两组患者治疗前后乳腺组织凋亡分子水平比较
同期组患者治疗后胱天蛋白酶3(Caspase-3)、捕获受体 3 (decoy receptor-3,DcR3)、存活素(Survivin)水平均显著低于序贯组、治疗前(均P<0.05)。见表2。
表1 两组治疗前后血管内皮生长因子水平比较 (±s,pg/ml)
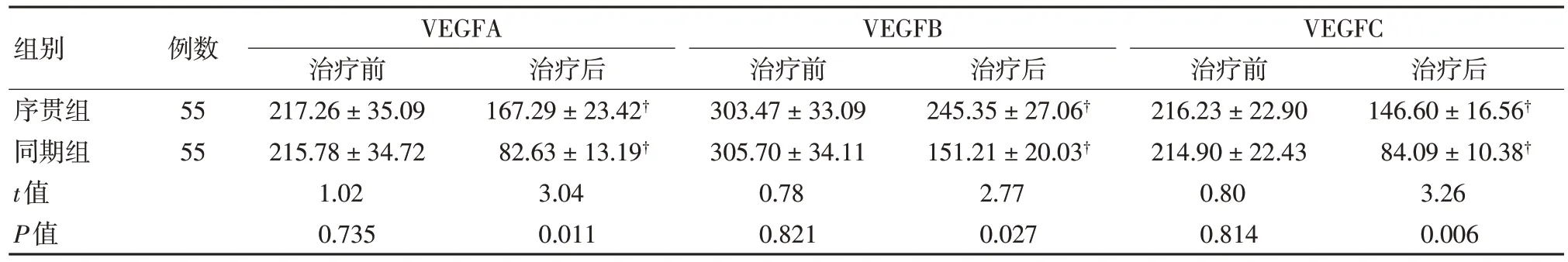
表1 两组治疗前后血管内皮生长因子水平比较 (±s,pg/ml)
注:†与治疗前比较,P<0.05。
组别序贯组同期组t值P值治疗后146.60±16.56†84.09±10.38†3.26 0.006例数55 55 VEGFA治疗前217.26±35.09 215.78±34.72 1.02 0.735治疗后167.29±23.42†82.63±13.19†3.04 0.011 VEGFB治疗前303.47±33.09 305.70±34.11 0.78 0.821治疗后245.35±27.06†151.21±20.03†2.77 0.027 VEGFC治疗前216.23±22.90 214.90±22.43 0.80 0.814
表2 两组治疗前后乳腺组织凋亡分子水平比较 (±s,pg/ml)
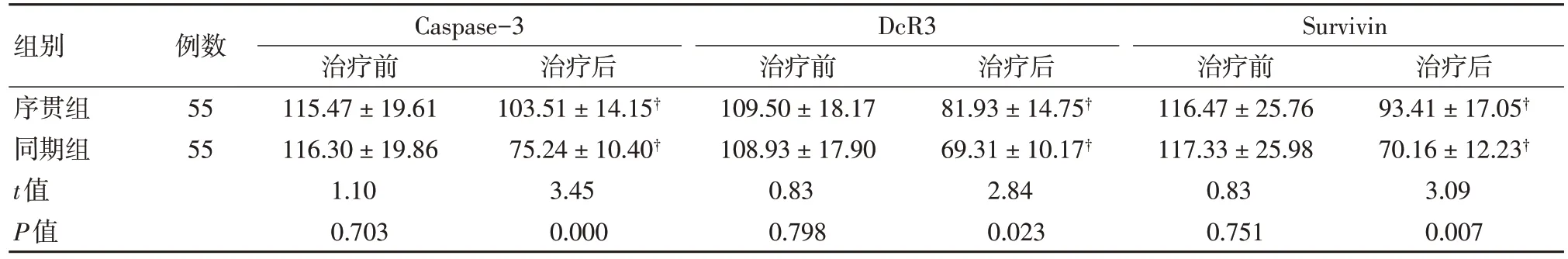
表2 两组治疗前后乳腺组织凋亡分子水平比较 (±s,pg/ml)
注:†与治疗前比较,P<0.05。
组别序贯组同期组t值P值治疗后93.41±17.05†70.16±12.23†3.09 0.007例数55 55 Caspase-3治疗前115.47±19.61 116.30±19.86 1.10 0.703治疗后103.51±14.15†75.24±10.40†3.45 0.000 DcR3治疗前109.50±18.17 108.93±17.90 0.83 0.798治疗后81.93±14.75†69.31±10.17†2.84 0.023 Survivin治疗前116.47±25.76 117.33±25.98 0.83 0.751
2.4 两组患者治疗前后LVEF水平比较
序贯组患者治疗前后LVEF 水平分别为(64.82±4.87)%,(65.36±5.42)%;同期组患者治疗前后 LVEF 水平分别为(65.30±4.94)%,(64.79±5.36)%;两组患者治疗前后LVEF 水平组间比较差异无统计学意义(P>0.05)。
3 讨论
曲妥珠单抗与蒽环类化疗药物联用治疗HER-2阳性乳腺癌可进一步提高无病生存期,延长生存时间,效果优于单用曲妥珠单抗;但两者同步应用可能诱发严重心脏毒性(III、IV 级),使部分患者无法耐受[2];在此情况下采用何种方式完成曲妥珠单抗和与蒽环类联合用药已成为医学界关注的热点和难点。
本次研究结果中,同期组患者完全缓解率和客观缓解率均显著高于序贯组(P<0.05),提示曲妥珠单抗与蒽环类药物同步新辅助化疗方案用于HER-2 阳性乳腺癌患者有助于促进肿瘤消退,控制病情进展,效果较序贯方案具有优势,与以往报道基本一致[3];同时同期组患者治疗后VEGFA、VEGFB 及VEGFC 水平均显著低于序贯组、治疗前(P<0.05);同期组患者治疗后Caspase-3、DcR3 及Survivin 水平均显著低于序贯组、治疗前(P<0.05),证实曲妥珠单抗与蒽环类药物同步新辅助化疗在降低HER-2 阳性乳腺癌患者血管新生因子和乳腺组织凋亡分子水平方面优势明显,笔者认为这可能是该方案具有更佳临床疗效关键机制所在。VEGF 属于目前已知促血管新生能力最强的细胞因子,可通过与相应受体结合激活信号通路,加快血管内皮细胞迁移增殖进程,从而导致新生血管形成[4];其水平可在一定程度上反映恶性肿瘤增殖速率;部分临床研究证实,恶性肿瘤患者血清VEGF 水平异常上升可作为临床治疗失败或复发转移重要危险因素之一[5]。大量基础及临床研究证实,乳腺组织凋亡分子表达异常是导致肿瘤病情进展重要始动因素之一;其中Caspase-3 是调节细胞凋亡蛋白酶级联反应核心细胞因子之一,异常高表达状态能够加快肿瘤细胞增殖进程[6]。DcR3 是一类肿瘤坏死因子受体,其表达增加能够与对应受体结合拮抗细胞凋亡;而Survivin 主要作用机制为抑制死亡受体活性,降低细胞凋亡速率;超过90%乳腺癌患者体内存在Survivin 过度表达现象[7]。
以往对于曲妥珠单抗和蒽环类化疗患者心脏功能多单纯采用LVEF 进行评估,但在短时间内往往难以观察到显著改变;本次研究结果中,两组患者治疗前后LVEF 水平比较差异无统计学意义(P>0.05),表明依赖LVEF 难以敏感准确评估曲妥珠单抗和蒽环类化疗药物对于心脏功能影响。笔者在研究中加入心肌肌钙蛋白I (cardiac troponin I,cTnI) 和 N-末端脑钠肽前体 (N-terminal pro-brain natriuretic peptide,NT-proBNP)两指标辅助进行心脏功能损伤水平评价,两组患者治疗后cTnI 和NT-proBNP 水平均显著高于治疗前(P<0.05);但两组患者治疗后 cTnI 和 NT-proBNP水平组间比较差异无统计学意义(P>0.05),提示同步和序贯化疗方案均可导致HER-2 阳性乳腺癌心脏毒性,但同步新辅助化疗心脏毒性程度并未见明显加重。流行病学报道显示[8],曲妥珠单抗心脏毒性出现比率约为2%~10%,而与蒽环类药物联用后这一比率可上升4%~6%;患者以胸闷、心慌及呼吸困难为主要症状,严重者出现LVEF严重下降甚至充血性心力衰竭;本研究患者中仅5 例出现短暂性LVEF 下降,其中序贯组2 例,同期组3 例,但均未因此中断化疗;而国外学者报道显示[9],通过对心脏功能进行严密监测可有效控制以曲妥珠单抗为基础药物方案应用后心脏毒性。同时两组患者红细胞减少、血小板减少、白细胞减少、恶心呕吐、肝功能损伤及肾功能损伤发生率比较差异均无统计学意义(P>0.05),表明两种新辅助化疗方案应用安全性接近,均为导致严重不良反应,与既往研究结论相符[10]。
综上所述,曲妥珠单抗+蒽环类同步联合新辅助化疗方案治疗HER-2 阳性乳腺癌可有效控制病情进展,下调血清血管新生因子和乳腺组织凋亡分子,且未加重心脏毒性。
