衰老性骨质疏松微环境对颌骨骨髓间充质干细胞生物学功能的影响*
2019-08-15李胜丹梁乙然刘一涵
李胜丹 梁乙然 刘一涵
骨质疏松症(OP,Osteoporosis)是一类以骨密度降低、骨脆性增加、骨微结构破坏、骨折风险增加为特征的全身性骨骼疾病[1]。骨质疏松症分为原发性骨质疏松和继发性骨质疏松两型。原发性骨质疏松包括绝经后骨质疏松和衰老性骨质疏松。随着我国人口老龄化的增加,老年性骨质疏松问题愈加严重,不仅表现在四肢躯干骨方面,颌骨质量也直接受影响,给临床口腔种植手术带来困难。正常生理状态下,成骨细胞(Osteoblast,OB)介导的骨形成与破骨细胞(Osteoclast,OC)介导的骨吸收保持平衡,以维持骨稳态。发生骨质疏松时,此平衡被打破,骨吸收大于骨形成,造成骨丢失[2]。而间充质干细胞是组织再生的基础,在衰老性骨质疏松条件下,以往研究大多集中在四肢躯干骨来源的骨髓间充质干细胞,本文则着重研究衰老性骨质疏松微环境对颌骨骨髓间充质干细胞生物学功能的影响,并探究骨质疏松的发病机制。
1.材料和方法
1.1 实验动物及主要试剂、仪器 2月龄和20月龄SPF级SD大鼠(解放军总医院动物中心);α-MEM培养基、胎牛血清(Gibco,USA);PBS、青霉素、链霉素、胰酶、甲苯胺蓝染色液、茜素红粉剂、二甲基亚砜(索莱宝,北京);碱性磷酸酶试剂盒、成骨诱导液(Sigma,USA);CCK-8试剂盒(碧云天,上海);细胞总RNA提取试剂盒、荧光定量PCR检测试剂盒(Takara,Japan);引物(生工,上海);CD29-PE、CD90-FITC、CD34-FITC、CD45-FITC(Biolegend,USA);CO2细胞培养箱(Thermo,USA);倒置相差显微镜及照相系 统 (OLYMPUS, Japan); Micro-CT(Siemens,Germany);全波长酶标仪(BioTek Instruments,USA);RT-PCR仪器(AXYGEN,USA);流式细胞仪(BD,USA);离心机(Heraens Cryofuge 8000,Germany)。
1.2 自然衰老骨质疏松大鼠模型的确立 取2月龄和20月龄SD大鼠各用3%戊巴比妥钠腹腔过量注射致死后,分离两组大鼠颌骨及股骨,并分别进行Micro-CT扫描,观察分析两组大鼠颌骨和股骨骨密度及骨小梁相关指标的变化。
1.3 两组大鼠JBMMSCs体外分离、培养和鉴定
1.3.1 JBMMSCs体外分离、培养 取2月和20月龄SD大鼠麻药过量致死,75%乙醇消毒15分钟,在超净工作台内取双侧下颌骨,仔细去除下颌骨上附丽的肌肉组织及牙槽骨中牙齿,暴露骨髓腔,取无菌60mm平皿放入5ml α-MEM培养基(置于冰上),用1ml注射器吸取含10%血清的α-MEM培养基反复冲洗骨髓腔,于37℃,50ml/L CO2孵箱培养。48h半量换液,3天后首次全换液,以后每三天换液一次。待贴壁细胞长到80%融合后,弃培养液,PBS冲洗2次,0.25mg/mL胰酶37℃消化2min;以2.5×104/cm2密度接种传代。取P3代细胞用于以下实验。
1.3.2 JBMMSCs分子表型鉴定 分别取年轻、衰老大鼠生长状态良好的P3代JBMMSCs,PBS洗2次,胰蛋白酶消化2min;1000r/min离心5min,弃上清,用PBS重悬;调整细胞密度至1×106/ml后,分装到1.5ml的离心管中,每管100ul。室温下分别向每管加入 1ulCD29(PE)、CD90(FITC)、CD34(FITC)、CD45(FITC)抗体,4℃避光孵育30min;PBS洗3次,1000 r/min离心5min;PBS重悬,流式细胞仪检测并分别计算相对应抗体阳性率(%)。
1.4 两组大鼠JBMMSCs生物学功能检测
1.4.1 JBMMSCs增殖能力的检测 克隆形成实验:分别取两组大鼠生长状态良好的P3代JBMMSCs,稀释细胞浓度为5×103/ml的单细胞悬液。取1ml分别均匀接种于直径90mm培养皿,补加7ml α-MEM培养基,十字轻轻混匀后,常规培养。每组设3个重复培养皿,10d后终止培养,PBS清洗2遍,4%多聚甲醛固定20min,PBS清洗后甲苯胺蓝染色20min,dd水冲洗并拍照。镜下观察计数:细胞≥50个记为一个克隆,并计算克隆形成率。
克隆形成率(%)=克隆形成数量/接种细胞数量×100%
CCK-8实验:分别取两组大鼠生长状态良好的P3代JBMMSCS,以2×103/孔的细胞量铺板于96孔板,每孔加入100μl α-MEM培养液常规培养,共设置7组。接种细胞后每天取出一个96孔板,向每孔加入10μl CCK8试剂,继续培养2h以后再次从孵箱取出,用酶标仪在450nm波长下测各孔的吸光度值(OD值),并记录结果。然后以OD值为纵坐标,时间为横坐标,绘制细胞生长曲线。
1.4.2 JBMMSCs成骨分化能力检测
成骨诱导:分别取两组大鼠生长状态良好的P3代JBMMSCs,以1×105/ml的密度接种于6孔板中,待细胞伸展至80%融合后,换成骨诱导液(α-MEM中含5mmol/Lβ-甘油磷酸钠、50μg/mL维生素C、0.1μmol/L地塞米松和10%FBS)培养,每3天全换液一次。
碱性磷酸酶(ALP)染色:将两组细胞分别进行成骨诱导,在诱导7天后用碱性磷酸酶染色试剂盒进行ALP染色,染色阳性结果是胞浆内出现蓝色的沉淀,染色操作步骤如下:
①cap的fast violet B salt溶于1ml ddH2O后分装(FVB蓝),50ul/支;
②染色前配固定液
4.9 ml ddH2O
0.1 ml柠檬酸原液(至室温)
7.5 ml丙酮
③吸出培养基,PBS洗;
④固定30s,ddH2O轻洗45s;
⑤50ul FVB蓝+2.35ml ddH2O混匀;
⑥100ul AS-MX溶液加入5中混匀;
⑦室温30min,其染液,ddH2O洗一次,留少量水拍照;
⑧阳性结果是胞浆内出现蓝色沉淀。
茜素红染色:将两组细胞分别进行成骨诱导21天以后,吸去原培养液,PBS反复漂洗后,用4%多聚甲醛溶液固定20min,再用配置好的茜素红染液进行染色30min。PBS冲洗三次后,倒置相差显微镜下进行观察和拍照,并对染色结果进行半定量分析。
1.4.3 Real-timePCR检测成骨相关基因Runx2、OCN的表达 分别取两组大鼠生长状态良好的P3代JBMMSCs,以1×105个cell/孔的量接种到六孔板上,经成骨诱导7d后,提取细胞总RNA,检测RNA的浓度,并反转录成cDNA。Runx2、OCN的引物序列参照表(表1)。PCR的反应体系为20μl,扩增条件为95℃5s、60℃30s,循环数39个。
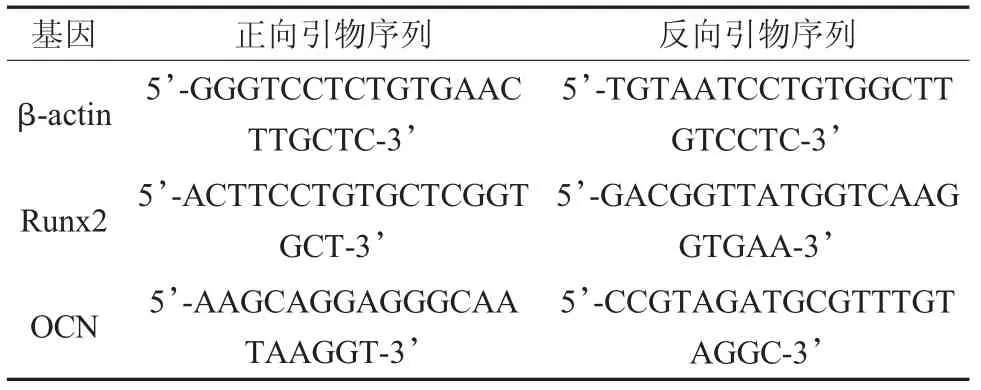
表1 实时定量荧光PCR引物序列
1.5 统计学分析 采用SPSS22.0统计软件对数据(±s)进行统计分析,两组间比较用t检验,检验水准α=0.05。
2.结果
2.1 衰老性骨质疏松大鼠模型的确立 两组大鼠经Mirco-CT扫描和图像分析显示:衰老组大鼠颌骨及股骨骨髓腔较年轻组空虚,骨密度明显下降(图1)。两组骨小梁参数统计分析显示:衰老组颌骨和股骨骨密度(BMD mg/mm3)、骨小梁数目(Tb.N 1/mm)均明显低于年轻组;而骨小梁间距(Tb.Sp μm)明显大于年轻组,两组间各参数相比,差异均有统计学意义(P<0.05)(图2)。因此,衰老性骨质疏松大鼠模型确立成功。
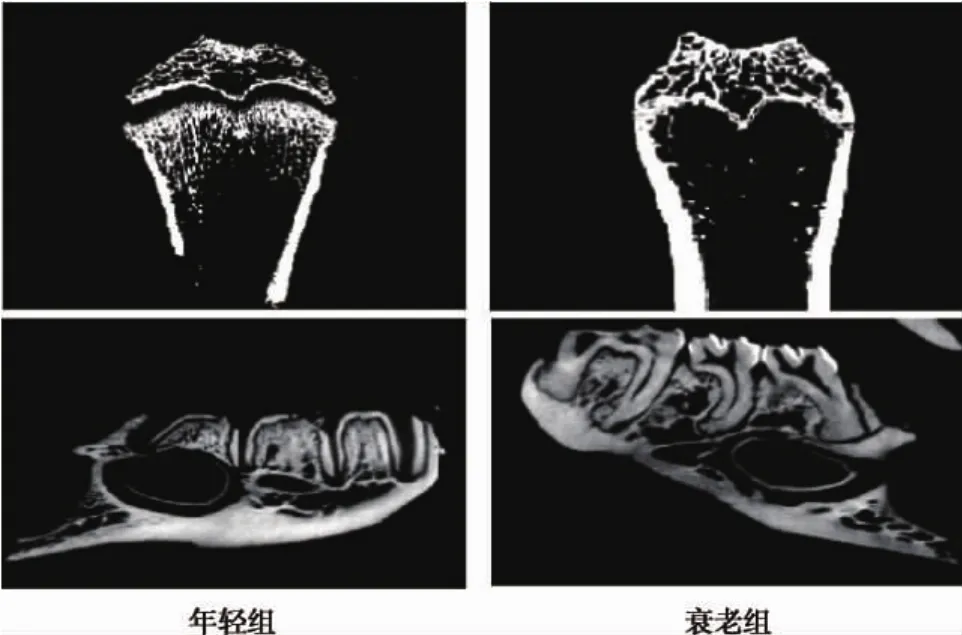
图1 两组大鼠颌骨及股骨Micro-CT扫描图像

图2 两组大鼠颌骨及股骨Micro-CT扫描数据分析结果(*P<0.05)
2.2大鼠JBMMSCs的分离、培养与鉴定 镜下观察两组大鼠JBMMSCs形态发现,年轻组和衰老组JBMMSCs都呈长梭形,与年轻组JBMMSCs相比,衰老组JBMMSCs细胞表面积较大,长宽比例降低(图 3)。

图3 两组大鼠JBMMSCs一般形态比较(10×)
经流式细胞仪检测显示,年轻组大鼠JBMMSCs表面分子CD29、CD90、CD34、CD45的表达率分别为98.60%、99.50%、3.15%、4.00%,衰老组大鼠JBMMSCs表面分子CD29、CD90的表达率分别为97.4%、97.6%,略低于年轻组,CD34、CD45的表达率分别为4.91%、5.2%,略高于年轻组。结果表明两组JBMMSCs均阳性表达干性相关分子CD29、CD90,阴性表达造血干细胞表面分子CD34、CD45,符合间充质干细胞特性(图4)。

图4 两组大鼠JBMMSCs表面抗体表达结果
2.3 两组大鼠JBMMSCs增殖能力比较 克隆形成实验结果显示,年轻组和衰老组JBMMSCs的克隆形成率分别为18.19%、5.99%,衰老组克隆形成率明显低于年轻组(*P<0.05)(图5)。
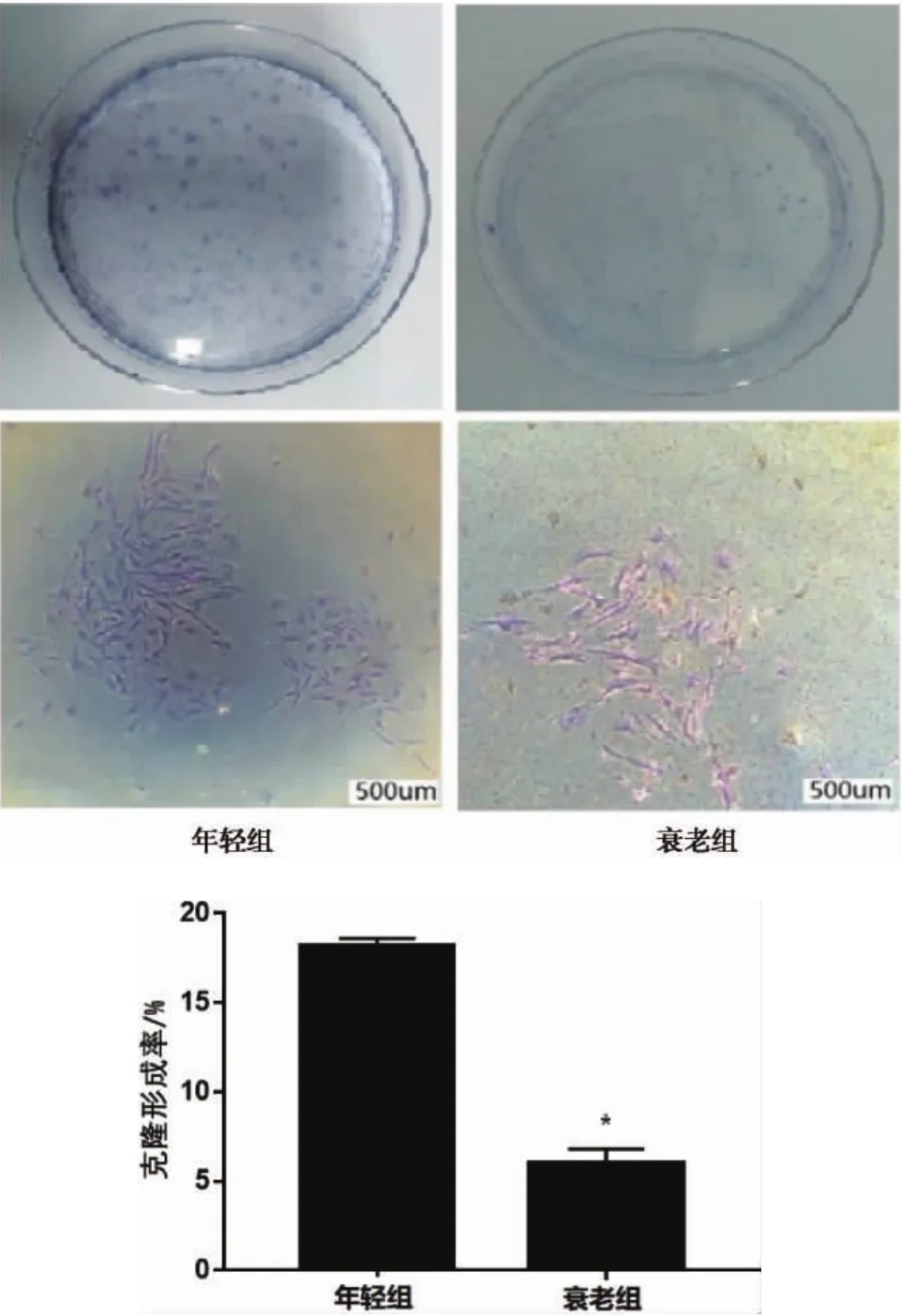
图5 两组大鼠JBMMSCs克隆形成能力比较(*P<0.05)
CCK8检测结果显示,衰老组JBMMSCs增殖能力较年轻组降低,培养后7d各时间点,两组OD值相比,从培养后3~7天差异均有统计学意义(*P<0.05)(图 6)。
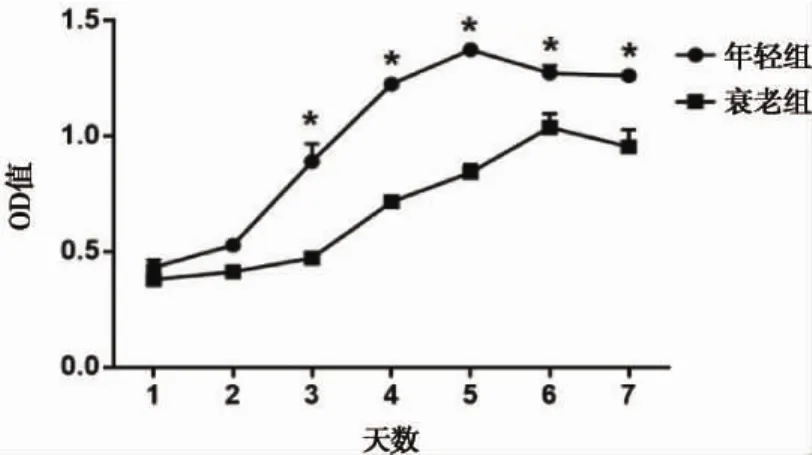
图6 两组大鼠JBMMSCs生长曲线(*P<0.05)
2.4 两组大鼠JBMMSCs成骨分化能力及成骨相关基因Runx2、OCN表达水平比较 成骨诱导7天后ALP染色结果显示:两组均有蓝色沉淀产生,年轻组生成的蓝色沉淀量高于衰老组(图7),且经Image J软件半定量分析,差异有统计学意义(*P<0.01)。

图7 两组大鼠JBMMSCs成骨诱导后ALP染色及半定量分析
成骨诱导21天后茜素红染色结果显示:对年轻组和衰老组JBMMSCs进行矿化诱导21天后,可见到细胞复层生长,染色后可看到明显的矿化结节,衰老组矿化结节形成数量低于年轻组,染色也较浅(图8),且经Image J软件半定量分析,差异有统计学意义(*P<0.05)。
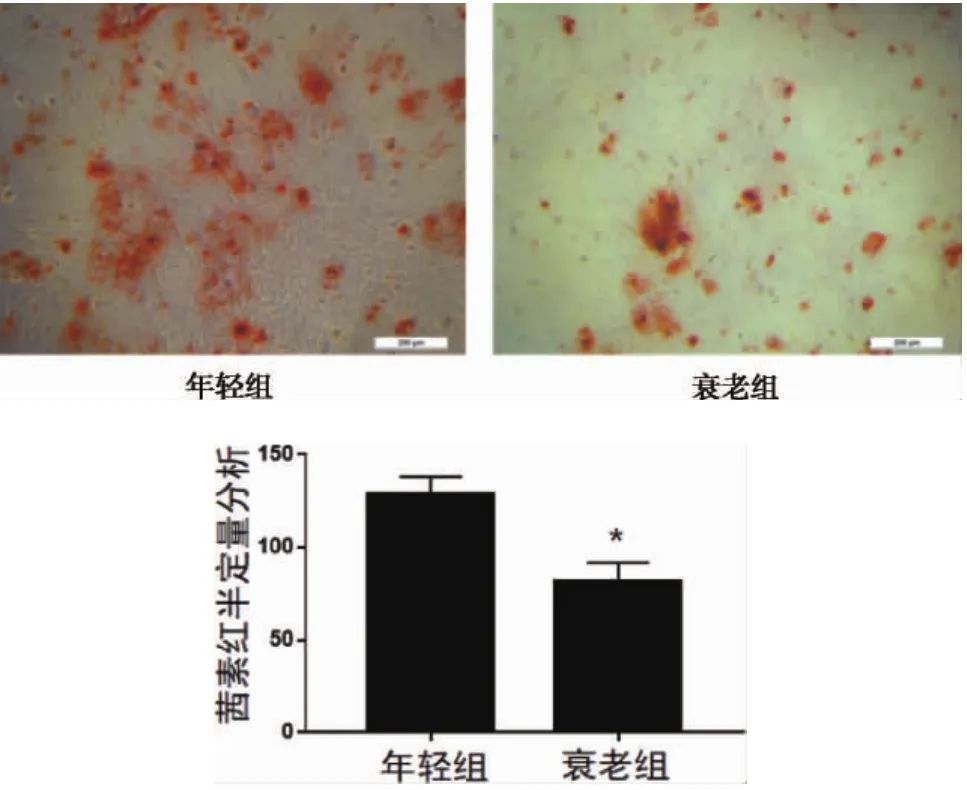
图8 两组大鼠JBMMSCs成骨诱导后茜素红染色及半定量分析
Real-time PCR检测显示,衰老组JBMMSCs成骨诱导后其Runx2 mRNA、OCN mRNA表达水平均低于年轻组(*P<0.05),(图9)。

图9 两组大鼠JBMMSCs成骨诱导后Runx2 mRNA、OCN mRNA表达水平(*P<0.05)
3.讨论
衰老是自然界各种生命不可抗拒的必然结果。随着年龄的增加,机体各个器官组织功能均发生增龄性改变,尤其在骨组织中表现明显[3]。骨质疏松症是一种退行性疾病,其特征是严重的骨质流失,导致骨质疏松和骨折风险增加。年龄相关的骨质疏松症是一种复杂的疾病,为研究此疾病,我们需要生理上相似的模型。据报道,SD大鼠超过9个月大可用于建立与年龄相关的骨丢失模型[4],已有研究证明了雄性SD大鼠随着年龄的增长会自然发展为骨质疏松症[5,6]。因此,本研究选择自然衰老20月龄SD大鼠作为衰老性骨质疏松动物模型,2月龄大鼠作为年轻组进行研究。通过对两组大鼠颌骨及股骨骨髓腔Micro-ct扫描发现,20月龄组颌骨骨密度显著下降,骨小梁数目也减少,而骨小梁分离度增加,与付欣等[7]的研究报道保持一致。表明我们选用的20月龄大鼠骨质疏松明显,可以作为衰老性骨质疏松模型进行实验。
骨髓间充质干细胞(bone-marrow-derived mesenchymal stem cells,BMSCs)是一种纺锤形、可黏附的非造血干细胞,可以从许多组织中分离出来,具有自我更新和多向分化能力,可以分化成各种中胚层细胞类型,比如成骨细胞,成软骨细胞和脂肪细胞[8]。在骨重建时,BMSCs募集随后增殖,谱系承诺,谱系特性标记物表达,胶原蛋白分泌和细胞基质矿化,此连续级联的生物过程驱动了骨的形成[9]。有学者研究表明,老年小鼠来源的BMSCs的数目、增殖能力与年轻小鼠来源的相比明显降低[10]。当MSC发生衰老时,其成骨分化能力下降而成脂能力增强[11,12],提示我们BMSCs的生物学功能下降可能是导致骨衰老退行性变的重要原因。然而,颌骨与四肢躯干骨胚层来源及成骨方式均不同,前者来源于外胚间充质,成骨方式是膜内成骨,后者来源于中胚层,成骨方式为软骨内成骨[13~15]。有学者研究报道,颌骨骨髓间充质干细胞的牙槽骨原位成骨能力要高于四肢躯干骨[16]。在衰老性骨质疏松条件下,颌骨骨髓间充质干细胞的增殖、分化能力将如何变化目前尚未见报道。本实验对此展开了针对性研究,研究结果显示,自然衰老大鼠JBMMSCs的增殖、成骨分化能力均较年轻大鼠明显下降,表明自然衰老骨质疏松微环境下JBMMSCs生物学功能发生改变。
Runx2是成骨分化过程中的关键调控因子,有研究表明,Runx2缺失的鼠的成骨细胞分化完全被抑制,既不能骨膜内成骨,也不能软骨内成骨[17]。OCN由成骨细胞分泌,作为成骨细胞活动的重要标志[18]。我们分别对Runx2和OCN的表达进行了检测,结果显示Runx2和OCN在衰老组的表达明显低于年轻组,与前面染色结果一致。表明自然衰老骨质疏松微环境可能通过影响成骨相关关键基因的表达而影响了JBMMSCs的成骨分化功能。
本实验结果表明,JBMMSCs随着增龄其生物学功能发生改变,主要表现为其增殖能力、成骨分化能力降低,这可能是导致衰老性骨质疏松的重要原因,但其具体分子调控机制尚不清楚,有待我们进一步研究,为延缓和治疗衰老性骨质疏松提供重要依据。
