甾体衍生物02F04通过非核受体上调PAM212细胞胸腺基质淋巴细胞生成素的研究①
2019-08-14平澤典保李子敏廖禹程杨志福王婧雯奚苗苗张玲琴文爱东
翁 琰 平澤典保 李子敏 廖禹程 王 霞 杨志福 王婧雯 奚苗苗 张玲琴 文爱东
(中国人民解放军空军军医大学第一附属医院药剂科,西安710032)
胸腺基质淋巴细胞生成素(Thymic stromal lymphopoietin,TSLP)是一种新型的、与白介素7(Interleukin-7,IL-7)类似的Ⅰ型细胞因子[1],主要由上皮细胞分泌,特别是经抗原激活的支气管上皮细胞、皮肤角化细胞、基质细胞、肥大细胞、平滑肌细胞和肺成纤维细胞[2]。TSLP可以支持B淋巴细胞的生长、分化以及T 细胞增殖,并能在缺乏IL-7的条件下促进淋巴细胞的发育[3],尤其对树突状细胞(Dendritic cells,DCs)的活化、分化、成熟和迁移具有重要的调控作用[4]。近年研究发现,TSLP是过敏性炎症的一个重要启动因子。过敏原刺激上皮细胞后,细胞中TSLP表达上调,从而产生Th2生成倾向的微环境,分泌Th2型细胞因子,生成炎症反应性Th2细胞,进而触发过敏性炎症反应[5]。因此,TSLP对呼吸道感染和非特异性炎症过程有广泛的免疫调节作用,出现在多种变态反应性疾病中,如过敏性鼻炎、过敏性哮喘、湿疹等[6,7];而诱导TSLP产生的化合物如二甲苯和壬酸等也因能增加对抗原的敏感性而加速了过敏炎症反应,从而被鉴定为炎症加速器[8,9]。因此,TSLP作为治疗过敏性疾病的一种主要靶分子,明确诱导TSLP产生的化合物及其作用靶点可以潜在地预防过敏性疾病的发生。
TSLP表达的一个主要特点是受激素调节。研究已表明几个核受体如视黄酸受体(Retinoic acid receptor,RAR),维甲酸X受体(Retinoid X receptor,RXR),过氧化物酶体增生物激活受体(Peroxisome proliferator-activated receptor,PPAR),维生素D受体(Vitamin D receptor,VDR)和糖皮质激素受体(Glucocorticoids receptor,GR)参与并调节了TSLP的产生[10-14]。目前,甾体化合物如糖皮质激素可以减轻炎症已广为人知,而其中涉及通过作用于GR而下调TSLP表达的作用机制也已被阐明。然而,迄今为止,未见有甾体化合物诱导TSLP产生的研究报道。本课题组发现了一个具有甾体结构的化合物02F04在小鼠角质细胞PAM212中诱导TSLP的产生[15]。02F04具有甾体生物碱结构,且其甾体结构与肝X受体(Liver X receptor,LXR)的内源性配体如22(R)-羟基胆固醇[22(R)-hydroxycholesterol,22R-HC]完全一致(图1)。然而,02F04诱导的TSLP表达是否该甾体结构有关、是否通过作用于核受体而介导仍然不得而知。因此,本实验就此进行了详细的研究,为探索类似结构的甾体化合物在诱导TSLP产生的作用机制提供重要的参考依据。
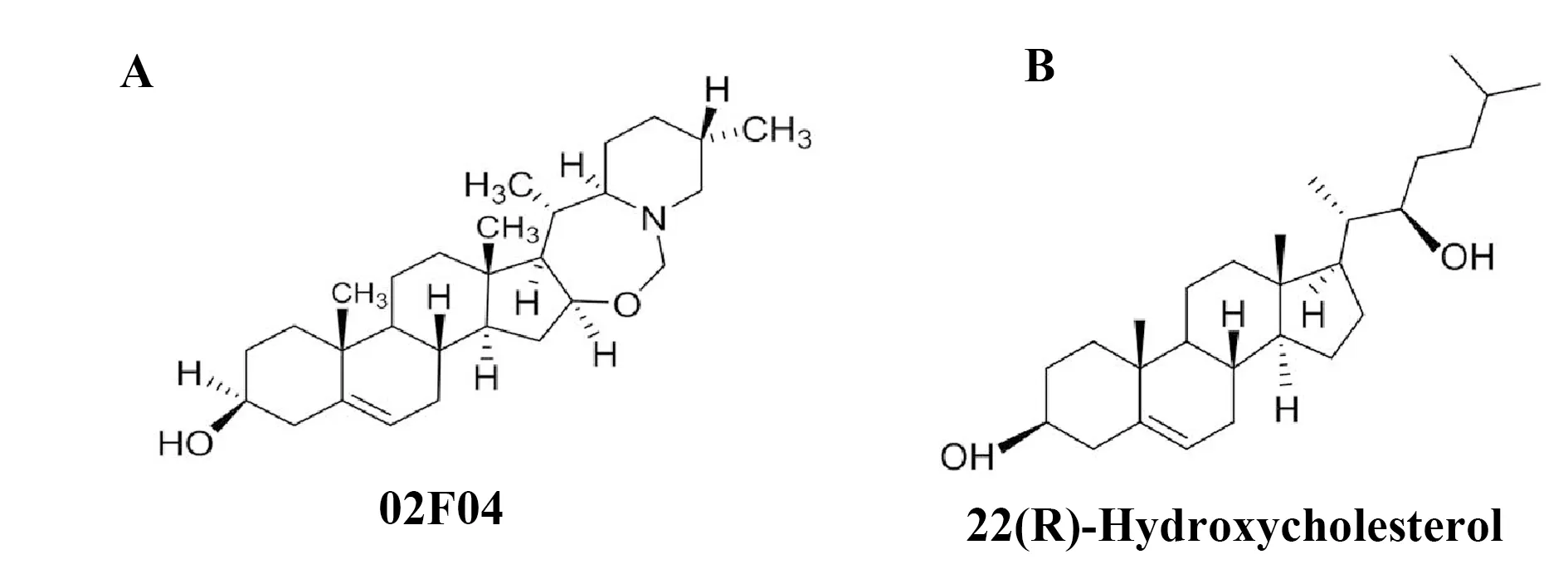
图1 02F04和22(R)-羟基胆固醇的化学结构式Fig.1 Chemical structures of 02F04 and 22(R)-hydroxycholesterol
1 材料与方法
1.1 材料
1.1.1 试剂 胎牛血清(法国Biowest公司),小牛血清(美国MP Biomedicals公司),MEMα培养粉(美国Invitrogen公司),胰蛋白酶(美国Gibco公司),小鼠TSLP ELISA试剂盒(美国R&D Systems公司),牛血清白蛋白和焦碳酸二乙酯(美国Sigma-Aldrich公司),RNAiso plus、PrimeScriptTMRT Master Mix和SYBR premix Ex TaqⅡ(日本TaKaRa公司),ELISA POD Substrate TMB试剂盒(日本Teaque公司),氯仿、乙醇、异丙醇和磷酸(日本和光纯药工业公司)。
02F04购自俄罗斯InterBioScreen公司;曲格列酮、地塞米松、BMS 753、LG 100268、GW 9662、GSK 3787、GW 501516和MC903购自美国Sigma-Aldrich公司;BMS 195614和MM 11253购自英国Tocris生物科技公司;HX 531购自日本乙卯研究所;米非司酮购自法国Roussel-Uclaf公司;BMS 189961购自荷兰Axon Medchem公司。
1.1.2 仪器 iMark吸收光酶标仪(美国Bio-Rad公司),NanoDrop®2000紫外-可见光分光光度计(美国赛默飞公司),梯度PCR 扩增仪和TP800实时荧光定量PCR仪(日本TaKaRa公司)。
1.1.3 细胞 PAM212 是BALB/c小鼠皮肤来源的角质细胞,由美国国立卫生研究院Stuart H Yuspa教授馈赠。
1.2 方法
1.2.1 细胞培养与接种 将PAM212细胞分装于直径为10 cm的培养皿中,按常规方法培养,即用含10%胎牛血清的MEMα培养液,置于37℃、CO2体积分数为5%的恒温恒湿培养箱中培养。当细胞长满至80%~90%时,先用PBS洗涤2次,再加入胰蛋白酶消化细胞,并用小牛血清终止消化,收集消化液,离心后去除上清液,沉淀用含10%胎牛血清的MEMα培养液制成细胞悬液,并调整细胞浓度为每1 ml含1.0×105个PAM212细胞的悬液,接种于细胞培养板中,常规培养。
1.2.2 细胞处理和分组 PAM212细胞接种24 h后,PBS洗涤2次,更换培养基并给予各种刺激,包括各种不同浓度的核受体(RARα,RARγ,RXR,PPARγ,PPARδ,VDR,GR或LXR)激动剂或抑制剂,细胞根据处理情况分为02F04单独刺激组、空白对照组以及各种激动剂或抑制剂与02F04联合给药组,各组均给药刺激24 h后测定TSLP蛋白浓度。此外,02F04单独刺激PAM212细胞4、8、12或24 h,测定相关核受体的靶基因表达;02F04与LXR激动剂或抑制剂单独给药或联合给药4 h,测定LXR靶向基因三磷酸腺苷结合盒转运体A1(ATP-binding cassette transporter A1,ABCA1)的表达。
1.2.3 细胞培养上清液中TSLP蛋白浓度检测 药物刺激细胞至指定时间后,收集上清液,按TSLP ELISA试剂盒说明书操作,在450 nm处测吸光度值,并在570 nm处进行波长校正。通过绘制标准曲线求出样品中TSLP的实际浓度。
1.2.4 MTT法检测PAM212细胞的存活率 1.2.3中收集细胞上清液后,PBS洗涤细胞2次,每孔加入10%MTT-PBS溶液(含5 mg/ml噻唑蓝)继续孵育4 h,弃上清后加入DMSO溶解产生的蓝紫色结晶甲瓒,于570 nm 波长处测定每孔吸光度(A)值,按下列公式计算细胞存活率,细胞存活率=实验组A值/对照组A值×100%。
1.2.5 实时荧光定量PCR 反应 用RNAiso Plus提取总RNA,逆转录为cDNA。PCR反应体系10 μl,扩增程序为:①热变性:95℃30 s,循环1次;②PCR反应:95℃5 s,60℃30 s,循环40次;③融解:95℃15 s,60℃30s,95℃15 s,循环1次。根据融解点来确定扩增产物的特异性。使用二阶导数最大值法计算扩增产物的荧光信号达到设定阈值时所经过的扩增循环次数(Ct),以GAPDH基因的Ct作为内参对照,用2^(内参基因Ct值-目的基因Ct值)计算目的基因的相对表达。引物由日本Fasmac公司合成,mGAPDH(forward: 5′-TGTGTCCGTCGTGGATCTGA-3′;reverse:5′-TTGCTGTTGAAGTCGCAGGAG-3′),mTSLP(for-ward:5′-AGCTTGTCTCCTGAAAATCGAG-3′,rever-se:5′-AGGTTTGATTCAGGCAGATGTT-3′),mCRAB-P2(forward:5′-TCCACCACTGTGCGAAC-3′,reverse:5′-CGGAAGTCGTCAGGCAGT-3′),mTGM2(forward:5′-GGTGATCCTCGCTTGAGTGT-3′,reverse:5′-CTCCAAATCACACCTCTCCAG-3′),mPLIN2(forward:5′-GACCTCTGCGGCCATGAC-3′,reverse:5′-GTATTGGCAACCGCAATTTGT-3′)。
2 结果
2.1 02F04呈浓度及时间依赖性地增加PAM212细胞中TSLP因子的表达 不同浓度的02F04刺激PAM212细胞24 h时,TSLP的蛋白水平如图2A所示。02F04能显著刺激PAM212细胞中TSLP表达的上调,且在0.3~30 μmol/L范围内,随着02F04刺激浓度的增加,PAM212细胞中TSLP的产生增多。然而,当02F04的浓度为30 μmol/L时,细胞存活率急剧降低至55.8%。因此,后续实验选择02F04的浓度为10 μmol/L进行进一步考察。图2B表明随着02F04刺激时间的延长,PAM212细胞的TSLP基因表达量也在不断增加,24 h与对照组比已有显著性差异(P<0.001),48 h表达进一步增加。
2.2 PAM212细胞中TSLP 的表达与VDR无关 VDR激动剂MC903在0.3~10 μmol/L范围内刺激PAM212细胞24 h,对细胞存活率没有显著影响,TSLP表达也没有变化(图3)。表明MC903不影响PAM212细胞中TSLP的产生。
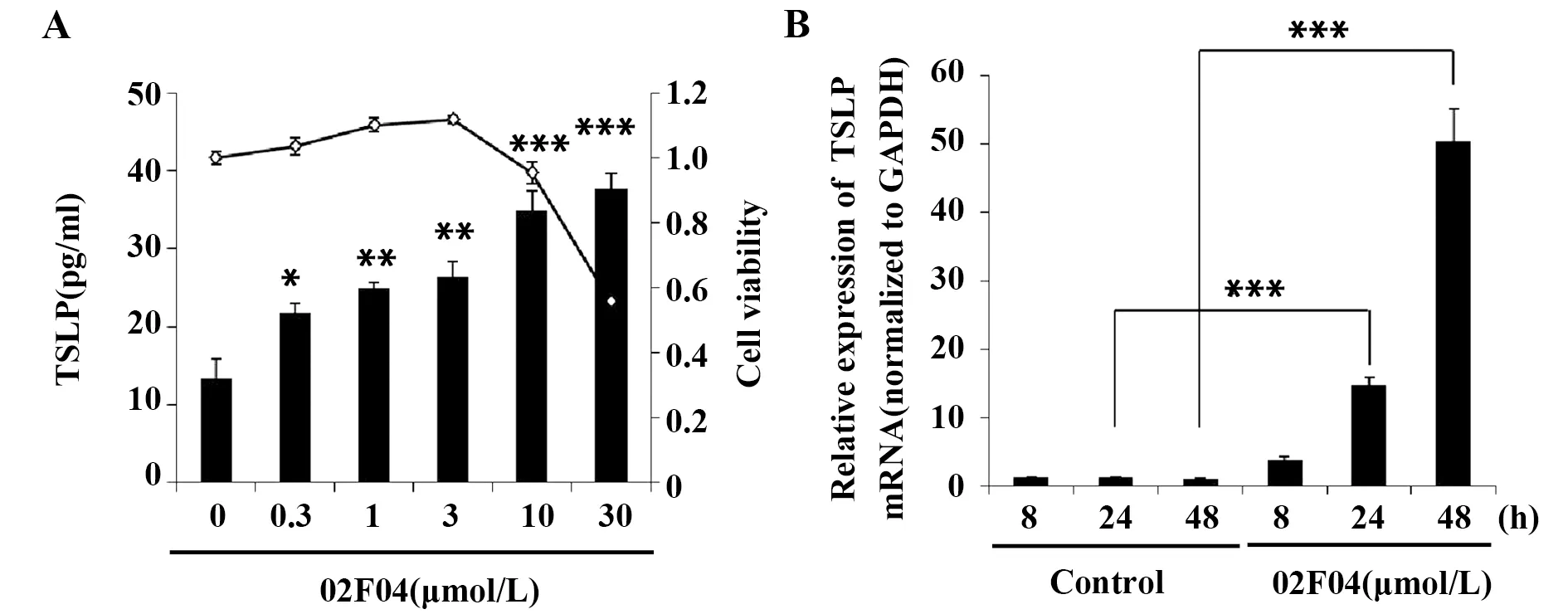
图2 02F04对PAM212细胞TSLP表达的影响Fig.2 Effect of 02F04 on TSLP expression in PAM212 cellsNote: *.P<0.05,**.P<0.01,***.P<0.001 vs the corresponding control;A.■.TSLP production;-◇-.Cell viability;B.Values in the control group with treatment for 8 h were set to 1.0.
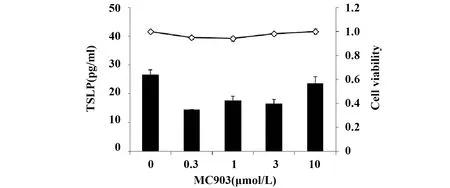
图3 VDR激动剂不能诱导PAM212细胞中TSLP的表达Fig.3 TSLP expression in PAM212 cells was not induced by agonist of VDRNote: ■.TSLP production;-◇-.Cell viability.
2.3 02F04诱导的TSLP表达与RAR无关 图4A表明,RARα激动剂BMS 753和抑制剂BMS 195614分别在1~10 μmol/L范围内单独刺激PAM212细胞24 h,均不影响细胞存活率及TSLP的产生;与02F04联合使用时,也不影响细胞存活率,且与02F04单独刺激产生的TSLP比较均无显著性差异。图4B表明,RARγ激动剂BMS 189961和RARγ抑制剂MM 11253单独刺激或与02F04联合使用时,在不影响细胞存活率的基础上,均呈浓度依赖性地降低对照组及02F04刺激组的TSLP水平。由图4C可知,02F04刺激PAM212细胞24 h内,RAR靶向基因CRABP2的表达与对照组比较无显著变化,且未测得RAR的另一靶向基因CYP26A1的表达。结果表明:02F04诱导的TSLP产生与RAR无关。
2.4 02F04诱导的TSLP表达与RXR无关 图5A表明,RXR激动剂LG 100268和抑制剂HX 531分别在0.3~3 μmol/L范围内,单独刺激或与02F04联合使用时,均对细胞存活率无显著影响。LG 100268虽然能降低对照组及02F04刺激组的TSLP表达水平,高浓度的HX 531单用也能降低对照组的TSLP表达, 而又不改变02F04诱导的TSLP水平。RXR靶向
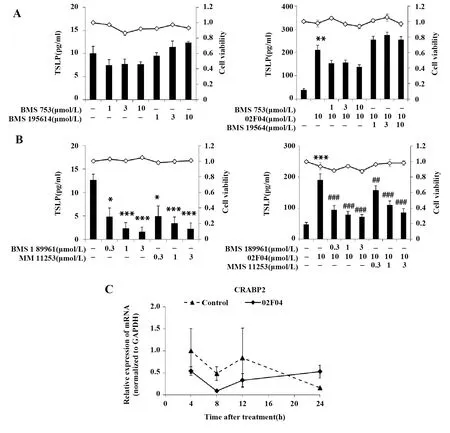
图4 RAR对02F04诱导的TSLP表达的影响Fig.4 Effect of RAR on 02F04-induced TSLP expressionNote: *.P<0.05,**.P<0.01,***.P<0.001 vs the non-stimulated group;##.P<0.01,###.P<0.001 vs 02F04 alone.A,B.■.TSLP production;-◇-.Cell viability;C.Values in the control group with treatment for 4 h were set to 1.0.
基因TGM2的表达如图5B所示,可见02F04刺激PAM212细胞24 h内,TGM2的表达无显著变化。结果表明:02F04诱导的TSLP表达与RXR无关。
2.5 02F04诱导的TSLP表达与PPAR无关 PPARγ激动剂曲格列酮与抑制剂GW 9662以及PPARδ激动剂GW 501516与抑制剂GSK 3787,分别单独使用或与02F04联合刺激PAM212细胞时,TSLP的表达与细胞存活率如图6A和B所示。除了30 μmol/L曲格列酮与02F04联合刺激组的细胞存活率降至80%以下外,其他刺激组细胞均未出现明显毒性;激动剂或抑制剂的加入不能改变对照组以及02F04诱导组的TSLP表达。基因水平检测结果表明,02F04刺激PAM212细胞24 h内,不影响PPAR的靶向基因PLIN2的表达(图6C)。因此,02F04诱导的TSLP表达与PPAR无关。
2.6 02F04诱导的TSLP表达与GR无关 GR激动剂地塞米松在0.1~1 μmol/L范围内,显著降低对照组及02F04诱导组的TSLP表达(图7A)。然而,GR抑制剂米非司酮并没有出现相反的作用,而是显著降低了02F04诱导的TSLP 产生(图7B)。结果表明:02F04诱导的TSLP产生与GR无关。
2.7 02F04激活LXR,但与其诱导的TSLP表达无关 图8A表明,LXR激动剂22R-HC刺激PAM212细胞4 h,显著增加了LXR靶向基因ABCA1的表达(P<0.001),而同时合用LXR抑制剂GSK2033后,ABCA1的表达被显著抑制(P<0.05)。10 μmol/L 02F04刺激PAM212细胞后4 h也显著增加了ABCA1的表达(P<0.001), 增加程度与10 μmol/L
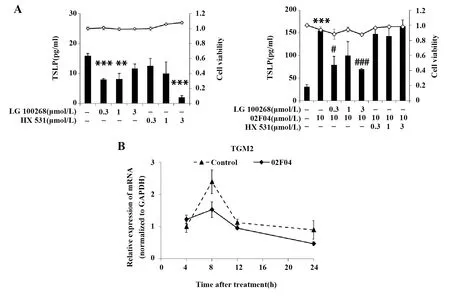
图5 RXR对02F04诱导的TSLP表达的影响Fig.5 Effect of RXR on 02F04-induced TSLP expressionNote: **.P<0.01,***.P<0.001 vs the non-stimulated group;#.P<0.05,###.P<0.001 vs 02F04 alone.A.■.TSLP production;-◇-.Cell viability;C.Values in the control group with treatment for 4 h were set to 1.0.
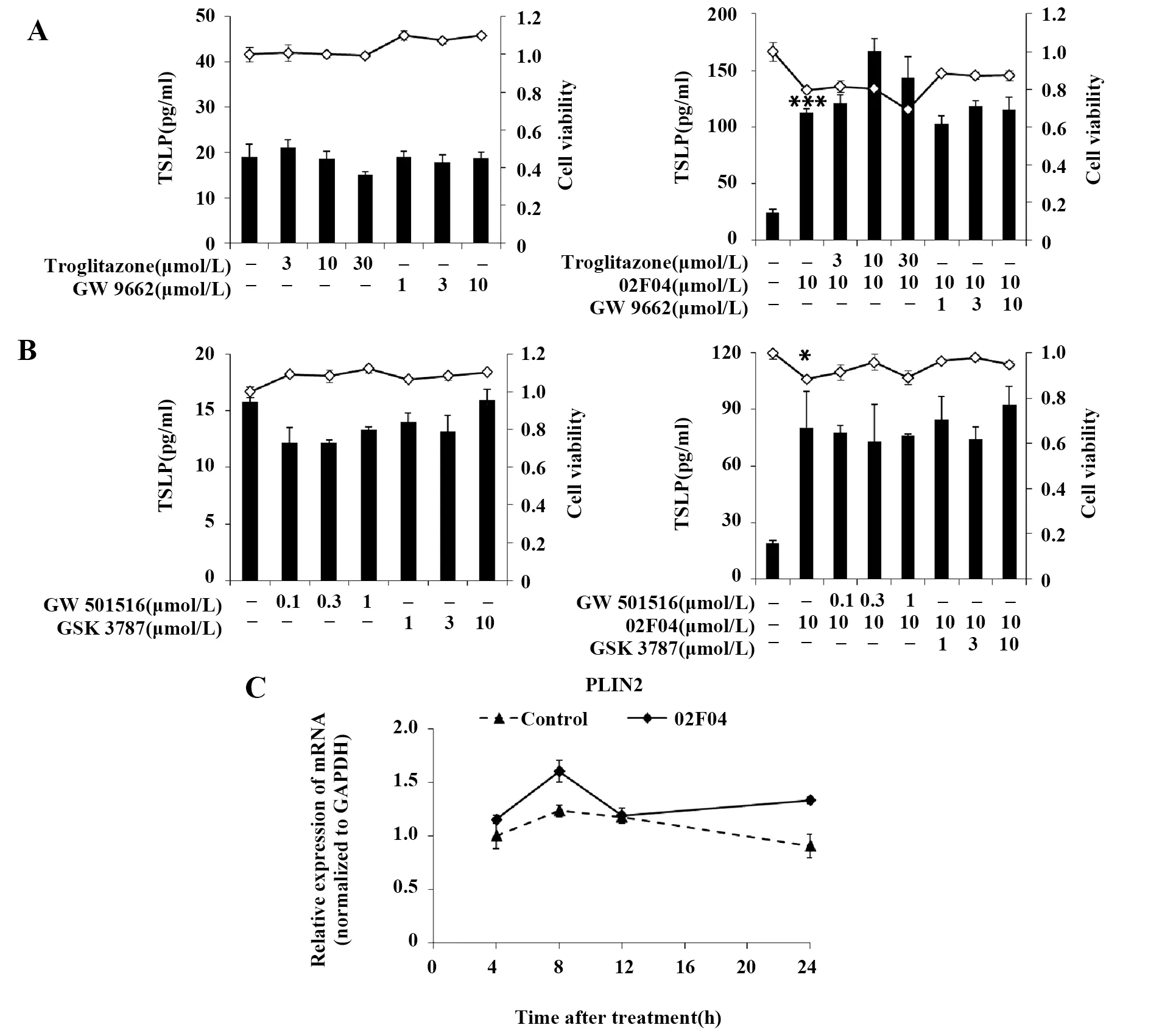
图6 PPAR对02F04诱导的TSLP表达的影响Fig.6 Effect of PPAR on 02F04-induced TSLP expressionNote: *.P<0.05,***.P<0.001 vs the non-stimulated group.A,B.■.TSLP production;-◇-.Cell viability;C.Values in the control group with treatment for 4 h were set to 1.0.
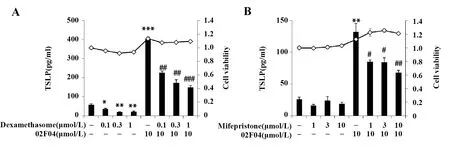
图7 GR对02F04诱导的TSLP表达的影响Fig.7 Effect of GR on 02F04-induced TSLP expressionNote: *.P<0.05,**.P<0.01,***.P<0.001 vs the non-stimulated group;#.P<0.05,##.P<0.01,###.P<0.001 vs 02F04 alone.■.TSLP production;-◇-.Cell viability.
22R-HC相当,并能被GSK2033显著抑制(P<0.01),表明02F04有类似LXR激动剂的作用,能激活LXR并增加ABCA1的表达。
研究02F04诱导的TSLP表达是否通过激活LXR介导,结果发现,PAM212细胞被刺激24 h 后,在不影响细胞存活率的基础上,22R-HC不能诱导TSLP的产生,GSK2033也不能抑制02F04诱导的TSLP产生(图8B)。表明02F04虽然能激活LXR,但是02F04诱导的TSLP表达不是通过激活LXR产生的。
3 讨论
TSLP是上皮细胞来源的细胞因子,对树突状细胞的极化和Th2类细胞因子的产生有极其重要的影响。TSLP可触发DCs介导的Th2类炎症反应,在过敏性疾病的发生中扮演着重要的角色,是过敏性炎症的重要启动因子之一[16]。诱导TSLP产生的化合物可以增加机体对抗原的敏感性从而加速过敏性炎症反应的发生。因此,鉴定能够诱导TSLP产生的化合物可以预防过敏性疾病的发生及进一步恶化。具有甾体结构的02F04虽然显著增加了PAM212细胞中TSLP的表达,但是其诱导的TSLP产生过程比较缓慢且持续,TSLP的基因水平在02F04刺激至48 h时仍一直在增加,这与其他诱导TSLP产生的化合物如豆蔻酰佛波醇乙酯相比完全不同。分析原因,02F04的化学结构完全不同于目前已知的TSLP生成诱导剂。
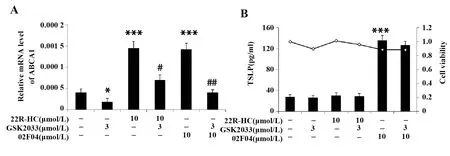
图8 02F04通过介导LXR上调ABCA1的表达,而其诱导的TSLP产生与LXR无关Fig.8 Involvement of LXR in 02F04-induced ABCA1 but not TSLP expressionNote: *.P<0.05,***.P<0.001 vs the non-stimulated group;#.P<0.05,##.P<0.01 vs.02F04 alone.B.■.TSLP production;-◇-.Cell viability.
核受体超家族是一组配体激活的转录因子家族,通过在信号分子与转录应答间建立联系,调控着细胞的生长和分化。研究已表明核受体RAR和VDR的激动剂可以诱导TSLP的表达,RXR、PPAR和GR的激动剂可抑制TSLP的产生[10-14]。另外,02F04的甾体结构与LXR的内源性配体22R-HC完全一致,因此应首先考虑02F04诱导的TSLP表达是否通过作用于核受体而产生。结果表明,02F04不能诱导RAR、RXR和PPAR靶向基因的表达,RAR、RXR、PPAR和GR的激动剂及抑制剂单用或者与02F04合用后,PAM212细胞中TSLP的产生也没有出现规律性的变化。此外,VDR激动剂MC903也不影响PAM212细胞中TSLP的表达。虽然02F04有类似LXR激动剂的作用,能与22R-HC一样程度地增加ABCA1的表达,且增加的ABCA1均能被LXR拮抗剂显著地抑制,但是02F04诱导的TSLP表达不是通过激活LXR产生的。因为LXR激动剂不能诱导TSLP的产生,LXR拮抗剂也不能抑制02F04诱导的TSLP表达。所以,02F04虽然具有甾体结构,但是其诱导TSLP产生的作用不是通过核受体介导的。实验证明02F04刺激PAM212细胞后,ABCA1和TSLP基因表达的峰值分别出现在4 h和48 h或更长时间,这个差异很大的达峰时间也间接反映02F04可能通过不同的作用机制诱导ABCA1和TSLP表达。因此,推测02F04是通过细胞内信号通路而不是核受体诱导了TSLP的表达。已有不少研究报道了细胞内信号通路如MAPK、NFκB、RAR-RXR、ROCK和Gq/11等可以参与TSLP的产生[17,18]。02F04具有与以往报道的TSLP生成诱导剂不同的化学结构,02F04是否能激活细胞内信号通路、具体通过哪种信号通路诱导TSLP的产生将是我们下一步的研究内容。
