金线莲一次性成苗技术研究
2019-08-13陈园媛姚金澳崔永一
陈园媛 姚金澳 崔永一
摘要:以福建金线莲茎段为试验材料,采用植物组织培养和无土栽培技术相结合的方法,探讨不同基本培养基、植物生长调节物质浓度、栽培基质以及栽培条件对金线莲一次性成苗培养的影响。结果表明,以1/4MS为基本培养基,添加1 mg/L NAA和1.5 mg/L 6-BA的营养液,以树皮为栽培基质,在75%遮阴率、空气流通量大的栽培条件下最有利于金线莲茎段一次性成苗的生长。
关键词:金线莲;一次性成苗;营养液;栽培基质;栽培条件
中图分类号: S682.310.4+3 文献标志码: A 文章编号:1002-1302(2019)01-0052-04
金线莲为兰科开唇兰属多年生草本,素有金草、神药、乌人参等美称,也被称为药中之王,除具有药用价值外,也是一种极具观赏价值的室内观叶植物[1-3]。
随着金线莲的药用价值和观赏价值不断被大众所熟知,金线莲的市场需求不断增加。但野生金线莲遭到人为的大量掠夺性采摘,接近灭绝,因此发展金线莲人工育苗,实现其种苗产业化生产势在必行。目前,有较多学者致力于金线莲组织培养研究,如不同基本培养基、外植体、取材部、有机添加物等对金线莲组织培养的影响[4-6]。
但是传统植物组织培养存在污染率高、培养流程繁琐、培养周期长、成本高等诸多问题。通过一次性成苗技术获得植株的方法用于植物组培苗生产,具有缩短培养周期、简化培养流程、降低污染、节省种苗生产成本等优势,是优质种苗组培快繁的重要手段[7]。一次性成苗是在外植体形成愈伤组织后,不转移到分化培养基上,直接在原培养基上分化,进行继代培养,不需要设置诱导培养基、增殖培养基和生根培养基,直至形成健壮的全苗[5]。近年来,菊花、小麦、水稻、大豆、棉花、甘蔗、紫色甘薯以及药用植物霍山石斛等,都有了植物组织培养一次性成苗的报道[8-15]。
目前关于金线莲一次性成苗培养以及不同栽培条件对金线莲生长影响的研究较少。江建铭等研究金线莲一步成苗培养,所用的培养基为l/2MS+2.0 mg/L 6-BA+1.0~1.5 mg/L NAA+0.05 mg/L芸苔素内酯+100 g/L香蕉泥[16]。朱萍研究一次性成苗培养得出,最优培养基为MS+1.0 mg/L 6-BA+1.5 mg/L NAA+150 g/L土豆+30 g/L蔗糖+6.5 g/L琼 脂+2.0 g/L活性炭[17]。何碧珠等研究多倍体金线莲一次性成苗及移栽得出,最佳培养基为MS+1.0 mg/L 6-BA+1.5 mg/L NAA+150 g/L土豆+3%蔗糖+0.65%琼脂+0.15% 活性炭[18]。邵清松等研究不同移栽条件对金线莲组培苗成活率以及生长的影响,得出在 1/4MS 营养液、泥炭-河沙2 ∶ 1、种植密度为3 cm×3 cm、遮阴率70%条件下,金线莲生长最好[19]。但现行的一次性成苗的研究需要在培养基中进行接种操作,仍存在较高的污染率,而且拟对出瓶苗进行提前炼苗驯化,拟出瓶的组培苗生长速度较慢,成活率偏低,不利于工厂化生产。
本研究采用的一次性成苗技术利用组织培养和无土栽培方法,将茎段放入穴盘液体培养,得到对外部环境有较强适应性的金线莲苗,从而简化组培过程,节省炼苗出瓶的时间,直接栽植。本试验主要探讨不同基本培养基、植物生长调节物质浓度、栽培基质以及栽培条件对一次性成苗生长的影响,为构建金线莲一次性成苗培养体系以及金线莲工厂化生产提供科学依据。
1 材料与方法
1.1 试验材料
选取长势较为一致的福建金线莲组培苗,取茎段,用自来水清洗黏附的培养基,待用。
1.2 试验方法
1.2.1 试验地点 试验在浙江农林大学平山温室进行,温室温度为28 ℃/20 ℃(昼/夜),光照时间为14 h/d,光照度为1 500~2 000 lx,适合金线莲生长。
1.2.2 试验时间 2016年9月至2017年9月,每2个月为1个试验周期。
1.3 试验设计
1.3.1 不同基本培养基对金线莲一次性成苗的影响 试验设MS、1/2MS、1/4MS、H1(花宝一号基本培养基)、H2(花宝二号基本培养基)、清水(CK)共6个处理,将茎段种植到盛有树皮基质的穴盘中,并将穴盘分别置于不同的营养液上,营养液pH值为5.8,每组处理26株,3次重复(图1)。
1.3.2 不同NAA浓度对金线莲一次性成苗的影响 在 1/4MS 基本培养基中加入1 mg/L的6-BA,以及不同浓度的外源激素NAA,NAA设4个浓度梯度,分别为0、0.5、1.0、1.5 mg/L。具体培养同“1.3.1”节。
1.3.3 不同6-BA浓度对金线莲成苗的影响 在1/4MS基本培养基中加入1 mg/L的NAA,同时加入不同浓度的外源激素6-BA,设4个浓度梯度,分别为0、0.5、1.0、1.5 mg/L。具體培养同“1.3.1”节。
1.3.4 不同栽培基质对金线莲一次性成苗的影响 将茎段分别种植到盛有泥炭土+珍珠岩(1 ∶ 1)、树皮、水苔基质的穴盘中,将穴盘置于1/4MS基本培养基以及1.5 mg/L 6-BA、1 mg/L NAA营养液上,具体培养同“1.3.1”节。
1.3.5 不同遮阴程度对金线莲一次性成苗的影响 将茎段种植到盛有树皮基质的穴盘中,并将穴盘放置于1/4MS基本培养基以及1.5 mg/L 6-BA、1 mg/L NAA营养液上,采用遮阳网进行遮阴度的设置,遮阴网位于培养容器顶部1 m 处。采用LI-6400光照度测定仪测定各处理的光照度,分别为全光照(2 000 lx)、50%遮阴(1 000 lx)、75%遮阴(500 lx)。具体培养同“1.3.1”节。
1.3.6 不同通气条件对金线莲一次性成苗的影响 将茎段种植到盛有树皮基质的穴盘中,并将穴盘放置于1/4MS基本培养基以及1.5 mg/L 6-BA、1 mg/L NAA营养液上,在75%的遮阴条件下,在培养容器上分别进行覆盖密封的塑料薄膜、带有通气孔的塑料薄膜以及未覆盖薄膜处理。具体培养同“1.3.1”节。
1.4 数据处理
经金线莲一次性成苗培养60 d后,对新叶数、生根数、根长、鲜质量、干质量分别进行统计,使用SPSS 19.0软件进行数据分析。
2 结果与分析
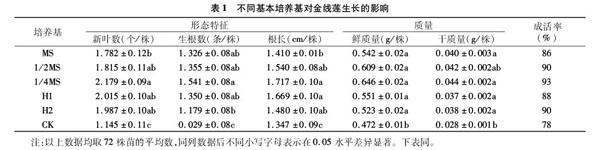
2.1 不同基本培养基对金线莲一次性成苗培养的影响
研究发现,一次性培养60 d后,对照组金线莲茎段成活率只达78%,其他处理组成活率均达85%以上。随着MS基本培养基浓度的降低,金线莲茎段成活率升高,其中1/4MS基本培养基处理组成活率高达93%,其茎段新叶数、生根数、根长、鲜质量及干质量的积累均高于其他处理组,并且与对照组存在显著性差异(表1)。综合上所述,1/4MS基本培养基最适合于金线莲茎段一次性培养。
2.2 不同浓度NAA对金线莲一次性成苗的影响
研究发现,当NAA浓度为1.0、1.5 mg/L时,金线莲茎段的成活率达到90%以上,与对照组相比有较大的差异(表2)。随着NAA浓度升高,生物量的积累呈现先上升后下降的趋势,说明低浓度或较高浓度的NAA不利于金线莲茎段一次性成苗的生长,当NAA浓度为1.0 mg/L时,茎段的鲜质量、干质量、根数、根长的累积最高。
2.3 不同浓度6-BA对金线莲一次性成苗的影响
研究发现,0.5 mg/L 6-BA处理的金线莲茎段成活率仅为80.5%,而1.5 mg/L 6-BA处理成活率高达93.0%,其金线莲茎段新叶数、生根数、根长、鲜质量及干质量积累均高于其他处理组,与对照组存在显著性差异。随着6-BA浓度升高,金线莲茎段生物量增加,说明较高浓度的6-BA有利于金线莲茎段一次性成苗的生长(表3)。综上所述,1.5 mg/L 6-BA处理最适宜金线莲一次性成苗的生长。
2.4 不同栽培基质对金线莲一次性成苗培养的影响
研究发现,在3组处理成活率均达到85%以上,其中树皮处理成活率高达91.1%,其试验材料生长健壮,尤其是在金线莲茎段根长,鲜质量、干质量等方面均高于其他处理组,并且存在显著性差异,在新叶数与生根数上,树皮处理与泥炭土+珍珠岩处理之间无显著差异,但与水苔处理之间差异显著(表4)。综上所述,在这3种基质中,选择树皮作为基质更有利于金线莲茎段一次性成苗的生长。
2.5 不同遮阴率对金线莲一次性成苗培养的影响
研究发现,一次性培养60 d后,不同遮阴处理对金线莲茎段一次性成苗生长状况有较大影响。2 000 lx处理金线莲茎段成活率只有78.6%,而500 lx处理茎段成活率高达91.8%。500 lx处理的茎段新叶数、生根数、根长、鲜质量及干质量的积累最高,并与2 000 lx处理存在显著差异,说明遮光处理有利于金线莲一次性成苗的生长(表5)。综上所述,500 lx处理(遮阴率75%)适合金线莲一次性成苗的生长。
2.6 不同通气条件对金线莲一次性成苗培养的影响
研究发现,覆盖密封塑料薄膜处理的金线莲茎段成活率仅为83.7%,不覆盖薄膜处理成活率高达90.4%。处理3金线莲茎段新叶数、生根数、根长、鲜质量及干质量积累均高于其他处理组,与覆盖密封塑料薄膜处理存在显著性差异。随着通气流通量增大,金线莲茎段生物量增加(表6)。试验结果说明,较好的通气条件有利于金线莲茎段一次性成苗的生长。
3 结论与讨论
在植物组织培养中,基本培养基提供组培苗生长所需的营养,其组分和浓度均为培养材料生长的重要影响因子[20]。MS基本培养基相比花宝营养元素的种类和比例较均衡,可满足植物的营养和生理需要,但高浓度的MS基本培养基会抑制金线莲的生长[21-25]。本研究中也观察到1/4MS基本培养基最有利于金线莲在一次性成苗的培养。
在之前研究中观察到,随着NAA浓度升高,其越来越有利于金线莲一次性成苗的生长,但较高浓度的NAA会抑制金线莲一次性成苗的生长,说明NAA不同浓度对金线莲一次性成苗培养起着较大的作用[26]。本试验也得出,在一定的范围内,随着NAA浓度升高,金线莲一次性成苗的生物量积累越多,但较高浓度的NAA会抑制金线莲一次性成苗的生长。另外,朱萍在一次性成苗研究中发现,随着6-BA浓度升高,芽分化能力加强,生根数增加[17]。本试验也得到类似的结果,6-BA 浓度为1.5 mg/L时最有利于金线莲一次性成苗生长。
金线莲属浅根性植物,根系不发达,对栽培基质的要求较高,需要栽培基质具有机质含量高、疏松、透气、透水、清洁等特点[25-26]。不同基质构成、种植品种对金线莲成活率与生长的影响不同[27-29]。本试验结果表明,树皮最适宜金线莲一次性成苗的生长。在水培的條件下,一次性成苗基质需要优良的透气性,因为树皮呈细块状,孔隙度大,持水性较低,透气性佳,更有利于金线莲一次性成苗的生长。
金线莲是阴生植物[30],合理的遮阴避免太阳的直晒,降低植株表面温度,提高光合生产能力,促进植物的生长[31]。邵青松等在研究不同移栽条件对金线莲组培苗成活率及生长的影响时观察到在70%的遮阴条件下,金线莲组培驯化苗生长最旺[19]。本试验中也观察到在75%的遮阴条件下,最有利于金线莲一次性成苗生长。
通气促进生根,增加叶面积,有利于克服驯化期间生长缓慢等问题,同时可以提高苗的成活率。胡庆等在研究改善容器通气条件对绿巨人增殖的影响时得到,较好的通气条件能够促进植物的生长,大大降低植株的病害问题,提高苗的成活率[32]。本试验得到了类似的结果,在未覆盖塑料薄膜条件下,金线莲一次性成苗的生长更优良。
本试验从基本培养基以及不同的植物生长调节物质方面开展了一次性成苗快速繁殖的研究,并探索金线莲一次性成苗的最佳基本培养基以及最佳的环境条件,较系统地构建了金线莲一次性成苗培养体系。这对金线莲优良种苗规模化生产具有较重要的理论与实践意义,也为其他植物繁殖应用中提供借鉴。
参考文献:
[1]钟岑生. 金线莲的药用价值与开发[J]. 广西农业科学,1997(2):102-104.
[2]李介元. 台湾金线莲[J]. 台湾农业探索,2001(2):42.
[3]何荆洲,卜朝阳,李俊玲,等. 不同基质对金线莲栽培的影响[J]. 湖北农业科学,2014,53(20):4900-4902.
[4]林秀莲,杨自轩,严旭超,等. 金线莲组培快繁及移栽技术研究[J]. 园艺与种苗,2016(5):6-9.
[5]王建勤,陈 钢. 金线莲原球莲的组培诱导[J]. 中药材,1995,18(1):3-5.
[6]王丽芳. 不同培养基及添加物对金线莲生长量的影响[J]. 北方园艺,2011(5):175-176.
[7]孙 贞. 铁皮石斛组培体系优化[D]. 杭州:浙江农林大学,2013.
[8]王丽娟,沈 默,吴绛云,等. 名种菊花快速繁殖技术[J]. 北方园艺,2002(3):61.
[9]颜昌敬,黄剑华. 小麦组织培养的一步成苗法[J]. 上海农业学报,1986,2(1):19-26.
[10]刘吉新,赵国珍,王建军,等. 生物技术在水稻育种上的应用[J]. 云南农业科技,2002(3):40-43.
[11]王升吉,关元华,王洪岩,等. 大豆不同外植体组织培养及再生研究[J]. 沈阳农业大学报,1999,30(3):255-259.
[12]孙敬三. 新疆陆地棉抗性生物技术育种的新改进[J]. 新疆农业大学学报,1999(4):259-265.
[13]符 碧. 甘蔗成苗技术的研究[J]. 广东教育学院学报,2000,6(3):119-121.
[14]杨贤松. 紫色甘薯茎尖培养一步成苗技术研究[J]. 资源开发与市场,2008,24(4):292-293.
[15]马绍鋆. 霍山石斛组培一次性成苗技术初探[D]. 合肥:安徽农业大学,2008.
[16]江建铭,王志安,俞旭平,等. 一种药用金线莲组织培养一步成苗快速繁殖方法:200810059233.3[P]. 2008-07-09.
[17]朱 萍. 福建赤壁金线莲高效繁殖与栽培技术研究[D]. 福州:福建农林大学,2014.
[18]何碧珠,吴沙沙,邹双全,等. 多倍体金线莲一次性成苗及移栽[J]. 福建农林大学学报(自然科学版),2016(5):522-528.
[19]邵清松,周爱存,黄瑜秋,等. 不同移栽条件对金线莲组培苗成活率及生长的影响[J]. 中国中药杂志,2014(6):955-958.
[20]周维燕. 植物细胞工程原理与技术[M]. 北京:中国农业大学出版社,2001:59-60.
[21]周玉美,陈 丽,崔永一,等. 台湾金线莲(Anoectochilus formosanus)快繁体系的构建[J]. 东北林业大学学报,2009,37(12):43-47.
[22]Ket N Y. Effect of environmental conditions on in vitro and ex vitro growth of jewel orchid(Anoectochilus formosanus Hayata)[D]. Cheongju:Chungbuk National University,2002.
[23]王建明,王松良,詹巧杰,等. 金线莲组织培养的条件优化研究[J]. 中国现代中药,2013(1):45-49.
[24]赵 玥,郭顺星. 两种金线莲组培苗的促根试验研究[J]. 辽宁农业科学,2011(3):40-42.
[25]邵果园,邬玉芬. 不同培养基组分对金线莲组培苗壮苗生根的影响[J]. 热带农业科技,2014(1):14-15,24.
[26]张福生,郭顺星. SPSS正交设计在福建金线莲组织培养中的应用[J]. 中国中药杂志,2009,34(20):2581-2585.
[27]王光华. 台湾金线莲组培苗移栽技术研究[J]. 林业勘察设计,2008(2):102-106.
[28]游振城. 金线莲组培苗栽培技术[J]. 林业勘察设计,2012(1):186-188.
[29]吴艺东. 金线莲组织培养及栽培技术研究[J]. 安徽农学通报,2009,15(15):46,211.
[30]甘金佳,蒋水元,李 虹,等. 不同栽培基质对金线莲生长和主要活性成分的影响[J]. 江苏农业科学,2017,45(14):112-114.
[31]陈 裕,林坤瑞. 金线莲生长发育与光照强度关系[J]. 福建热作科技,1996,21(4):22-23.
[32]胡 庆,吴雪松,徐 坚. 低pH值水培及改善容器通气条件对绿巨人增殖的影響[J]. 江西林业科技,2002(2):15-16.万 如,王亚军,安 巍,等. 基于psbA-trnH序列条形码鉴定21份枸杞属植物[J]. 江苏农业科学,2019,47(1):56-59.
