迎春樱组培快繁体系研究
2019-08-13南程慧薛晓明伊贤贵
南程慧 薛晓明 伊贤贵
摘要:以MS+0.1 mg/L NAA为基本培养基,迎春樱无菌初代培养材料于2~4 mg/L 6-BA诱导10 d后转接于MS+0.5 mg/L 6-BA+0.05 mg/L NAA培养基上,增殖系数为5.9~10.7;壮苗培养以MS+0.5 mg/L 6-BA+0.05 mg/L NAA+1.0 mg/L GA3+5 g/L琼脂为宜,材料后期生长旺盛,培养基污染率低,材料于C1中诱导10 d后转接于此培养基,增殖系数为8.2,丛芽健壮;以3/4MS为基本培养基,NAA浓度为0.04~0.08 mg/L时,生根率为 91.5%~100.0%,不定根较多,茎叶健壮;生根苗开瓶后直接移栽于V细沙 ∶ V珍珠岩 ∶ V蛭石=1 ∶ 1 ∶ 1组成的基质穴盘中,培养室中生长20 d时成活率为93.8%。
关键词:迎春樱;组培;培养基;增殖系数;生根率;快繁体系
中图分类号: S685.120.4+3 文献标志码: A 文章编号:1002-1302(2019)01-0048-04
迎春樱(Cerasus discoidea)属蔷薇科(Rosaceae)樱属(Cerasus)[1-2],是我国野生樱花资源中的特有种;伞形花序,着花1~3朵,花色粉红,2—3月先叶开放,为早春优质的观赏花木;主要分布于安徽南部、江西东北部、浙江大部等地的山谷林中或溪边灌丛中海拔200~1 100 m处。
迎春樱作为华东低海拔山区重要的春花树种,南京、杭州、武汉、南昌、上海、无锡、长沙等地已对其进行园林利用,但多为直接的野外成树移植,这对其野生资源的自然更新造成一定的破坏,科学合理的引种繁育体系鲜见报道[3]。野外调查结果显示,由于受人为开发、自然繁殖衰退等因素的影响,野生迎春樱的种群数量有逐渐减少的趋势。为合理保护和开发利用野生迎春樱资源,建立科学快速的无性繁育体系,在前期已获得无菌外植体的基础上,本研究对其组培快繁体系的建立进行了系统的研究,以期为迎春樱的合理开发利用及保护提供理论依据。
1 材料与方法
1.1 试验材料
在前期组培无菌外植体研究的基础上,以0.2 g/L GA3处理过的迎春樱种子为试验材料[4-5],于温度为15 ℃、光照度1 500~2 000 lx、光暗周期16 h/8 h的光照培养箱中培养30 d左右,以具有2张真叶的无菌沙床苗为外植体材料。
1.2 试验条件
培养室温度为(23±2) ℃,光照度为1 500~2 000 lx,每天光照16 h。
1.3 试验方法
1.3.1 丛芽诱导与增殖试验 选用光照培养箱培养30 d左右的迎春樱沙床苗为外植体材料,剪去幼根,无菌水浸洗3遍,70%乙醇浸洗30 s后,无菌水浸洗3遍,再用0.2% HgCl2溶液浸洗3 min后,无菌水浸洗5~6遍,置于灭菌滤纸上吸干材料表面水分后,将每个材料剪成带子叶和真叶的茎段接种于MS+1 mg/L 6-BA+0.1 mg/L NAA的启动培养基上;培养室中培養30 d左右,选择无菌增殖芽进行丛芽的诱导与增殖。丛芽诱导与增殖以MS为基本培养基,含30 g/L蔗糖、7 g/L琼脂粉,附加0.5~6.0 mg/L细胞分裂素6-BA、0.05~0.40 mg/L 生长素NAA,pH值为5.8。采用梯度和交叉配比的方法进行目的培养基的筛选试验,30 d时进行观测统计。
1.3.2 继代壮苗试验 以MS为基本培养基[6-10],附加 0.5 mg/L 细胞分裂素6-BA、0.05 mg/L生长素NAA、0.5~2.0 mg/L GA3、4~7 g/L琼脂粉,pH值5.8,蔗糖30 g/L,采用梯度和交叉配比的方法进行壮苗培养基的筛选试验。
1.3.3 生根培养试验 分别以1/4MS、1/2MS、3/4MS、MS为基本培养基,附加0.2~1.0 mg/L生长素NAA,采用梯度和交叉配比的方法进行生根培养基的筛选试验。
1.3.4 试管苗移栽试验 选取生根培养40 d左右的健壮生根苗,分别采用开瓶炼苗5 d后移栽[11-15]和开瓶后直接移栽的方法[12]进行试管苗的移栽试验,生根苗出瓶时须清水冲洗干净,并用0.1%多菌灵蘸根处理;在参考前人试验的基础上[13],选用高温灭菌过的V细沙 ∶ V珍珠岩 ∶ V蛭石=1 ∶ 1 ∶ 1组成的基质作为栽培基质,于穴盘中生长20 d后观测统计试管苗移栽成活情况。
2 结果与分析
2.1 不同激素配比对丛芽诱导与增殖的影响
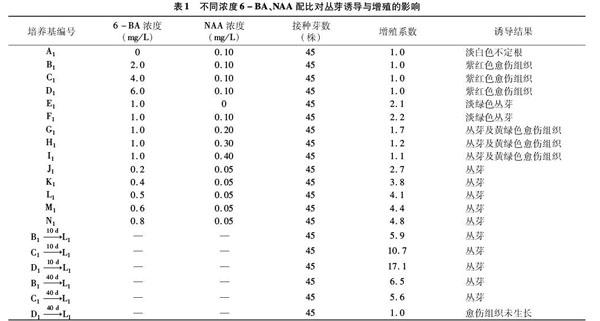
沙床苗转接至MS+1 mg/L 6-BA+0.1 mg/L NAA初代培养基上,培养40 d时增殖系数为2.2,增殖芽数量少,难以满足组培快繁的需要;在前期的预试验中,高浓度的6-BA刺激可诱导丛芽发生,据此笔者在初代培养基上,通过对6-BA、NAA的浓度进行梯度和交叉配比的方法来探讨外源激素对迎春樱丛芽诱导与增殖的影响(表1)。
根据A1、B1、C1、D1、F1试验观测结果,在NAA浓度为 0.10 mg/L 不变的条件下,通过对6-BA的浓度进行梯度和交叉配比可知,在培养基中只有外源激素NAA的情况下,NAA起到促进不定根产生的作用,6-BA在浓度为1.0 mg/L时可促进丛芽的产生,随着其浓度的逐渐提高,其作用由促进丛芽产生转变为促进紫红色愈伤组织产生(图1),从而抑制了丛芽的产生;根据E1、F1、G1、H1、I1试验观测结果,在 6-BA 为1.0 mg/L不变的条件下,通过对NAA的浓度进行梯度和交叉配比可知,在培养基中只有外源激素6-BA的情况下,6-BA则起到促进丛芽产生的作用,随着NAA浓度的逐渐提高,NAA对迎春樱的影响由A1中的促进生根转变为促进外植体基部黄绿色愈伤组织的产生,从而抑制了不定根及丛芽的产生。由此可知,6-BA对迎春樱的影响在于促进其丛芽的产生,NAA则起到促进其不定根产生的作用,高浓度的6-BA、NAA均可促进愈伤组织的产生,从而抑制丛芽和不定根的产生。
据J1、K1、L1、M1、N1试验观测结果可知,在NAA浓度为0.05 mg/L不变的情况下,6-BA浓度在0.4~0.6 mg/L时丛芽生长较好,过低或过高浓度的6-BA均不利于迎春樱外植体高生长。外植体于B1、C1、D1中刺激10、40 d时转接至L1培养基中,丛芽发生明显;刺激10 d时转接的材料随着 6-BA 浓度的提高,丛芽增殖系数逐渐升高,其中外植体于D1转接至L1的增殖系数最大,达17.1,部分单株增殖系数最大可达49.5,但过高刺激产生的丛芽生长细弱,部分叶片卷缩、枯黄,出现玻璃化现象;刺激40 d时转接的材料随着 6-BA 浓度的提高,丛芽增殖系数下降或无丛芽产生。由此可知,丛芽诱导与增殖试验时,6-BA刺激浓度不易过高,时间不易过长,刺激浓度过高时,后期丛芽生长不良,以2~4 mg/L 刺激浓度为宜;刺激时间过长时,外植体转变为愈伤组织,后期轉接生长难以诱导丛芽,以刺激时间10 d左右、材料未形成明显的愈伤组织为宜。
2.2 继代壮苗
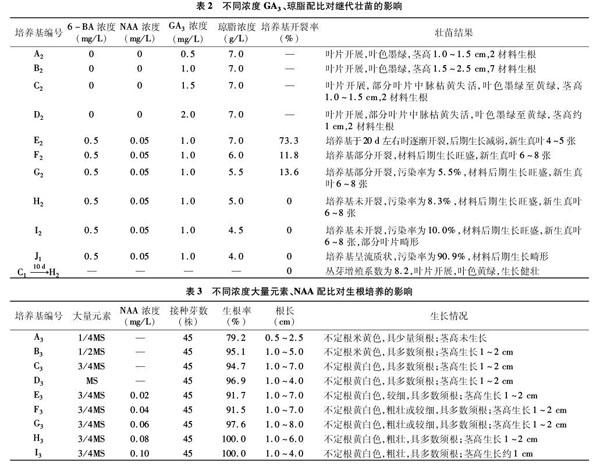
丛芽诱导与增殖试验中6-BA刺激浓度过高容易导致丛芽过多,后期生长出现丛芽细弱、叶片卷缩、枯黄、玻璃化等现象,同时丛芽增殖多、生长快需要消耗大量水分,外植体生长一段时间后容易造成培养基失水开裂,出现材料后期生长衰弱的现象;赤霉素具有促进细胞分裂和茎的伸长的作用,琼脂浓度则对培养基软硬具有调节作用,为达到继代壮苗的目的,在附加GA3的基础上,对MS培养基中琼脂浓度进行调节,以筛选出适合迎春樱后期生长的壮苗培养基。每个处理36个材料,30 d后观测统计材料生长情况,具体结果见表2。
由表2可知,A2、B2、C2、D2处理中,材料叶片开展,无叶片卷缩畸形及玻璃化现象,除B2茎高1.5~2.5 cm外,各处理高生长不明显,处理间差别不大,均有少量的生根现象,B2处理材料后期生长最好。据此可知GA3起到促进迎春樱叶片开展、减少玻璃化的现象,GA3浓度为1.0 mg/L时,可起到促进迎春樱叶片开展、茎段伸长的目的。
以MS+0.5 mg/L 6-BA+0.05 mg/L NAA+1.0 mg/L GA3 为基本培养基, 对培养基中琼脂浓度进行梯度交叉配比可知,培养基中琼脂浓度≥5.5 g/L时,30 d观测时均有不同程度的开裂现象,其中,琼脂含量为7.0 g/L时,开裂率达73.3%,材料后期生长减弱;琼脂浓度降低,开裂率随之降低。琼脂浓度≤5.0 g/L,30 d观测时培养基无开裂,有不同程度的污染现象;琼脂浓度≤4.0 g/L时,培养基呈流质状或液态,接种操作困难,培养基容易污染,后期污染率高达90.9%,材料生长畸形;琼脂浓度为4.5~6.0 g/L时,培养基呈固态,接种操作容易,后期材料生长旺盛,新生真叶6~8张。由此可知,培养基琼脂浓度不宜过低或过高,以30~40 d不开裂为基准,培养基中琼脂浓度为5.0 g/L左右时,可起到继代壮苗的目的。
外植体材料于C1中培养10 d后转接至H2,30 d时观测丛芽增殖系数为8.2,叶片开展,叶色黄绿,后期生长健壮(图2),起到丛芽诱导增殖及壮苗的双重目的。
2.3 生根培养
由丛芽诱导与增殖试验结论可知,NAA具有促进外植体基部产生不定根的作用,依据前人的相关研究通过对MS培养基中大量元素和NAA浓度进行梯度和交叉配比的方法[10-13],探讨适合迎春樱的生根培养基。40 d时观测生根生长情况,具体配比观测结果见表3、图3。
由表3可知,对MS培养基中的大量元素进行梯度配比,各处理均有不同程度的生根现象,A3处理生根率最低,为 79.2%,40 d时根长仅0.5~2.5 cm,茎高约1 cm,生长缓慢;B3、C3、D3处理生根率均在90%以上,具不定根1~8条,不定根又具多数须根,米黄色或黄白色,B3、D3处理根长较C3短,茎高1~2 cm,叶色墨绿,生长健壮。据此可知,迎春樱为易生根植物,MS培养基中不添加任何外源激素的情况下均有不同程度的生根现象;培养基中大量元素过低对迎春樱生根及茎叶健壮生长有不利影响,过高则对其生根造成一定的抑制作用,影响不定根的伸长,以3/4MS培养基生根效果较好,但不定根细弱,移栽容易断根。
以3/4MS培养基为基本培养基,对NAA浓度进行梯度交叉配比可知,随着NAA浓度的提高,不定根由细变粗,生根率也逐渐提高,培养基中NAA浓度达0.08 mg/L时,生根率可达100.0%;NAA浓度为0.10 mg/L时,生根率虽高,但茎叶生长较弱,40 d观测时,茎高未生长,茎叶发黄,逐渐失去生长能力;NAA浓度≤0.02 mg/L时,不定根细弱,NAA作用不明显。据此可知,以3/4MS培养基为基本培养基,NAA浓度对迎春樱不定根的粗细、健壮有影响,浓度过低不定根细弱,浓度过高不定根粗短,茎叶生长缓慢,NAA浓度0.04~0.08 mg/L 是迎春樱生根培养基的合适浓度,生根率均在91%以上,不定根较多,茎叶健壮。
2.4 生根苗的炼苗移栽
选取F3、G3、H3培养基中的健壮生根苗进行炼苗移栽试验,采用开瓶炼苗5 d后移栽于V细沙 ∶ V珍珠岩 ∶ V蛭石=1 ∶ 1 ∶ 1组成的基质穴盘中的方法,20 d时观测生根苗成活率为 9.4%;采用开瓶后直接移栽于V细沙 ∶ V珍珠岩 ∶ V蛭石=1 ∶ 1 ∶ 1组成的基质穴盘中的方法,将穴盘置于培养室(培养温度、光照等条件同生根培养一致)中培养20 d时观测生根苗成活率为93.8%,新生真叶2~3张(图4)。
据试验观测结果可知,开瓶炼苗5 d后培养基开裂,生根苗部分不定根暴露于空气中,干燥失水,失去活力,同时上部叶片失水萎蔫,移栽后成活率低,这种方法不适于迎春樱的炼苗移栽;迎春樱为易生根植物,生根培养不定根良好,采用直接移栽于同等温度、光照条件下炼苗移栽的方法,移栽后缓苗期短,污染率低,植株生长健壮,生根苗成活率达93.8%,该方法较前一种方法更适于迎春樱的炼苗移栽。
3 讨论与结论
在MS+0.1 mg/L NAA为基本培养基的条件下,6-BA具有促进迎春樱丛芽产生的作用,浓度过高则促进愈伤组织的产生。在丛芽诱导与增殖试验中,可采取前期高浓度6-BA刺激诱导丛芽,后期低浓度增殖生长的方法进行迎春樱的丛芽诱导与增殖;前期刺激6-BA浓度以2~4 mg/L为宜,刺激时间10 d左右,后期转接至MS+0.5 mg/L 6-BA+0.05 mg/L NAA培养基上,增殖系数为5.9~10.7,起到丛芽诱导与增殖的目的,转接至MS+0.5 mg/L 6-BA+0.05 mg/L NAA+1.0 mg/L GA3+5 g/L琼脂壮苗培养基上,30 d时增殖系数为8.2,起到丛芽诱导增殖及壮苗的双重目的。随着继代次数的增多,外源激素在植物体内不断积累,后期叢芽诱导与增殖可适当降低6-BA刺激浓度和时间。
在未附加其他外源激素的情况下,对MS培养基中大量元素进行梯度配比,40 d时试管苗均有不同程度的生根现象,说明迎春樱为易生根植物;以3/4MS为基本培养基,NAA浓度对迎春樱不定根的粗细、健壮有影响,NAA浓度为 0.04~0.08 mg/L时,生根率为91.5%~100.0%,不定根较多,茎叶健壮,为迎春樱的合适生根培养基。生根培养40 d左右时,将生根苗直接开瓶移栽于V细沙 ∶ V珍珠岩 ∶ V蛭石=1 ∶ 1 ∶ 1 组成的基质的穴盘中,20 d时成活率为93.8%,新生真叶2~3张,成活率高,生长健壮;45 d左右进行大田移栽,成活率在90%以上。
本研究表明,高浓度的6-BA可有效促进愈伤组织的产生,而迎春樱通过愈伤组织获得胚体再生相当困难,植物遗传转化的众多研究已证明,通过愈伤组织再生系统转化率较高。因此,在本研究的基础上,通过愈伤组织开展迎春樱胚体再生体系研究成为开展转基因工作的重要环节[16],是迎春樱组培快繁尚需攻关完善的环节,同时,为使理论更好地应用于生产,迎春樱组培苗大田移栽后,后期成活率高低、生长健壮与否、个体变异情况是后续仍须深入研究的课题。
参考文献:
[1]俞德浚,陆玲娣,谷粹芝,等. 中国植物志:第38卷[M]. 北京:科学出版社,1986:46-89.
[2]王贤荣. 国产樱属分类学研究[D]. 南京:南京林业大学,1997:56-58.
[3]南程慧. 迎春樱居群变异与繁殖生物学研究[D]. 南京:南京林业大学,2012:138-155.
[4]南程慧,王贤荣,汤庚国,等. 迎春樱组培无菌外植体获得方法初探[J]. 湖北民族学院学报(自然科学版),2010,28(3):251-255.
[5]王沙生,高荣孚,吴贯明. 植物生理学[M]. 2版.北京:中国林业出版社,1990:303-306.
[6]Kris P,Tess A,Jerzy N. Tissue culture propagation of Mongolian cherry(Prunus fruticosa)and Nanking cherry(Prunus tomentosa)[J]. Plant Cell,Tissue and Organ Culture,2005,82(2):207-211.
[7]Ning G G,Fan X L,Huang W J,et al. Micropropagation of six Prunus mume cultivars through high-frequency axillary shoot proliferation and ISSR analysis of cloned plants[J]. Acta Biologica Cracoviensia,2007,49(1):25-31.
[8]李 勇,方扬辉,郑雪燕,等. 福建山樱花组培快繁技术[J]. 林业科技开发,2015,29(1):20-23.
[9]李 蒙. 山樱花高海拔居群生态学特征及组织培养[D]. 南京:南京林业大学,2013:70-80.
[10]王光萍,黄敏仁. 福建山樱花的组织培养及植株再生[J]. 南京林业大学学报(自然科学版),2002,26(2):73-75.
[11]吕月良,陈 璋,施季森,等. 福建山樱花不定芽诱导和植株再生规模化繁殖试验[J]. 南京林业大学学报(自然科学版),2006,30(3):105-108.
[12]闫道良,王贤荣,钦 佩,等. 钟花樱组织培养再生体系的建立[J]. 林业科技开发,2006,20(3):21-24.
[13]荣冬青,王贤荣. 垂枝早樱“红枝垂”组培快繁试验[J]. 林业科技开发,2008,22(5):72-75.
[14]和凤美,朱永平,杨晓红,等. 冬樱花愈伤组织诱导和抑制褐化初探[J]. 中国农学通报,2010,26(12):130-134.
[15]高新一,王玉英. 植物无性繁殖实用技术[M]. 北京:金盾出版社,2003:319-454.
[16]谭 彬,郭水欢,韩亚萍,等. 毛桃叶片愈伤组织诱导[J]. 江苏农业科学,2017,45(5):37-40.陈园媛,姚金澳,崔永一. 金线莲一次性成苗技术研究[J]. 江苏农业科学,2019,47(1):52-55.
