花生子叶节高效芽诱导体系的研究
2019-08-13冯滢王凤欢张乐鲍红帅马旭策
冯滢 王凤欢 张乐 鲍红帅 马旭策
摘 要 花生是一种重要的油料作物,培育高产、优质、抗病、耐逆新品种是促进花生增产、增效的主要手段,但较低的花生外植体再生效率严重阻碍了花生基因工程的研究。因此,建立高效的花生再生体系对于科学研究具有重要意义。试验以3份不同花生品种的子叶节作为外植体,探究不同预培养天数和不同浓度的不同植物激素对子叶节丛生芽分化的影响。结果表明:预培养5d的子叶节芽诱导情况最好。不同品种进行激素诱导培养时也有一定的差异规律:麻油1-1和弗落蔓生的子叶节外植体在MSB5+6 mg·L-1 6-BA+2 mg·L-1 2,4-D培养基中诱导芽效果最好;濮花23号的子叶节最佳诱导芽培养基是MSB5+10 mg·L-1 6-BA+2 mg·L-1 2,4-D。
关键词 花生子叶节;再生体系;植物激素
中图分类号:S565.2 文献标志码:B DOI:10.19415/j.cnki.1673-890x.2019.09.024
花生(Arachishypogaea L.)属于豆科蝶形花亚科落花生属,是一种重要的油料作物。培育高产、优质、抗病、耐逆的花生新品种是促进花生增产、增效的主要手段。中国虽通过常规育种手段育成了一大批花生新品种,促进了花生产业的发展,但在育种过程中也遇到了一些问题:育成品种的遗传基础狭窄,一些野生品种由于杂交不亲和、杂种不育等因素导致其优良性状利用困难,而生产上迫切需要具有抗虫、抗病等特殊性状的新品种,采用常规杂交育种手段很难实现[1]。
花生组织培养对于品种改良、新品种繁殖、遗传转化和种质保存等具有重要意义[2]。组织培养至今已有多年,取得了不斐的成绩,而花生各部分的再生研究也获得了较大进步,如下胚轴[3]和胚小叶[4]。随着花生组织培养研究的发展,已有不少科学研究者对于初始的组织培养的材料方法进行了更深一步的探索和方法改进。例如,Sharma和Anjaiah[5]报道了一种利用成熟子叶外植体在MS培养基[6]上添加6-BA和2,4-D培养出不定芽的有效方法。尤淑丽[7]选用外引及自选共8个花生品种胚小叶作为外植体,研究愈伤组织诱导率和不定芽分化率,结果表明,品种间愈伤组织诱导率和不定芽分化率差异显著。蒋菁等[8]以3日龄胚小叶、下胚轴和子叶节为外植体,对花生的体胚诱导做了大量研究,结果表明,胚小叶容易诱导体细胞胚,而胚轴和子叶未发现体细胞胚的形成,浓度为10 mg·L-1的2,4-D和浓度为5 mg·L-1的6-BA有利于体细胞胚分化成苗,成苗培养基中添加5~15 mg·L-1的GA3利于提高体细胞胚的成苗率。Emelie等[9]在研究影响油料作物芽再生的因素时,成功开发了一种高效的芽再生转化原球茎。Shan等[10]以華北地区常见的9个花生品种为外植体,建立了一套有效的外植体器官发生体系,可用于基因改造后的转化再生,在遗传改良工程中具有一定的应用价值。
由于豆科植物的再生难度较大且有种属特异性,研究进展较为缓慢,特别是如何建立高效、稳定、能够连续获得再生植株的体系仍需要更进一步研究[11]。本研究以3个花生栽培品种为材料,探究以子叶节为外植体的植株再生技术,分析不同预培养时间、激素组合在花生子叶节再生体系培养中的影响,从而建立花生子叶节的高效再生体系。
1 材料及方法
1.1 材料
材料为花生品种麻油1-1、弗落蔓生和濮花23号,以上品种在河北农业大学花生研究所种质资源库中均有保存。
1.2 方法
1.2.1 培养基配制
基本培养基、芽诱导培养基等参考文献[12]。基本培养基为MSB5基本培养基+30 g·L-1+7.9 g·L-1(MSB5培养基是由MS培养基的大量元素,微量元素,铁盐成分加上B5培养基有机成分而成);芽诱导培养基MSB5+6 mg·L-1 6-BA+2 mg·L-1 2,4-D,pH 5.8。
1.2.2 试验过程
选用品相好的花生种子,浸于75%酒精中1 min后,再在0.1%的HgCl2溶液中浸泡15 min,然后用无菌水漂洗4~5次,剥去种皮接种于MSB5培养基上进行种子萌发。分别各取在培养基上萌发3 d、5 d、7 d的花生无菌子叶节外植体3组,每组80个;9 d的花生无菌子叶节外植体3组,每组78个。接种到芽诱导培养基上进行诱导,30 d左右统计芽诱导情况。
将萌发5 d的无菌种子苗子叶节无上表皮一端接触培养基接种在6-BA浓度分别为2 mg·L-1、4 mg·L-1、6 mg·L-1、8 mg·L-1和10 mg·L-1,2,4-D浓度为2 mg·L-1的不同处理的芽诱导培养基上,每个处理60个外植体3次重复,培养1个月后调查丛生芽分化率。
2 结果
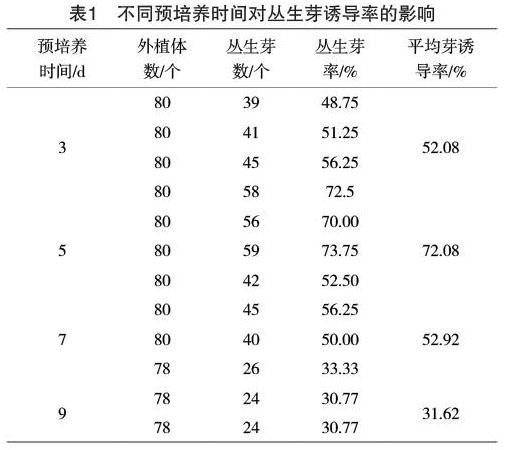
2.1 不同预培养时间对子叶节外植体诱导的影响
表1显示,在培养基上萌发3 d、5 d、7 d及9 d的子叶节都能被诱导形成丛生芽,但是芽的分化频率存在着明显差异。在所有处理中,培养5 d的无菌苗子叶节的分化频率最高、子叶节外植体的再生能力最强,分化频率为72.08%。此外,通过观察得出,培养5 d的无菌苗的子叶变大,变绿,上胚轴稍有长出,此时获得的子叶节是用于诱导丛生芽产生的较好材料。因此,在以花生子叶节为外植体进行转化试验时,选用培养5 d的无菌苗获得子叶外植体。
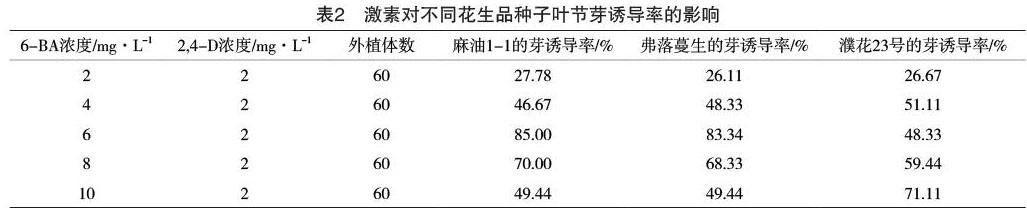
2.2 不同激素浓度子叶节芽诱导结果
同一种植物不同的基因型在外植体组织的诱导和芽分化的过程中对激素的要求不同,其中所需要的激素浓度水平取决于其内源激素的水平。所以不同品种进行激素诱导培养时有不同的差异规律。
由表2结果可知,不同浓度6-BA和2,4-D激素组合配比对三种花生品种的芽诱导率不同,其中麻油1-1诱导率最高的的组合是6-BA的浓度为6 mg·L-1,2,4-D的浓度为2 mg·L-1,芽分化率达到83.33%;弗落蔓生诱导率最高的的组合是6-BA浓度为10 mg·L-1,2,4-D浓度为2 mg·L-1,芽诱导率达到83.34%;濮花23诱导率最高的的组合是6-BA浓度为10 mg·L-1,2,4-D浓度为2 mg·L-1的诱导率为71.11%。在此基础上,6-BA的浓度过高或过低都会抑制芽的分化,可知细胞分裂素与生长素的比例是激素使用的关键,因此选用最佳的组合才能提高再生效率。
3 结论与讨论
外植体芽诱导过程即外植体先脱分化后再分化的过程,中间涉及到的植物激素是植物生长素和细胞分裂素,合适的生长素和细胞分裂素比例能够促进外植体丛生芽的诱导发生,反之,则会有抑制效果。一般而言,花生再生能力受基因型影响较大,因此找到合适的激素配比是高效再生体系建立的根本。
Tiwari V等[13]利用当地品種GG-20的去胚子叶为外植体,进行组织诱导培养,结果表明,在培养基中加入66.6 μM的6-BA的再生效果最好,再生率达到52.69%±2.32%,同时该外植体在诱导培养基20 μM 6-BA+10 μM 2,4-D中有很高的发芽率,为17.67%±3.51%。本试验所得结果与以上研究不一致,这可能与所选品种不同有关。本研究建立了麻油1-1、弗落蔓生、濮花23号的高频再生体系,利用花生子叶节为外植体,在诱导培养基中加入浓度为6 mg·L-1的6-BA、2 mg·L-1的2,4-D,丛生芽诱导率平均达70%以上。再生体系用花生子叶节为外植体,取材方便;所用的培养基为基本的MSB5培养基、激素种类少;诱导成芽只需要1个月,时间短。此外,此再生体系明显优于其它体系之处在于:花生子叶节营养丰富,诱导得到的丛生芽生长健壮,成苗快。
细胞全能性是植物活细胞具有的特性,不同基因型的物种决定了各种性状的差异。不同花生品种在组织培养的各个阶段和各个方面几乎都受到基因型的影响。芽发生频率也与花生的基因型密切相关。研究表明,不同的花生品种诱导不定芽的发生率存在明显差异。试验发现,花生品种麻油1-1和弗落蔓生的芽诱导率较高,分别为85%和83.34%;而花生品种濮花23号的芽诱导率相对于较低,为71.11%。
参考文献:
[1] 苗利娟,黄冰艳,张新友,等.花生组培再生及农杆菌介导遗传转化研究进展[J].中国农学通报,2017(32):21-26.
[2] 蒋佰福.优良玉米自交系合344的选育和应用[J].杂粮作物,2005,25(3):143-144.
[3] Dodo H W,Konan K N,Chen F C,et al.Alleviating. Peanut Allergy Using Genetic Engineering:the Silencing of the Immunodominant Allergen Ara h 2 Leads to Its Significant Reduction and a Decrease in Peanut Allergenicity[J].Plant BiotechnologyJournal,2008(6):135-145.
[4] Yang C Y,Chen S Y,Duan G C.Transgenic Peanut (Arachishypogaea L.) Expressing the Urease Subunit Bgene of Helicobacter Pylori[J].CurrMicrobiol,2011(63):387-391.
[5] Sharma K K,Anjaiah V V.An Efficient Method for the Production of Transgenic Plants of Peanut (Arachishypogaea L.) through Agrobacterium Tumefaciens-mediated Genetic Transformation[J].Plant Sci,2000(159):7-19.
[6] Murashige T,Skoog F.A Revised Medium for Rapid Growth and Bio Assays with Tobacco Tissue Cultures[J].Physiol Planta,1962(15):473-497.
[7] 尤淑丽.花生高效再生体系的建立初报[J].黑龙江农业科学,2014(3):13-15.
[8] 蒋菁,唐秀梅,熊发前,等.花生体细胞胚诱导及植株再生研究[J].中国农学通报,2012,28(3):138-142.
[9] Emelie I,Annelie A,Li X Y,et al.Development of an Efficient Regeneration and Transformation Method for the New Potential Oilseed Crop Lepidiumcampestre[J].BMC Plant Biology,2013(13):115.
[10] Lei S,Tang G Y,Xu P L,et al.High Efficiency in Vitro Plant Regeneration from Epicotyl Explants of Chinese Peanut Cultivars[J].In Vitro Cellular & Developmental Biology-Plant,2009(45):525-531.
[11] 李浚明.植物组织培养教程[M].第2版.北京:中国农业大学出版社,2002:198-204.
[12] 王凤欢,何美敬,杨鑫雷,等.花生胚小叶对卡那霉素的敏感性研究[J].花生学报,2016,45(2):15-20.
[13] Tiwari V,Chaturvedi AK,Mishra A,et al.An Efficient Method of Agrobacterium Mediated Genetic Transformation and Regeneration in Local Indian Cultivar of Groundnut (ArachishypogaeaL.) Using Grafting[J].Applied Biochemistry and Biotechnology,2015,175(1):436-453.
(责任编辑:赵中正)
