某铀水冶厂碱分解法沉淀铀加碱量计算
2019-08-13高东星刘永涛程瑞泉任志刚金凤博
高东星,刘永涛,程瑞泉,袁 征,任志刚,金凤博,李 平
(中核沽源铀业有限责任公司,河北 张家口 076561)
某铀水冶厂萃取工艺采用三脂肪胺(体积分数7.5%)+磷酸三丁酯(体积分数15%)+磺化煤油(体积分数77.5%)配制的有机相进行萃取,对萃取得到的铀饱和有机相进行水洗后,再用100 g/L Na2CO3+5 g/L NaHCO3的溶液进行反萃取[1-3]。铀反萃取合格液内含有三碳酸铀酰钠、碳酸钠、碳酸氢钠以及少量杂质。该铀水冶厂采用碱分解法沉淀铀,其工艺步骤是:将铀反萃取合格液加入沉淀槽内,在50~60 ℃搅拌条件下加入固体NaOH进行沉淀;30 min后停止搅拌让浆料沉降,约24 h后排出上部清液;然后再次加入铀反萃取合格液,进行下一循环沉淀[4-5];清液经老化后返回配制反萃取剂。由于该铀水冶厂铀沉淀工艺NaOH加量没有有效的控制方法,在工业生产中铀沉淀母液的余碱经常出现不足和过高的现象。该厂铀沉淀母液余碱含量分布情况见表1。

表1 铀沉淀母液中余碱含量分布
注:表格内容根据该厂年度生产报表数据进行统计。
从表1可以看出,其工艺指标铀沉淀母液中余碱要求质量浓度为4~8 g/L,年度生产报表余碱数据达标的只占40.37%,余碱质量浓度大于12 g/L的占11.47%,余碱含量波动性较大。当余碱含量过低时会影响沉淀效率;过高时会造成NaOH损失,影响铀沉淀浆料沉降效果,增加母液返回配制反萃取剂时的NaHCO3消耗。
为提高碱分解法铀沉淀过程NaOH加量的控制,使其消耗更加稳定、合理、有效,为工业生产提供控制加量方法。针对以下2点内容展开研究:1)摸索以铀沉淀过程溶液pH作为参数控制碱量;2)根据碱分解法铀沉淀原理,对试验过程的铀合格液、母液取样分析,并记录加碱量,通过数据分析总结铀沉淀加碱量计算公式并加以验证。
1 试验原理及方法
1.1 铀沉淀原理
沉淀铀工艺的碱分解法原理[6]:在含有过剩Na2CO3和NaHCO3的碱性溶液中,六价铀以三碳酸铀酰钠(Na4[UO2(CO3)3])的形式存在;当将NaOH加入铀合格液时,首先与NaHCO3发生反应使pH上升,过量的NaOH使溶液pH大于12后,溶液中的三碳酸铀酰钠便分解生成重铀酸钠沉淀,其化学反应式为
NaHCO3+NaOH=Na2CO3+H2O
(1)

(2)
1.2 试剂及设备
1.2.1试剂及料液
氢氧化钠:工业片碱(质量分数≥99%),化学纯,北京化学试剂厂;铀反萃取合格液:取自该厂沉淀车间铀反萃取合格液储槽。
1.2.2试验设备
电热恒温水浴锅:型号HH-S6,新宝仪器;机械搅拌器:型号JB50-S,上海梅颖浦仪器仪表;pH计:型号PHS-3C,上海雷磁;烧杯:5 L,蜀牛玻璃仪器有限公司;秒表:型号YS-801,深圳市弈圣科技有限公司;量筒:1 L,蜀牛玻璃仪器有限公司;温度计:0~100 ℃,玻璃酒精温度计,北京中西远大科技有限公司;碱性精密试纸:pH 9.5~13,上海三爱思试剂有限公司。
1.3 试验方法
取一定量铀合格液加入烧杯内,并放于水浴锅中,待温度升到50 ℃后,在搅拌状态下分多次间断性加入片碱,每次加入片碱并测量pH的变化,等待10 min,使片碱完全溶解、pH稳定后取样;然后再加入适量片碱继续搅拌,取样过滤分析母液内铀质量浓度。为了降低取样对试验结果产生的影响,试验的铀合格液初始体积为5 L。
2 试验结果与讨论
2.1 pH作为加碱量控制参数
2.1.1铀沉淀过程pH与溶液铀浓度关系
取3份不同批次的铀合格液进行沉淀,pH与母液铀浓度变化关系见表2。

表2 不同pH条件下母液中铀质量浓度
从表2可看出:试验过程中随片碱加入量增加,pH逐渐升高;母液中铀浓度在pH<11前降低幅度较小,在pH>11之后降低较快,反应生成了大量的重铀酸钠沉淀;在pH达到13时基本沉淀完全,沉淀母液中铀质量浓度可以达到0.05 g/L以下。
2.1.2铀沉淀过程pH与加碱量关系
以上述试验方法为基础,另做加碱量与母液pH关系试验,试验过程不取样,记录加入碱量及相应pH变化,分析以pH作铀沉淀控制参数的可行性,结果如图1所示。

图1 加碱量与母液pH变化
由图1可看出:1)随加碱量增加,母液pH增加先快后慢,加碱量与母液pH关系呈非线性变化;2)当接近铀沉淀pH终点时,需要加入相对较多的片碱来改变pH的变化。因此,通过铀沉淀母液pH的控制无法达到余碱含量稳定的目的。虽然通过pH参数可以控制铀沉淀基本完全,确保母液铀浓度较低;但在生产条件下pH的监测对仪表要求较高。另外,铀合格液中碳酸钠、碳酸氢钠、三碳酸铀酰钠的含量不同也会使加碱量与母液pH发生不同的变化。综上所述,通过铀沉淀母液pH的控制难以实现余碱含量的稳定,但可以作为反应终点预判的一种手段。
2.2 铀沉淀加碱量公式的探讨
2.2.1试验数据与分析
取生产现场铀合格液样品进行试验,对铀沉淀试验过程中所取的母液样品进行U、NaHCO3、Na2CO3、NaOH质量浓度的分析,试验结果见表3。

表3 不同加碱量下铀沉淀反应分析结果
注:加碱质量为0.00 g/L时,对应的溶液数据是初始铀合格液的分析结果;游离碳是溶液中碳酸根与碳酸氢根浓度之和。
从表3可看出:当铀合格液加碱15.89 g/L时,铀沉淀反应较完全,沉淀母液中铀质量浓度为0.05 g/L,NaHCO3和NaOH质量浓度均为0.00 g/L;继续加入NaOH,母液中余碱浓度会随之增加,且Na2CO3的浓度趋于稳定。
根据铀沉淀工艺化学反应式,可得出加碱计算公式为
(3)
式中:m—加入碱质量,g;ρ(U)—铀合格液中U的质量浓度,g/L;ρ(NaHCO3)—铀合格液中NaHCO3的质量浓度,g/L;V—加入铀合格液的体积,L。
式(3)计算的结果恰好是化学反应式(1)、(2)反应完全的NaOH理论加入值,即沉淀母液中NaHCO3和余碱NaOH质量浓度均为0.00 g/L,且铀质量浓度小于0.05 g/L时的加碱量。现通过(3)式对表3内试验数据进行计算,以验证式(3)对该铀沉淀工艺加碱量计算的适用情况。公式(3)涉及2个分析数据,即合格液中铀质量浓度(16.07 g/L)及NaHCO3质量浓度(51.44 g/L),计算得到的铀合格液中,理论上片碱加入量为32.60 g/L,而实际加碱量为15.89 g/L,相差较大。分析原因是铀合格液中铀质量浓度或NaHCO3质量浓度在化学分析方法上存在问题。
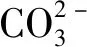
2.2.2铀合格液中混合碱的分析方法
中和滴定法用盐酸滴定,用酚酞及甲基橙作指示剂,其化学反应式为

(4)

(5)
反应(4)用酚酞作指示剂,变色的pH为8.4;反应(5)用甲基橙作指示剂,变色的pH为3.9。
[UO2(CO3)3]4-在pH为6~13内处于稳定状态[7],因此,该水冶厂铀合格液在滴定NaHCO3浓度甲基橙变色时,[UO2(CO3)3]4-中和了HCl,其化学反应式为

(6)
这使得NaHCO3浓度测定值较真值高,通过铀合格液中铀浓度修正NaHCO3浓度的测定值,得到式(7)为
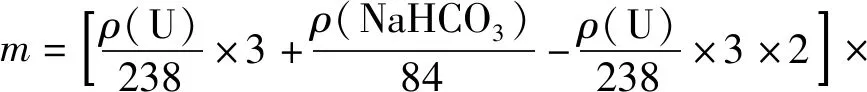
(7)
上式整理为
(8)
式中:m—加入碱质量,g;ρ(U)—铀合格液中U的质量浓度,g/L;ρ(NaHCO3)—铀合格液中NaHCO3的质量浓度,g/L;V—加入铀合格液的体积,L。
在加碱质量计算时,NaHCO3质量浓度仍采用原方法分析值,通过对公式的间接修正可以得到较准确的加碱量。
3 验证试验
试验所用铀合格液为生产线上5份不同批次的样品,片碱加入质量是通过式(8)及合格液铀质量浓度和NaHCO3质量浓度计算得出,铀沉淀试验控制母液中余碱NaOH质量浓度为4 g/L。因此,在式(8)理论计算加碱量基础上增加质量浓度为4 g/L的NaOH控制余碱,试验结果见表4。
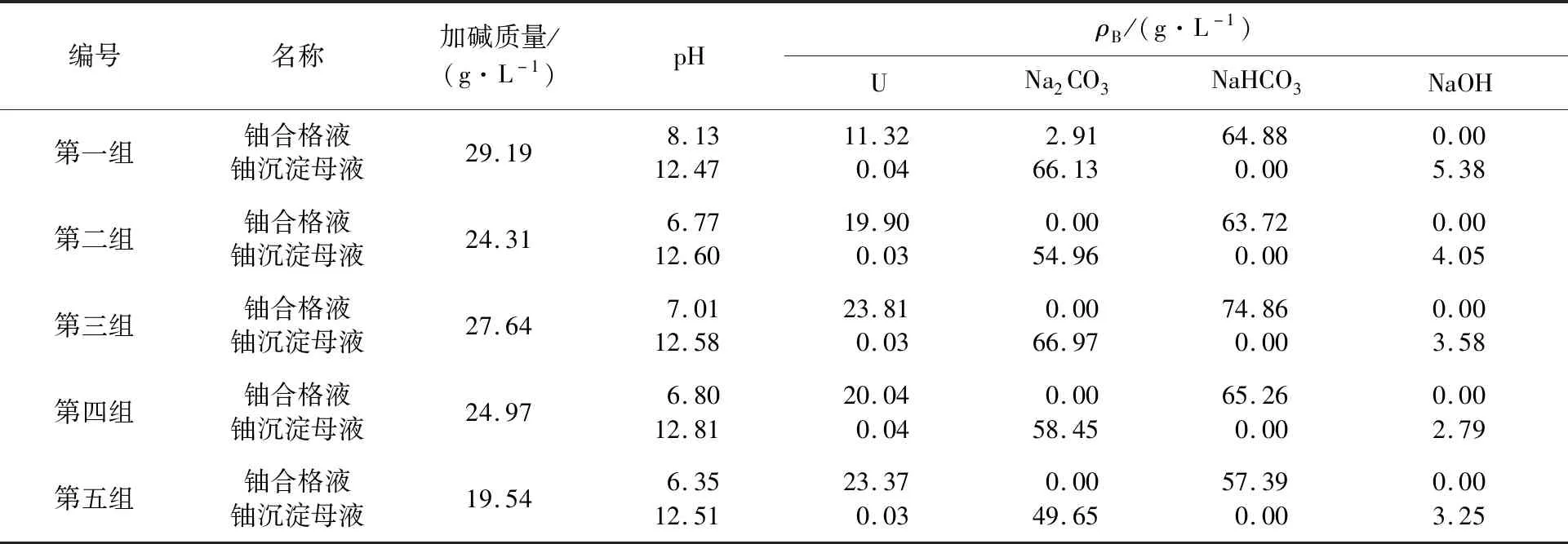
表4 加碱量公式验证试验数据
从表4可看出,铀沉淀反应按公式(8)计算的NaOH加量可以控制母液余碱NaOH质量浓度为(4.0±1.5) g/L,同时沉淀母液中铀质量浓度均小于0.05 g/L。式(8)可以满足该铀沉淀工艺加碱量的计算,沉淀母液中铀质量浓度达到工艺要求的同时又控制了余碱含量的稳定。
4 结论
1)水冶厂铀沉淀过程中,母液铀质量浓度在pH<11前降低幅度较小;在pH>11之后降低较快,反应生成了大量的重铀酸钠沉淀;在pH达到13时基本沉淀完全,沉淀母液铀质量浓度可以达到0.05 g/L以下。
2)随铀沉淀加碱量增加,母液pH增加先快后慢;当接近铀沉淀pH终点时,需加入相对较大量片碱来改变pH。在生产条件下,不易精确控制母液余碱含量,监测沉淀母液pH只能作为反应终点预判的一种手段。
3)该水冶厂铀合格液内混合碱的滴定方法,主要因[UO2(CO3)3]4-在酸碱中和滴定过程中消耗盐酸标准溶液,对滴定数值产生干扰,导致NaHCO3的分析值较真实值高,可通过合格液中铀浓度对NaHCO3的分析值进行修正。
4)采用加碱量修正式计算的加碱量能够达到稳定母液余碱NaOH浓度的目的。一般工业生产上铀沉淀工艺采用循环沉淀,应用此公式进行加碱量计算时应考虑上一循环沉淀槽中剩余母液的余碱情况做适当调整。
5)在铀沉淀母液余碱NaOH质量浓度达到(4.0±1.5) g/L时,母液中铀质量浓度即可低于0.05 g/L,沉淀效率较高。合理的控制沉淀余碱NaOH含量参数,既能保证铀沉淀完全又可节约NaOH、NaHCO3的消耗。
