二甲戊灵对轮叶黑藻生理特性的影响
2019-08-10朱凌李蒙英成中芹谢立群
朱凌 李蒙英 成中芹 谢立群

摘 要:通过测定轮叶黑藻(Hydrilla verticillata)抗氧化酶(SOD和POD)活性,以及丙二醛(MDA)、脯氨酸(Pro)和可溶性蛋白含量的变化,比较了不同浓度二甲戊灵对轮叶黑藻生理特性的影响,结果表明,轮叶黑藻经0.10~2.00 mg·L-1二甲戊灵处理2 d后,体内的SOD和POD活性显著降低,但低浓度二甲戊灵对植物造成的氧化胁迫不足以引起SOD的防御机制形成,因而在短时间内SOD活性快速下降,一段时间后上升;而4.00 mg·L-1二甲戊灵处理后2 d, SOD活性下降不明显,说明高浓度二甲戊灵引起SOD的防御机制形成,诱导植物体内抗氧化酶活性升高。轮叶黑藻经4.00 mg·g-1处理后8 d,MDA含量出现了较其他试验组高的峰值;经不同浓度二甲戊灵处理后10 d,1.00 mg·g-1以上使轮叶黑藻Pro含量显著增加,2.00 mg·g-1以上使可溶性蛋白含量显著下降,说明1.00 mg·g-1以上浓度二甲戊灵即显著影响轮叶黑藻的重要生理学指标。
关键词:二甲戊灵;轮叶黑藻;生理特性
中图分类号:Q178 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2019.07.003
Abstract: The effects of different concentrations of pendimethalin on the physiological characteristics of Hydrilla verticillata were studied by measuring the activities of antioxidant enzymes (SOD and POD), the content of MDA, proline (Pro) and soluble protein. The results showed that the activity of SOD and POD in Hydrilla verticillata decreased significantly after the treatment with 0.10 to 2.00 mg·L-1 of pendimethalin for 2 days. However, the oxidative stress caused by low concentration pendimethalin on the plant was not enough to cause the formation of SOD defense mechanism, so SOD activity decreased rapidly in a short time and increased after a period of time. SOD did not decrease significantly at 2 d after treatment with 4.00 mg·L-1,this indicating that high concentration of pendimethalin caused the formation of SOD defense mechanism and induced the increase of antioxidant enzyme activity in the plant. After treatment with 4.00 mg·g-1 for 8 days, the content of MDA in the plant showed a high peak. At different concentrations for 10 days, the Pro increased significantly when the pendimethalin more than 1.00 mg·g-1. And the soluble protein notable decreased when pendimethalin above 2.00 mg·g-1. The results indicated that the concentration of pendimethalin above 1.00 mg·g-1 could significantly affect the important physiological indexes of Hydrilla verticillata.
Key words: pendimethalin; Hydrilla verticillata; physiological characteristics
為提高农作物产量,大量不同品种的农药被用于控制农业病虫害和杂草生长。根据国家统计局的数据,2007—2015年我国农药使用量逐年上升,2012年突破1 800 kg。由于喷施的农药只有少量停留在作物上发生效用,大部分进入土壤[1],随着灌溉或雨水径流汇入附近河、湖等地表水体,不但污染河、湖水体,也严重威胁河、湖水体中多种生物生存[2]。沉水植物作为河、湖等水体中重要的生物群,在增加水体溶解氧、为水生动物提供食物和生长繁殖场所、净化水体等方面发挥着必不可少的作用,是维持河、湖水体生物多样性和稳定性最基础的一环[3-4]。然而,近年来河、湖等地表水环境中沉水植物衰退情况日益严重[5],这种现象除与水体富营养化[6-8]、重金属污染[9]等因素有关外,与除草剂污染也有着密切的关系,但目前关于除草剂对沉水植物的影响程度仍缺乏广泛深入的研究报道。
本试验在实验室条件下建立良好的沉水植物生长条件,培养轮叶黑藻,以世界第三大除草剂二甲戊灵[10]作为逆境条件,探究二甲戊灵对轮叶黑藻抗氧化酶SOD和POD活性,以及丙二醛MDA、脯氨酸Pro和可溶性蛋白含量的影响,以期为农药面源污染对沉水植物的影响提供科学依据。
1 材料和方法
1.1 取樣与试验条件
试验用轮叶黑藻(Hydrilla verticillata)取样自苏州大学独墅湖校区北区池塘,该池塘属于校方物业部门管理,据了解,在取样前2个月未施二甲戊灵等除草剂。取样于2017年6月20日进行。
试验用二甲戊灵(Pendimethalin)为标准样品(纯度99.8%),购自 Sigma-Aldrich公司。试验用培养液采用1/6浓度的霍格兰氏营养液,二甲戊灵处理浓度是指二甲戊乐灵标准样品加入培养液中配置成的溶液终浓度。根据在自然条件河流中检测到的二甲戊灵除草剂的浓度范围[11],设置试验组溶液浓度为0.10,0.20,0.50,1.00,2.00,4.00 mg·L-1。将轮叶黑藻用蒸馏水冲洗净后,放入培养液中驯化培养7 d,再放入含有浓度为0.10,0.20,0.50,1.00,2.00,
4.00 mg·L-1的二甲戊灵试验组和对照组中,在培养箱培养。培养过程中,温度为20~25 ℃,光暗时间比为12 h∶12 h,照度为3 600 Lx。各处理每48 h取样测定1次;连续测定5次。
1.2 生理特性的测定方法
每48 h对轮叶黑藻植株取样。各样品用蒸馏水洗净后用吸水纸吸干,称取0.5 g,加入少量50 mmol·L-1磷酸缓冲液(pH值=7.0)在冰浴中研磨成匀浆,再定容至5 mL后转移至离心管,2 000 rpm离心15 min取上清液, 4 ℃冷藏备用,重复3次。
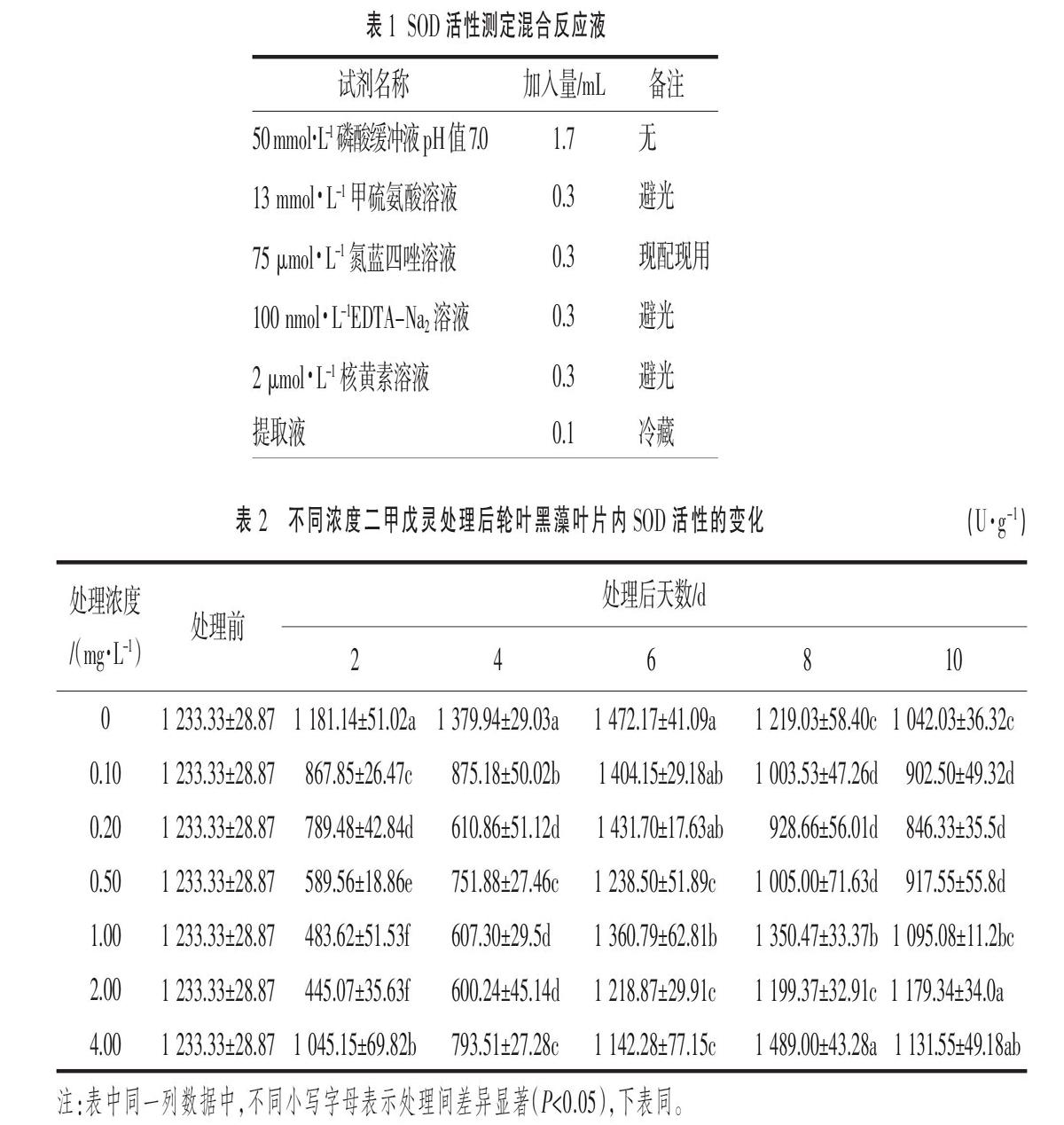
SOD活性采用氮蓝四唑(NBT)光化还原法测定,POD活性采用愈创木酚法测定,MDA含量采用硫代巴比妥酸(TBA)比色法测定,上述3种试验方法参照李合生[12]方法进行,SOD活性测定反应液略有改进,采用的混合反应液见表1。Pro含量的测定,采用磺基水杨酸提取,茚三酮比色法进行[13]。可溶性蛋白含量的测定,以1 mg·mL-1牛血清蛋白作为标准溶液,采用考马斯亮蓝染料结合法[14]测定。
对试验组与对照组的SOD和POD活性、MDA、Pro和可溶性蛋白含量的平均数进行新复极差多重比较分析;使用Microsoft Excel软件进行统计分析及绘图。
2 结果与分析
2.1 不同浓度二甲戊灵对轮叶黑藻SOD和POD活性的影响
处理前,轮叶黑藻叶片内SOD值为(1 233.33±28.87) U·g-1,处理后2 d,各试验组中SOD活性见表2,随二甲戊灵浓度从0.10 mg·L-1增加至2.00 mg·L-1,SOD活性相逐步降低,但浓度为4.00 mg·L-1时,SOD活性比其他试验组高;处理后4 d,4.00 mg·L-1浓度条件下SOD活性出现较大幅度下降,相比处理后2 d下降了24.08%;
而POD值,处理前为(8.78±1.67)(U·g-1),处理后POD均呈上升趋势(表3),处理后2 d,0.1~2.00 mg·L-1浓度条件下,POD活性与对照组之间差异显著,但是4.00 mg·L-1浓度条件下,POD活性与对照组之间无显著差异,结果同SOD活性。
2.2 不同浓度二甲戊灵对轮叶黑藻MDA含量的影响
处理前,轮叶黑藻MDA含量为(16.17±2.02)(μmol·g-1),处理后变化情况见表4,对照组MDA的含量基本稳定,但轮叶黑藻经0.10~4.00 mg·L-1二甲戊灵处理后,与对照相比MDA含量总体出现增加趋势。2.00 mg·L-1和4.00 mg·L-1二甲戊灵浓度处理峰值分别达到23.84和25.99,比其他试验组的峰高。
2.3 不同浓度二甲戊灵对轮叶黑藻Pro含量的影响
轮叶黑藻经不同浓度二甲戊灵处理后10 d,低浓度处理组(0.10,0.20和0.50 mg·L-1)的脯氨酸(Pro)含量与对照组差异不显著(图1),高浓度处理组(1.00,2.00和4.00 mg·L-1)Pro含量显著高于对照组。
2.4 不同浓度二甲戊灵对轮叶黑藻可溶性蛋白含量的影响
轮叶黑藻经不同浓度二甲戊灵处理后10 d,随着二甲戊灵处理浓度的增加,轮叶黑藻中可溶性蛋白含量呈下降趋势,高浓度处理组(2.00 mg·L-1和4.00 mg·L-1)的可溶性蛋白含量有较大程度下降,与对照组之间呈显著差异。
3 结论与讨论
抗氧化酶SOD和POD是植物体中重要的保护机制基础[15-16],本试验结果表明,当轮叶黑藻在0.10~2.00 mg·L-1二甲戊灵处理时,可能该浓度范围尚未触发植物细胞合成SOD的保护机制,反而因为二甲戊灵的处理造成超氧自由基增多,影响了SOD的正常代谢,导致SOD活性降低;而4.00 mg·L-1浓度处理条件下,二甲戊灵的强烈胁迫诱使植物细胞加快合成SOD,从而该浓度条件下的SOD活性较高;但细胞合成SOD的能力是有限的,不足以将二甲戊灵作用所产生的超氧自由基清除到危害下限内,SOD活性在处理后4 d也出现下降。赵士诚等[17]在镉胁迫对植物SOD酶活影响的研究中,也发现用5 μmol·L-1镉处理植株,SOD活性大部分时间低于对照和两个高镉处理,说明低浓度镉对植物造成的轻微氧化胁迫不足以引起SOD防御机制的形成。但是需要强调的是,酶液样品的SOD活性在4 ℃保存条件下的变化仍然明显[18],故测定的试验结果的横向比较有待后续进一步研究。
MDA是膜脂过氧化物最终分解产物,积累越多表明组织的保护能力越弱[19-20];当处理二甲戊灵浓度增大到4.00 mg·L-1,可能是由于植物体内的SOD和POD的活性不能持续保持在较高的水平,导致对膜质过氧化作用加强,细胞膜遭到进一步破坏,进而出现膜质氧化产物MDA含量的升高[21]。
脯氨酸Pro是植物体内维持渗透压的重要物质之一,同时,作为植物体内的一种贮氮机制,可以防止游离氨的积累,起到对植物的保护作用[21],本试验表明,二甲戊灵在较高浓度下对Pro影响较大,这与Foolad和Jones[22]的研究吻合;可溶性蛋白含量在二甲戊灵浓度2.00 mg·L-1以上处理10 d后显著降低,同样表明植物体生长发育受到抑制的程度显著升高[23-24]。
参考文献:
[1]顾宝根, 程燕, 周军英,等. 美国农药生态风险评价技术[J]. 农药学学报, 2009, 11(3):283-290.
[2]LU H, YUAN Y, CAMPBELL E, et al. Integrated water quality, energy and economic evaluation of three bioremediation treatment systems for eutrophic water[J]. Ecological engineering, 2014, 69(4):244-254.
[3]NURMINEN L, HORPPILA J. Life form dependent impacts of macrophyte vegetation on the ratio of resuspended nutrients[J]. Water research, 2009, 43(13):3217-3226.
[4]苏彬彬. 沉水植物的研究进展[J].绿色科技, 2015(9):60-61.
[5]王华, 逄勇, 刘申宝,等. 沉水植物生长影响因子研究进展[J].生态学报, 2008, 28(8):3958-3968.
[6]王斌, 李伟. 不同N、P浓度条件下竹叶眼子菜的生理反应[J].生态学报, 2002, 22(10):1616-1621.
[7]颜昌宙, 曾阿妍, 金相灿,等. 不同浓度氨氮对轮叶黑藻的生理影响[J].生态学报, 2007, 27(3):1050-1055.
[8]SAYER C D, BURGESS A, KARI K, et al. Long-term dynamics of submerged macrophytes and algae in a small and shallow, eutrophic lake: implications for the stability of macrophyte-dominance[J]. Freshwater biology, 2010, 55(3):565-583.
[9]计汪栋, 施国新, 杨海燕,等. 铜胁迫对竹叶眼子菜叶片生理指标和超微结构的影响[J].应用生态学报, 2007, 18(12):2727-2732.
[10]华乃震. 旱田除草剂二甲戊灵的剂型、应用和市场[J].现代农药, 2015(4):1-4.
[11]SUCHARA E A. Pendimethalin in surface waters of rivers in the proximity of irrigated paddy fields by solid phase microextraction and gas chromatography[J]. International journal of environmental analytical chemistry, 2012, 92(3):313-323.
[12]李合生. 植物生理生化实验原理和技术[M].北京:高等教育出版社, 2000:60-62.
[13]邹琦. 植物生理生化实验指导[M].北京:中国农业出版社, 1995:96-97.
[14]张志良. 植物生理学实验指导[M].第二版.北京:高等教育出版社, 1990:127-128.
[15]付光明, 苏乔, 吴畏,等. 转BADH基因玉米的获得及其耐盐性[J]. 辽宁师范大学学报(自然科学版), 2006, 29(3):344-347.
[16]KALIR A, POLJAKOFFMAYBER A. Changes in activity of malate dehydrogenase, catalase, peroxidase and superoxide dismutase in leaves of Halimione portulacoides (L.) Aellen exposed to high sodium chloride concentrations[J]. Annals of botany, 1981, 47(1):75-85.
[17]趙士诚, 孙静文, 马有志,等. 镉对玉米幼苗活性氧代谢、超氧化物歧化酶和过氧化氢酶活性及其基因表达的影响[J]. 中国农业科学, 2008, 41(10):3025-3032.
[18]严万里, 陈晓明, 郭丽燕,等. 超氧化物歧化酶活性测定的影响因素研究[J]. 生物学通报, 2011, 46(3):50-53.
[19]孙国荣, 关旸, 阎秀峰. 盐胁迫对星星草幼苗保护酶系统的影响[J]. 草地学报, 2001, 9(1):34-38.
[20]王丽燕, 赵可夫. 玉米幼苗对盐胁迫的生理响应[J]. 作物学报, 2005, 31(2):264-266.
[21]郑世英, 商学芳, 王景平. 可见分光光度法测定盐胁迫下玉米幼苗抗氧化酶活性及丙二醛含量[J]. 生物技术通报, 2010(7):106-109.
[22]FOOLAD M R, JONES R A. Mapping salt-tolerance genes in tomato (Lycopersicon esculentum) using trait-based marker analysis[J]. Tagtheoretical and applied genetics, 1993, 87(1-2):184-192.
[23]APPLEBY A P. Behavior of dinitroaniline herbicides in plants[J]. Weed technology, 1989, 3(1):198-206.
[24]GILLIAM C H, EAKESD J, OLIVE J W. Herbicide use during propagation affects root initiation and development [J]. Journal of environmental horticulture, 1993, 11(4): 157-159.
