CCR5介导小鼠肝癌微环境中骨髓来源抑制性细胞的迁移
2019-08-05许雅苹郑晓辉黄黎月王玉孝
许雅苹,郑晓辉,吴 春,伊 雪,黄黎月,王玉孝*
(1.厦门医学院基础医学部 福建 厦门 361023; 2.机能与临床转化福建省高等学校重点实验室 福建 厦门 361023; 3.厦门医学院呼吸疾病研究所 福建 厦门 361023)
肿瘤微环境中免疫网络的失调是肿瘤免疫逃逸的重要原因之一。其中骨髓来源抑制性细胞(myeloid-derived suppressor cells, MDSCs)在肿瘤微环境中起重要作用[1]。MDSCs是近年来发现的一群未分化完全的骨髓来源异质性细胞,具有免疫抑制功能[2]。在小鼠中MDSCs表达CD11b和Gr1,并可分为单核细胞型Mo-MDSCs (CD11b+Ly6G+Ly6Chigh)和粒细胞型G-MDSCs (CD11b+Ly6G+Ly6Clow)[3]。MDSCs可通过活性氧(ROS)和一氧化氮(NO)的产生以及程序性死亡配体1(PD-L1)和精氨酸酶(ARG-1)的表达抑制T细胞和NK细胞的抗肿瘤功能[4],而肿瘤和基质细胞长期分泌各种炎症因子促进肿瘤病变中MDSCs的产生,募集和活化[5],因此抑制MDSCs在肿瘤部位的聚积是治疗肿瘤的一种新思路。
在肝癌患者中MDSCs大量的升高[6]。趋化因子通过与特异性跨膜G蛋白偶联的C-趋化因子受体的相互作用来调节淋巴细胞和骨髓细胞的运输。大量研究表明多种趋化因子/趋化因子受体参与MDSCs向肿瘤微环境的募集。据报道,在横纹肌肉瘤中,CXCR2缺乏可以阻止CD11b+Ly6GhiMDSC迁移至肿瘤[7],而CXCR2的缺失减弱了MDSCs向结肠粘膜和肿瘤的浸润[8]。此外,也有研究报道CXCR2配体促进PMN-MDSC向肿瘤部位的迁移[9]。CCL2与其受体CCR2,CCR4和CCR5之间的相互作用参与黑素瘤,乳腺癌和前列腺癌中Mo-MDSCs的募集。
CCR5 (C-C chemokine receptor type 5)是结合三种趋化因子的关键CCR:CCL3(MIP-1a),CCL4(MIP-1b)和CCL5(RANTES)[10]。CCR5抑制剂被证明可抑制胰腺癌[11]、前列腺癌[12]和乳腺肿瘤[13]的生长和转移。在患有结直肠癌肝转移患者中,maraviroc对CCR5的阻断诱导了肿瘤相关巨噬细胞的复极化,并获得了一定的临床进展[14]。然而,CCR5及其配体在MDSCs动员和肝癌微环境中的作用知之甚少。本文主要目的在于探索肝癌微环境中CCR5对MDSCs在肝癌微环境中迁移的影响,寻找肝癌治疗的新思路。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF级BALB/c小鼠,雄性,体重 18~22 g,2月龄。由厦门大学实验动物中心提供[SCXK(闽)2018-0003],饲养于厦门大学实验动物中心[SYXK(闽)2018-0009]。本研究由厦门医学院实验动物伦理委员会审批准,编号:20160309106,并按实验动物使用的3R原则给予人道的关怀。
1.1.2 细胞
H22小鼠肝癌细胞株由福建省慢性肝病肝癌重点实验室提供。
1.2 主要试剂与仪器
流式细胞抗体大鼠抗小鼠的APC CD11b,PE Gr-1,FITC Ly-6G,PE Ly-6C购自美国BD公司,红细胞裂解液购自Hyclone公司,MDSCs分选试剂盒购自德国美天旎(Miltenyi Biotec, Bergisch Gladbach, Germany),DiR染料购自Invigrogen,CCR5抑制剂Maraviroc购自Sigma-Aldrich。小动物活体成像检测仪(Caliper Life Sciences, Perkin Elmer, Lumina III);流式细胞仪(Beckmann Cytoflex)。
1.3 实验方法
1.3.1 细胞培养
小鼠肝癌细胞H22培养于90% RPMI 1640、10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的完全培养基中,并于37℃、5%CO2、95%相对湿度的恒温培养箱中培养。
1.3.2 脾细胞分离
取小鼠脾细胞于300目的尼龙布上,加入预冷的2 mL RPMI-1640基础培养基,用研磨棒轻轻按压研磨后收集细胞悬液,1500 r/min 4度离心5 min,去上清后用2 mL红细胞裂解液破红3 min,用预冷的2 mL RPMI-1640全培终止,离心后预冷的10 mL 0.5% FBS-PBS洗1遍。
1.3.3 MDSCs分离纯化
MDSCs分选采用美天旎小鼠MDSCs分选试剂盒。分离荷瘤小鼠脾细胞约1×108个,用buffer重悬制备成单细胞悬液。用300目细胞滤网过滤后1500 r/min,4℃ 离心10 min。去上清后,用700 μL Buffer重悬细胞,转移到1.5 mL EP管,加入70 μL FCR 抗体阻断剂(FCR blocking reagent),4℃旋转混匀孵育10 min。孵育后直接加入100 μL生物素化抗Gr-1的抗体(biotin-conjugated anti-Gr-1 antibody), 4℃旋转混匀孵育15 min;孵育完后细胞用10~20 mL buffer重悬,再次1500 r/min,4℃ 离心10 min去上清。800 μL buffer重悬细胞,加入100 μL 抗链霉素的磁珠(anti-streptavidin micobeads),4℃旋转混匀孵育15 min;孵育完后细胞用10~20 mL buffer重悬,1500 r/min,4℃ 离心10 min;离心后去上清,细胞用2 mL buffer重悬细胞过柱,此步洗脱下来的细胞即为MDSCs。
1.3.4 细胞迁移实验
分选纯化后的MDSCs接种于小室上层,5 × 105/孔,下室加入1% FBS的1640或H22的条件培养基(tumor conditional medium, TCM),CCR5抑制剂组的MDSCs在接种前用CCR5抑制剂Maraviroc 100 nmol/L预处理2 h。接种5 h后收集小室细胞计数,并加入流式抗体APC CD11b,FITC Ly-6G,PE Ly-6C对迁移下来的MDSCs亚群进行分析。
1.3.5 小鼠肝癌原位模型建立
正常BABL/c小鼠麻醉后仰卧位固定,在肝左外叶包膜下注射H22肝癌细胞悬液(5×105/25 μL),见注射部位起一个小泡,证明注射成功[13]。10 d后将小鼠处死,取小鼠脾、骨髓、肝进行流式分析。
1.3.6 小动物活体成像
成功建立肝癌原位模型的小鼠8只,随机分成两组,每组4只。对照组尾静脉注射对照的MDSCs,CCR5抑制剂组尾静脉注射100 nM Maraviroc预处理的MDSCs 3×106cells/只。24 h后小动物活体成像检测,数据分析采用Living Image Software (Caliper Life Sciences, CA)。
1.3.7 流式细胞检测
将细胞悬液制备成5×106/mL,取100 μL细胞加入相应抗体,4度避光孵育相应时间后上机检测。MDSCs检测使用抗体:APC CD11b、PE Gr-1, MDSCs亚群抗体APC CD11b、PE Ly-6C、FITC Ly-6C。
1.4 统计学方法
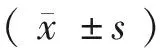
2 结果
2.1 原位肝癌模型中MDSCs的增殖
为了研究MDSCs在肝癌微环境中的增殖,我们建立了肝癌原位模型。10 d后将小鼠处死,并通过流式检测小鼠骨髓、脾、肝中MDSCs的情况。由结果可以看到,不论是骨髓、脾还是肝,与正常小鼠相比,MDSCs都显著性升高(图1)。这说明,在肝癌微环境中,MDSCs显著增加。MDSCs升高可能为肝癌的生长提供了有利的免疫微环境。

注: A:流式分析MDSCs在正常小鼠和原位肝癌模型小鼠中的情况;B:MDSCs在骨髓、脾、肝中的比例。与正常组相比,**P<0.01, *** P<0.001。图1 肝癌原位模型中MDSCs的增殖Note. A, Representative fluorescence-activated cell sorter analysis of MDSCs in the normal and hepatoma-bearing mice. B, Frequency of MDSCs in bone marrow, spleen, and liver. Compared with the normal group, **P<0.01, ***P<0.001.Figure 1 MDSCs were increased in the mouse orthotopic liver cancer model
2.2 体外肝癌细胞通过CCR5诱导MDSCs迁移
肝癌原位模型中MDSCs在肝癌的增殖可能为肝癌细胞的生长提供了有利的条件,因此研究肝癌细胞如何诱导MDSCs在肝中增殖有十分重要的意义。我们接着通过迁移实验来研究肝癌细胞诱导MDSCs迁移。我们分选了来自荷瘤小鼠脾的MDSCs,分选前荷瘤小鼠脾MDSCs的比例为14.2%,经过磁珠分选后回测MDSCs的纯度为94.5%(如图2A)。流式检测MDSCs的CCR5阳性率为85.1%(如图2B)。接着我们用分选得到的MDSCs进行迁移实验,如图2C所示,在迁移小室的下室接1640培养基或小鼠肝癌细胞H22的条件培养基(TCM),将MDSCs接种在迁移小室上面,5 h后收集下室的细胞进行计数。如图2D所示,TCM显著诱导MDSCs迁移,而经CCR5抑制剂Maraviroc处理过的MDSCs其迁移能力显著下降,这说明CCR5可能在TCM诱导MDSCs迁移的过程中起重要作用。
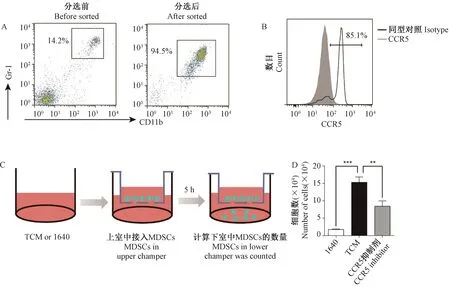
注: A:磁珠分选高纯度MDSCs;B:分选后的MDSCs表达CCR5;C:体外迁移实验模型图;D:下室中MDSCs迁移数。**P<0.01,***P<0.001。图2 体外TCM通过CCR5诱导MDSCs迁移Note. A, Purity of MDSCs was analyzed after sorting. B, CCR5 expression was analyzed by flow cytometry. C, Schema of the Transwell culture system for in vitro assay. D, Number of MDSCs in the lower chamber. **P<0.01, ***P<0.001.Figure 2 TCM-promoted MDSC migration through CCR5 in vitro
2.3 体外肝癌细胞通过CCR5诱导MDSCs亚群迁移
接着我们应用流式对迁移到下室中的MDSCs亚群进行分析。在迁移之前,即分选纯化后MDSCs亚群的比例为G-MDSCs为83.4%,而Mo-MSDCs为16.0%(如图3A)。经迁移后在1640培养基中G-MDSCs迁移的比例为98.4%,而Mo-MDSCs的比例为1.48%,这说明G-MDSCs的迁移能力比Mo-MDSCs强(如图3B)。在TCM的诱导下G-MDSCs 和Mo-MDSCs迁移数与1460组相比有显著性升高,如图3C所示,而经CCR5抑制剂处理后G-MDSCs 和Mo-MDSCs迁移数与TCM组相比也有显著性下降,说明CCR5可能在TCM诱导MDSCs亚群迁移的过程中都起重要作用。

注: A:迁移前MDSC亚群的比例;B:流式分析下室中MDSC亚群迁移情况;C:MDSC亚群迁移细胞数。**P<0.01,***P<0.001。图3 体外TCM通过CCR5诱导MDSC亚群迁移Note. A, Proportion of MDSC subsets before migration. B, Flow cytometric analysis of the subsets of MDSCs in the lower chamber. C, Number of MDSCs in the lower chamber. **P<0.01, ***P<0.001.Figure 3 TCM promoted MDSC subset migration through CCR5 in vitro
2.4 活体成像检测MDSCs在体内迁移情况
为了验证肝癌微环境中MDSCs的迁移及CCR5在肝癌微环境下对MDSCs迁移的影响,我们先建立了原位肝癌模型小鼠,并将小鼠分为两组。10 d后用DiR标记的MDSCs通过原位肝癌模型小鼠尾静脉回输到小鼠体内,24 h后通过IVIS观察MDSCs在小鼠体内迁移情况。实验组MDSCs标记前先用Maraviroc 100 nmol/L预处理。结果如图4A可见MDSCs主要定植到小鼠的肝和脾,且CCR5抑制处理的MDSCs其迁移能力变弱。我们又将小鼠的肝和脾取出,分别检测MDSCs在肝和脾的定植情况。结果显示,实验组的肝和脾内的MDSCs与对照组相比显著性降低,见图4B和4C。这说明在肝癌微环境中,CCR5对MDSCs迁移有重要作用。

注: A: MDSCs在肝癌原位小鼠体内迁移的主要部位; B:MDSCs迁移到肝中的情况;C:MDSCs迁移到脾的情况。*P<0.05。图4 活体成像检测MDSCs在体内迁移情况Note. A, Major portion of MDSC migration in mice with in situ liver cancer. B, Migration of MDSCs into the liver. C, Migration of MDSCs into the spleen. *P<0.05.Figure 4 Migration of MDSCs in vivo was detected by an in vivo imaging system
3 讨论
近年来,人们发现在多种肿瘤患者以及小鼠肿瘤模型MDSCs显著性增加。由于MDSCs能够通过不同的机制抑制T细胞和NK细胞介导的抗肿瘤免疫反应的能力,参与肿瘤免疫负调控,因此MDSCs是肿瘤微环境中重要的免疫抑制细胞[15]。目前已证实了多种炎症因子参与MDSCs扩增和迁移,比如VEGF,GM-CSF,IL6 CCL2,S100A8和S100A9等。CCL2 / CCR2,SDF-1 / CXCR4,CCL5/CCR5途径对于在乳腺癌、肺癌、卵巢癌和黑色素瘤环境中MDSCs的募集至关重要。然而,介导MDSCs募集到肝癌微环境的具体机制尚不完全清楚。
为了更好地研究MDSCs在肝癌微环境中募集的机制,我们采用了小鼠原位肝癌模型,其肝环境比皮下肿瘤模型更接近临床。我们结果显示在肝癌微环境下,MDSCs在骨髓、脾、肝中都显著性升高。有研究报道,CCR5通过与其配体趋化因子CCL5相互作用参与肿瘤生长,侵袭,血管生成和免疫细胞向肿瘤微环境的募集[16]。我们前期研究也表明了MDSCs高表达CCR5[17]。因此,我们猜想MDSC是否通过CCR5募集到肝癌微环境中。为了研究我们MDSCs在肝癌微环境中募集的机制,我们分选并获得了高纯度的MDSCs。MDSCs的分选方法有多种,我们曾经对比报道了多种MDSCs分选方法[18-19]。本文的研究需要用到较多的MDSCs,且后续用于流式及活体成像分析,因此选用磁珠分选的方法以较快地获得大量的MDSCs用于后续实验。
最近的一项研究表明,CCL2分别在胶质瘤微环境中通过CCR2募集Ly-6C+单核细胞MDSCs[20],这表明MCP-1 / CCR2在诱导Mo-MDSC迁移中起着至关重要的作用。通过体外迁移实验,我们发现抑制MDSCs的CCR5后其迁移能力显著性降低,而且其对MDSCs亚群的迁移能力也有显著抑制作用。这表明,CCR5在肝癌细胞吸引MDSCs迁移的过程中起重要作用。有趣是,据报道,由黑素瘤浸润的MDSCs产生的CCR5配体在体外和体内吸引表达CCR5的Treg[21]。此外,肿瘤分泌的这些趋化因子不仅诱导CCR5+细胞的运输,而且还上调其表面上的CCR5表达。后续我们将对肝癌细胞是否影响MDSCs的CCR5表达进一步深入研究。
由于CCR5对细胞迁移的重要性,CCR5及其配体被认为是肿瘤治疗靶标。据报道, CCR5抑制剂Maraviroc在结肠直肠癌细胞中介导细胞毒性和凋亡作用[22],减少胃癌细胞传播[23],抑制前列腺癌和乳腺癌细胞的转移[23-24]。此外,CCR5靶向诱导结肠直肠癌患者中肿瘤相关巨噬细胞的复极化[14]并抑制B16黑素瘤小鼠模型中的MDSCs活性[26]。靶向CCL5可降低乳腺癌中MDSCs的功能,从而抑制肿瘤进展[27]。我们在肝癌原位小鼠模型体内证实CCR5作为肝癌治疗靶标可能性。我们抑制MDSCs的CCR5,再将其回输到小鼠原位肝癌模型体内,发现迁移到小鼠肝及脾的MDSCs数量变少,表明其迁移能力一定程度上受损,迁移至肿瘤部位的MDSCs变少后其对肿瘤免疫逃逸的贡献也将会受到一定的影响。
综上所述,本研究表明CCR5介导MDSCs向肝癌原位模型小鼠的肿瘤和脾部位迁移,抑制MDSCs的CCR5可以减少MDSCs在肝的聚积,从而改善肝癌的微环境。
