鉴定与衰老相关的甲基化基因及筛选具有逆调控效应的物质
2019-08-05杨星九周光朋蔡海利叶志海王建铭韩晓亮
杨星九,黄 昊,马 竣,周光朋,蔡海利,叶志海,王建铭,韩晓亮*,高 苒
(1.中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021; 2.博尔诚(北京)科技有限公司,北京 102600)
衰老是指机体对环境的生理和心理适应能力进行性降低、逐渐趋向死亡的现象。病理学上,衰老是应激和劳损,损伤和感染,免疫反应衰退,营养失调,代谢障碍以及疏忽和滥用药物积累的结果,是包括癌症、糖尿病、心血管疾病和神经退行性疾病的主要危险因素[1]。寻找可靠的衰老生物标志物和延缓生理衰老的方法一直是科学家们热衷研究的领域之一。
衰老是一个缓慢而复杂的生物进程,涉及遗传学、表观遗传学等因素的作用和相互作用[2]。DNA甲基化修饰是一种表观遗传标记,是在DNA甲基化转移酶(DNA methyltransferase,DNMT)或去甲基化酶的作用下,在基因组DNA中的CpG二核苷酸的胞嘧啶5’碳位共价键结合或去除一个甲基基团。DNA甲基化修饰是能够在不改变DNA序列的前提下,改变遗传表现,进而通过基因表达调控实现多种生物过程的发生和进行,包括胚胎发育、基因组印记和衰老等[3]。多种常见疾病涉及DNA甲基化修饰异常,如癌症、心血管疾病、衰老和代谢紊乱等[4]。
DNA甲基化是一种可以在人群中定量检测的表观遗传标记。近年的研究证明了人体基因组DNA甲基化的整体水平随着年龄的增长显著下降,并且很多研究报道了特定甲基化修饰位点与实际年龄具有显著相关性[5]。Horvath和Hannum等[6-7]通过整合353和71个CpG位点建立了基于DNA甲基化的“表观遗传时钟”模型;这些CpG位点的基因与细胞存活和发育显著相关,通过检测这些位点的DNA甲基化水平,可以评估机体的衰老进程。研究发现在患有与衰老相关疾病的人群中,如阿尔茨海默病、癌症、心血管疾病和亨廷顿病,DNA甲基化年龄超过了实际年龄,此现象被定义为“年龄加速(age acceleration)”[5]。
越来越多的证据支持营养和饮食可以调控DNA甲基化修饰,进而调节健康状况和影响衰老进程。Hannum等[8]运用71个CpG位点的DNA甲基化水平建立了年龄预测模型,并通过观察性研究发现增加鱼类和蔬菜的摄入与表观遗传老化程度减弱具有相关性。Lee等[9]在近期也证明了外源补充叶酸、维生素B12和黄烷醇能够延缓女性甲基化年龄的衰老。因此,通过饮食干预逆转DNA甲基化修饰异常,从而延缓衰老进程将可能成为一个新兴的研究领域。
我们通过数据库(Pubmed, CNKI和万方数据库)检索关于DNA甲基化标志物和年龄预测的文献,根据发表文献中特定基因的DNA甲基化率与年龄的相关性,确定了两个与人体衰老进程相关的甲基化基因,分别是促泌素(secretagogin,SCGN)和整合素亚基α2b(integrin subunit alpha 2b,ITGA2B)基因。本研究进一步运用GEO数据库验证了SCGN和ITGA2B基因甲基化标志物与人体衰老进程的相关性,并基于全基因组甲基化芯片数据,筛选其中与衰老进程相关性最高的甲基化位点,从而建立了相应的甲基化qPCR检测体系。最后,我们通过独立样本的检测进一步验证其与衰老的相关性,并评估了抗衰老天然提取物中的有效物质对与衰老相关的DNA甲基化标志物甲基化水平的影响。
1 材料和方法
1.1 实验材料
1.1.1 外周血样本
53名健康志愿者参与了此项研究;其中男性30例,平均41岁(24~60岁),女性23例,平均41.4岁(27~60岁),相应性别和年龄分布见表1,年龄和性别分布无显著差异(P=0.756)。本研究的相关实验遵循福利伦理的相关规则和要求,符合涉及人的生物医学研究的伦理原则,包括知情同意原则、控制风险原则、免费和补偿原则、保护隐私原则、依法赔偿原则和特殊保护原则,所有志愿者同意此项研究并签署了知情同意书。
1.1.2 细胞
胃癌AGS细胞系和肝癌HepG2细胞系购自中国医学科学院基础医学研究所细胞资源中心。
1.1.3 文献数据库
PubMed数据库(www.ncbi.nlm.nih.gov/pubmed/),中国知网数据库(www.cnki.net/)和万方数据库(www.wanfangdata.com.cn);全基因组甲基化谱数据来源:基因表达汇编(Gene Expression Omnibus,GEO)数据库(www.ncbi.nlm.nih.gov/geo/)。
1.2 主要试剂与仪器
血细胞基因组DNA提取试剂盒和亚硫酸氢盐处理试剂盒购自博尔诚(北京)科技有限公司;细胞RMPI-1640培养基和胎牛血清购自美国Gibco公司;阿扎胞苷(5-azacytidine, 5-Aza)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)和没食子酸(gallic acid, GA)购自美国Sigma公司;CCK8试剂盒购自日本同仁化学研究所;PCR引物和探针由生工生物工程(上海)股份有限公司合成。磁珠分离架购自美国Invitrogen公司,实时定量PCR仪ABI 7500购自Life Technologies公司。
1.3 实验方法
1.3.1 筛选和验证与衰老进程相关的甲基化基因
通过数据库(Pubmed,中国知网和万方)检索关于DNA甲基化标志物和衰老相关的文献,关键词“methylation”,“biomarker”,“aging”和“甲基化”,“标志物”,“衰老”或“年龄”,根据发表文献中特定基因的DNA甲基化率与年龄的相关性,筛选出了一组候选的与衰老相关的DNA甲基化标志物。通过检索公共数据库Gene Expression Omnibus(GEO),获取涉及人体衰老进程的全基因组甲基化调控的数据,并利用这些数据通过与年龄的相关性分析对上述甲基化基因进行验证。
1.3.2 建立和验证与衰老进程相关的甲基化基因的qPCR检测方法
细胞基因组DNA提取、定量及亚硫酸氢盐处理:血液和培养的细胞均按照血细胞基因组DNA提取试剂盒(博尔诚(北京)科技有限公司)说明书步骤,提取细胞基因组DNA,使用核酸蛋白浓度分析仪测定所提取DNA的浓度和纯度。使用亚硫酸氢盐处理试剂盒(博尔诚(北京)科技有限公司)说明书对符合要求的血细胞基因组DNA进行亚硫酸氢盐转化处理、纯化;-20℃保存,48 h内使用。
1.3.3 DNA甲基化位点的选定及其对应引物、探针的合成
基于全基因组甲基化芯片数据,挑选了与人体衰老进程相关性最高的SCGN和ITGA2B基因及位点,采用Meth-Primer软件对基因序列进行分析,设计相应基因序列的引物序列及探针,建立了其甲基化qPCR检测体系。引物和探针序列由生工生物工程(上海)股份有限公司合成,序列见表2。

表1 健康志愿者性别、年龄分布资料
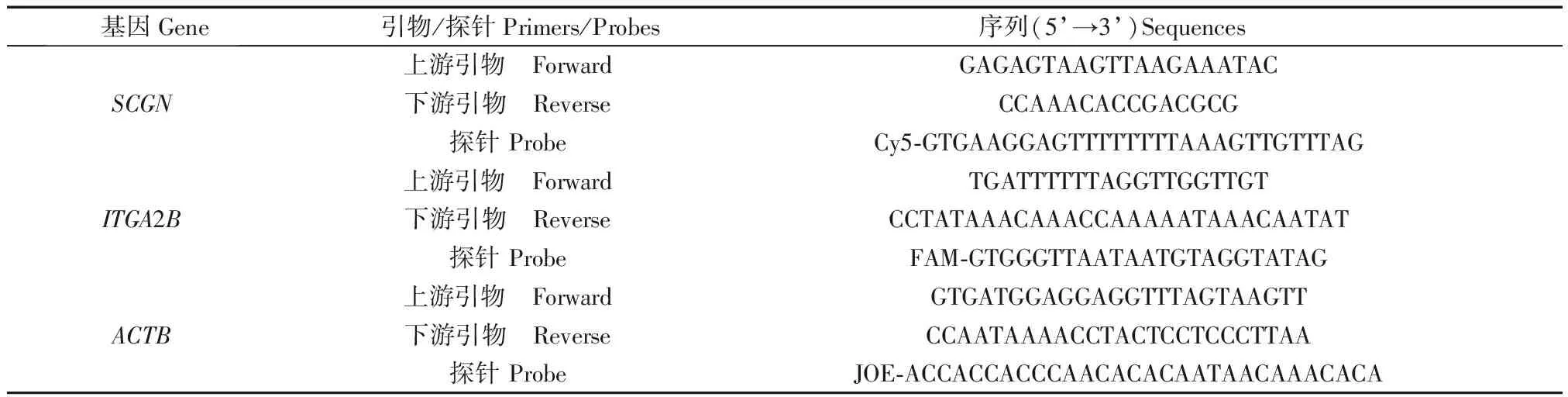
表2 引物、探针序列
1.3.4 DNA甲基化阴阳性对照实验及实时定量PCR及其结果判定
使用DNA甲基转移酶处理的白细胞基因组DNA作为目标基因靶序列甲基化状态的阳性参考品,全基因组扩增的白细胞基因组DNA作为目标基因靶序列甲基化水平的阴性参考品,ACTB(β-Actin)作为内参,进行实时定量PCR,摸索基因的引物、探针等最佳反应条件。本研究使用ABI 7500实时定量PCR仪对DNA样本进行PCR反应,50 μL体系中添加PCR反应液30 μL和DNA样本液20 μL,反应液中包含正、反向引物(0.3 μmol/L),检测探针(1 μmol/L)。以2-ΔΔCT计算基因特异位点甲基化在细胞系中相对水平,其中ΔCT(试验样品)=CT(试验样品,目的基因)—CT(试验样品,内参基因ACTB),ΔΔCT(试验样品)=ΔCT(试验样品)—ΔCT(阳性参考品)。
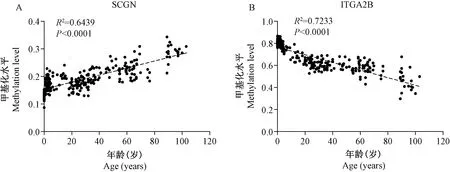
注:A:SCGN甲基化水平与年龄呈正相关;B:ITGA2B甲基化水平与年龄呈负相关。图1 SCGN和ITGA2B基因甲基化水平与年龄的相关性Note. A, Methylation level of SCGN was positively correlated with age. B, Methylation level of ITGA2B was negatively correlated with age.Figure 1 Correlation between SCGN and ITGA2B methylation levels and age
1.3.5 细胞培养
胃癌AGS细胞和肝癌HepG2细胞常规培养于DMEM完全培养液内(含10%胎牛血清),每48 h更换培养基,使用0.04%胰酶消化液消化细胞传代,对数生长期细胞进行细胞学实验。
1.3.6 细胞存活实验
对数生长期细胞1×104个接种于96孔板,3种药物按照不同浓度稀释加入培养孔,每种药物设3个复孔。培养48 h后吸弃上清,更换完全培养液(含10% CCK8),继续37℃孵箱培养3 h,振荡床轻微振荡10 s,采用自动酶标仪(Bio-Rad)检测各孔450 nm波长的吸光度。
1.4 统计学方法
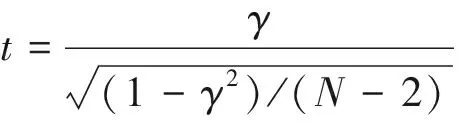
2 结果
2.1 甲基化基因特异位点的筛选及验证
通过256例人体外周血白细胞基因组DNA的全基因组甲基化芯片(Illumina公司的Human Methylation 450k芯片)数据与相应个体年龄的相关性分析,验证了候选DNA甲基化标志物促泌素(secretagogin,SCGN)和去甲基化标志物整合素亚基α2b(integrin subunit alpha 2b,ITGA2B)的甲基化率(β)与生物年龄均具有显著性相关性(图1),相关系数R2分别为0.6439和0.7233,P值均小于0.001。
2.2 甲基化阴阳性对照体系的选择
在本研究中,DNA甲基转移酶处理的白细胞基因组DNA的目标基因靶序列为完全甲基化状态,全基因组扩增的白细胞基因组DNA的目标基因靶序列为完全去甲基化状态。因此,我们使用DNA甲基转移酶处理的白细胞基因组DNA作为目标基因靶序列甲基化状态的阳性参考品,全基因组扩增的白细胞基因组DNA作为目标基因靶序列甲基化水平的阴性参考品。
经多次实验摸索条件后确定最优反应条件:94℃ 20 min;55.5℃ 35 s,93℃ 30 s,45个循环;40℃ 5 s;4℃保存。对阳性参考品的检测中,SCGN基因靶序列显示发生扩增,在45个循环内未检测到ITGA2B基因靶序列的扩增(图2A),对阴性参考品的检测中,ITGA2B基因靶序列显示发生扩增,而在45个循环内未检测到SCGN基因靶序列的扩增(图2B),说明本系统均能够特异检测到处于甲基化状态的SCGN和去甲基化状态ITGA2B基因。
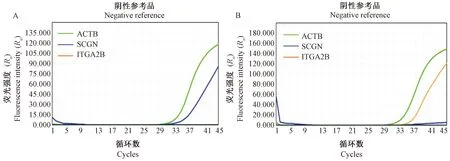
注:A:阳性参考品能特异检测到甲基化的SCGN;B:阴性参考品能特异检测到去甲基化的ITGA2B。图2 SCGN和ITGA2B检测体系的扩增曲线Note. A, Positive reference can specifically detect methylated SCGN. B, Negative reference can specifically detect demethylated ITGA2B.Figure 2 Amplification curves of the SCGN and ITGA2B detection systems
2.3 SCGN的甲基化和ITGA2B的去甲基化水平均与年龄呈线性关系
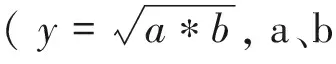
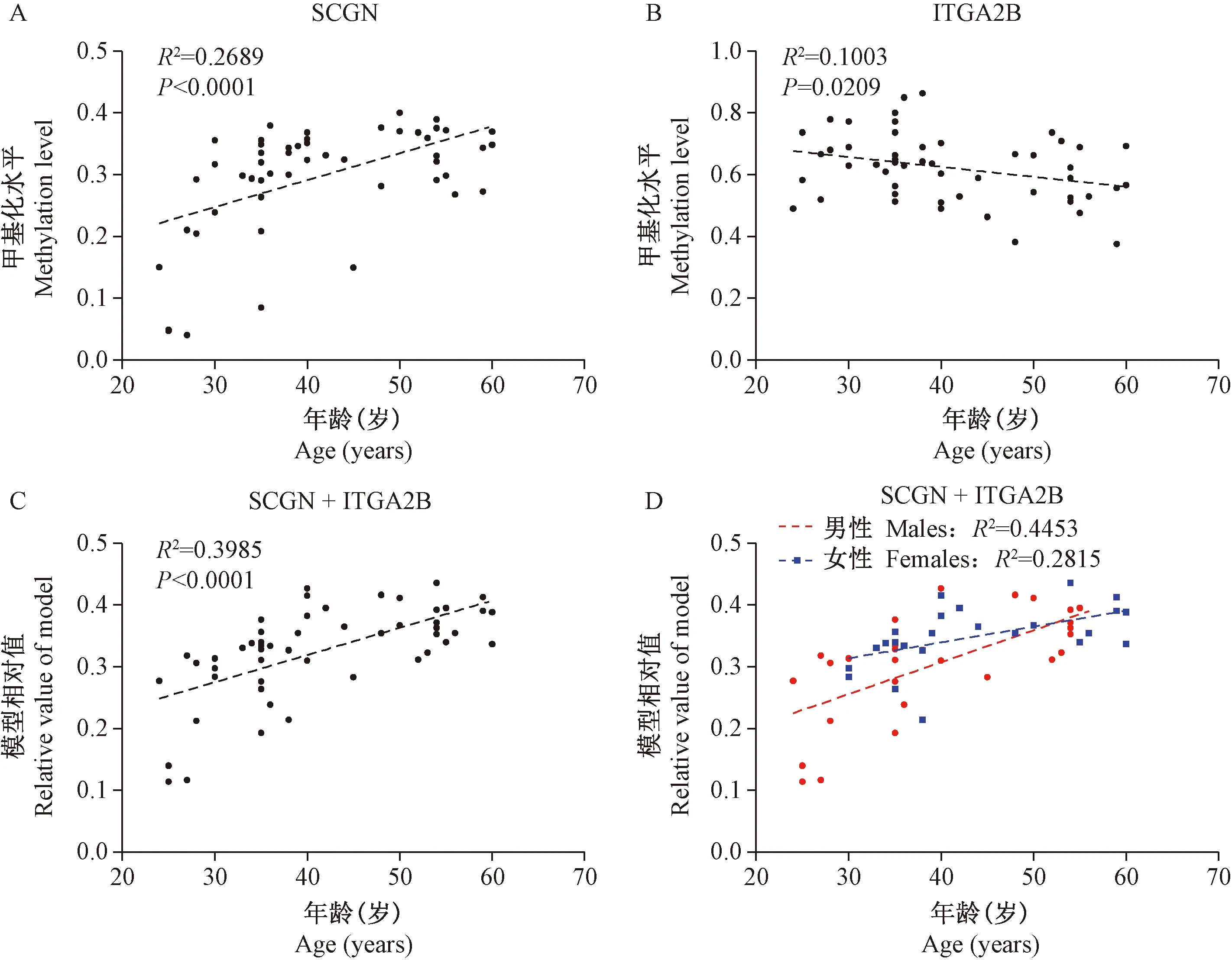
2.4 EGCG和GA抑制肿瘤细胞存活
肿瘤是衰老的一种表现,绿茶提取物的主要成分EGCG和GA已证明具有延缓衰老的功效,本研究使用EGCG和GA作用于胃癌细胞AGS和肝癌细胞HepG2,观察EGCG和GA对肿瘤细胞存活能力的影响,化疗药物5-Aza作为阳性对照。结果显示5-Aza,EGCG和GA对胃癌细胞AGS和肝癌细胞HepG2均具有显著的抑制生存作用(剂量-存活曲线,见图4),IC50分别为21.4 μmol/L、26.1 μmol/L、40 μmol/L和13.9 μmol/L、62.1 μmol/L、114.4 μmol/L。
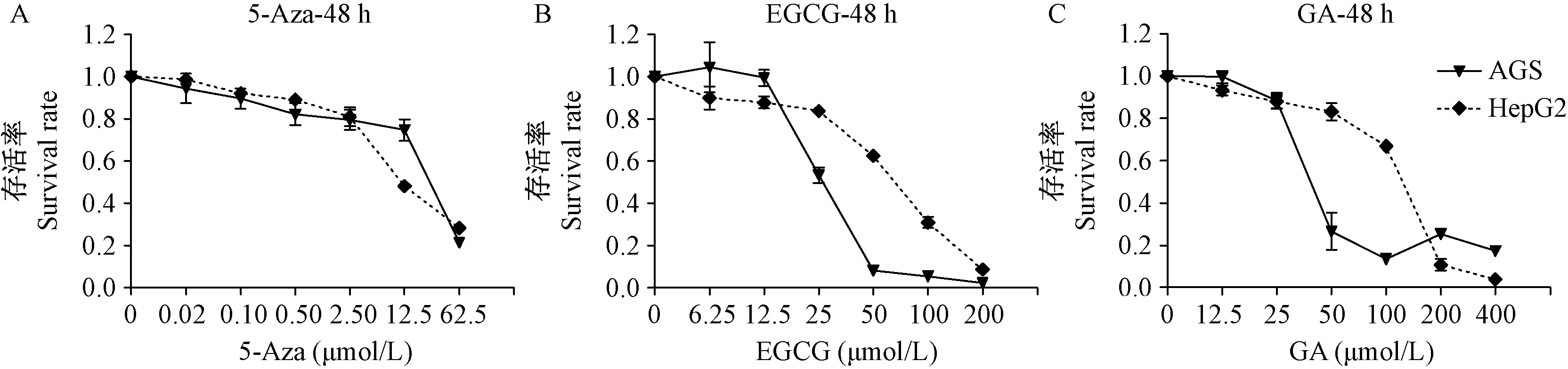
2.5 EGCG和GA逆转细胞中的SCGN的甲基化和ITGA2B的去甲基化水平
注:A:SCGN甲基化水平与年龄呈正相关;B:ITGA2B甲基化水平与年龄呈负相关;C:基于SCGN和ITGA2B甲基化水平的模型相对值与年龄呈正相关;D:男性和女性的基于SCGN和ITGA2B甲基化水平的模型相对值与年龄均呈正相关。图3 SCGN和ITGA2B基因甲基化水平与年龄的相关性Note. A, Methylation level of SCGN was positively correlated with age. B, Methylation level of ITGA2B was negatively correlated with age. C, Relative values of the model based on SCGN and ITGA2B methylation levels were positively correlated with age. D, Both relative values of the model based on SCGN and ITGA2B methylation levels of males and females were positively correlated with age.Figure 3 Correlation between SCGN and ITGA2B gene methylation level and age
注:A、B和C:分别显示5-Aza、EGCG和GA对胃癌AGS和肝癌HepG2细胞48 h的剂量—存活曲线。图4 药物对AGS和HepG2细胞的剂量—存活曲线Note. Dose-survival curves of 5-Aza (A), EGCG (B), and GA (C) for gastric cancer AGS cells and liver cancer HepG2 cells for 48 h, respectively.Figure 4 Dose-survival curves of drugs on AGS and HepG2 cells
阿扎胞苷(5-Aza)是一种胞嘧啶核苷类药物,能直接掺入DNA中,抑制DNA和RNA合成,可杀伤处于S期的细胞,其可以抑制基因组DNA的整体甲基化,无特异靶向性,本研究中使用5-Aza作为逆转DNA甲基化的阳性对照药物。绿茶提取物的主要成分EGCG和GA已证明具有延缓衰老的功效,我们使用EGCG和GA处理胃癌细胞AGS和肝癌细胞HepG2后,发现基因组DNA中SCGN基因的甲基化水平下降,ITGA2B基因的去甲基化水平下降,差异均具有统计学意义(P<0.05),而已知的广谱的DNA甲基化抑制剂5-Aza能够显著抑制SCGN的甲基化水平和增加ITGA2B的去甲基化水平(即ITGA2B的甲基化水平下降)(如图5)。以上说明EGCG和GA可能通过多靶点抑制衰老作用基因的甲基化水平(SCGN)和去甲基化水平(ITGA2B)从而逆转衰老进程,而5-Aza通过抑制基因组DNA的整体甲基化水平,更多的发挥细胞毒性作用。因此,本检测方法能够用于监测药物、营养品、或保健品对细胞、组织、或人体的抗衰老作用和功效评估。
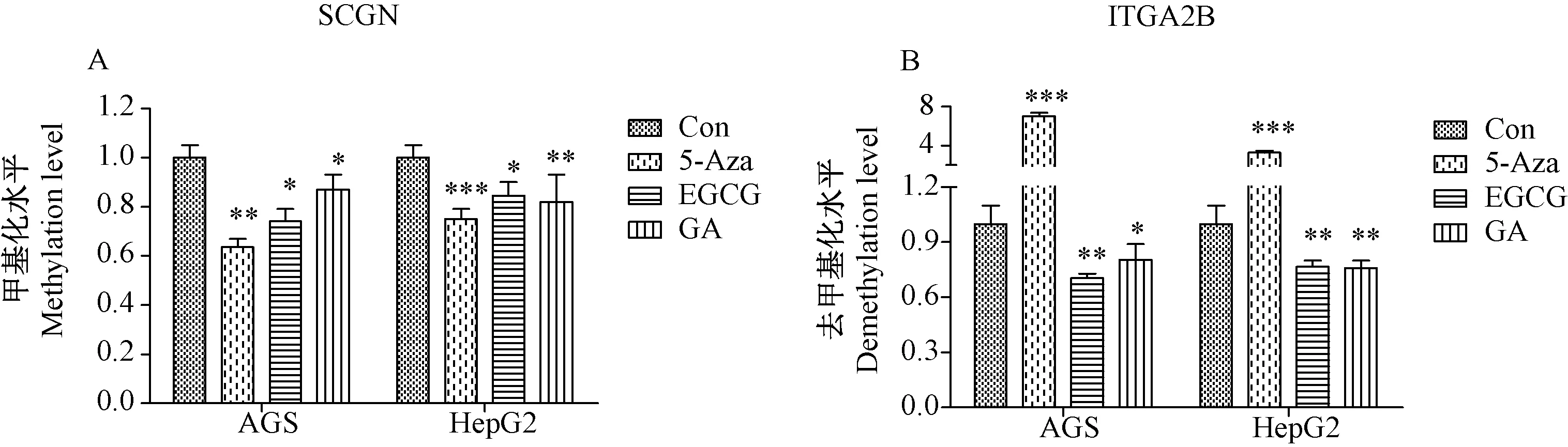
注:A:5-Aza、EGCG和GA均能下调AGS和HepG2细胞的SCGN甲基化水平;B:5-Aza上调AGS和HepG2细胞的ITGA2B的去甲基化水平(即下调甲基化),EGCG和GA显著下调ITGA2B的去甲基化。*P<0.05, ** P<0.01, *** P<0.001。 图5 药物对细胞系SCGN、ITGA2B基因甲基化水平的影响Note. A, 5-Aza, EGCG, and GA down-regulated SCGN methylation levels in AGS and HepG2 cells. B, 5-Aza up-regulated the demethylation level of ITGA2B in AGS and HepG2 cells (i.e., down-regulation of methylation), and EGCG and GA significantly down-regulated the demethylation of ITGA2B. *P<0.05, **P<0.01, ***P<0.001.Figure 5 Effect of drugs on the methylation levels of SCGN and ITGA2B genes in cell lines
3 讨论
迄今为止,DNA甲基化是在衰老研究中最为广泛研究的表观遗传机制。近年全基因组DNA甲基化测序技术的广泛应用,DNA甲基化在衰老研究领域中的研究成果快速增长。随着机体组织的衰老,基因组DNA甲基化整体水平通常会降低,但某些与特定基因相关的DNA序列在衰老过程中发生DNA甲基化水平上升[10]。随着这些研究成果的积累,表观年龄的概念被逐步建立和接受。在已建立的多种“表观遗传时钟”模型中,Horvath等建立的基于353个CpG位点的DNA甲基化预测模型被广泛使用,其年龄预测准确度为+/-3.6年[6]。Hannum等利用血细胞基因组DNA甲基化数据建立的基于71个CpG位点的年龄预测模型与年龄具有较高的相关性,预测准确度为+/-4.9年[7]。即使Horvath和Hannum的“表观遗传时钟”模型显示与实际年龄较高的相关性,但两个模型只共享了5个CpG位点[5]。Weidner等开发了一种基于血液样本的“表观遗传时钟”,其优先将数据集减少到与年龄高度相关的102个CpG位点,其中ITGA2B,ASPA和PDE4C基因上的3个CpG位点构建的预测模型显示与实际年龄具有较高的相关性,预测准确度为+/-3.3年[11]。以上位点的数据均是基于微阵列芯片研究,需要大量的DNA和复杂的生物信息学分析。因此,我们拟筛选一组与年龄相关的甲基化基因,并通过设计特异引物和探针识别和量化与单个表观遗传位点相关的CpG位点的甲基化状态,从而简化操作流程和降低检测成本。
通过文献检索分析,我们确定了一组与人体衰老进程相关的甲基化基因,运用GEO数据库对这些甲基化相关标志物进行了验证,结果发现SCGN和ITGA2B基因甲基化水平与年龄具有显著相关性。根据微阵列芯片中基因甲基化与年龄的相关性及探针位点(SCGN:cg06493994,ITGA2B:cg25809905),我们对SCGN和ITGA2B的特异位点的DNA甲基化检测建立了定量PCR检测体系。SCGN基因位于6号染色体上,编码的蛋白是一种分泌型钙结合蛋白,主要位于细胞质中,该蛋白被认为参与氯化钾刺激的钙通量和细胞增殖[12-13]。ITGA2B基因位于17号染色体上,编码的蛋白是整合素链家族成员之一,编码前原蛋白经蛋白水解生成轻链和重链,通过二硫键结合形成α-2b/β-3整合素细胞粘附受体的亚基,这种受体通过介导血小板聚集在血液凝固系统中起着至关重要的作用[14]。
在本研究中,我们使用DNA甲基转移酶处理的白细胞基因组DNA和全基因组扩增的白细胞基因组DNA分别作为目标基因靶序列甲基化状态的阳性参考品和阴性参考品,建立了SCGN和ITGA2B的特异位点的DNA甲基化检测体系。对53名志愿者血浆检测结果显示SCGN和ITGA2B基因靶序列的甲基化水平均与年龄呈显著的相关性,其与相关研究结果一致。进一步对SCGN基因靶序列的Ct值和ITGA2B基因靶序列的Ct值进行回归分析,获得回归方程,结果显示回归方程计算的几何平均值与年龄具有更显著的相关性。Horvath和Hannum的DNA甲基化表观年龄预测的检测使用甲基化芯片检测(Infinium 450K),检测费用昂贵,技术难度大,难以广泛推广。我们在本研究中通过检测SCGN的甲基化和ITGA2B的去甲基化水平,建立了一种新的DNA甲基化衰老预测模型,该模型推算的结果与生物年龄具有较好的相关性。
营养素和饮食,如叶酸、胆碱、蛋氨酸、维生素B6和B12,可以通过参与单碳代谢,促进S-腺苷-L-甲硫氨酸(SAM)(通用甲基供体)产生,增强DNA甲基化,从而实现DNA甲基化修饰的调控[15-16]。天然提取物的主要成分,如表没食子儿茶素-3-没食子酸酯(EGCG)、没食子酸(GA)、白藜芦醇、类黄酮、木黄酮和槲黄素等,可以通过抑制DNA甲基化转移酶,导致整体DNA甲基化水平下降[16]。营养素和饮食可以通过DNA甲基化的调控调节代谢、改变疾病易感性,从而维持健康及预防疾病发生[17-19]。
肿瘤是细胞衰老的表现和结果。我们使用肿瘤细胞模型对化疗药物5-Aza和天然化合物EGCG、GA进行了评估,观察化合物对细胞生长增殖能力及对SCGN和ITGA2B的甲基化水平的影响。结果显示5-Aza,EGCG和GA对胃癌细胞AGS和肝癌细胞HepG2均具有显著的抑制生长增殖作用。EGCG和GA能够逆转基因组DNA中SCGN的甲基化和ITGA2B的去甲基化,而已知的DNMT1抑制剂5-Aza能够显著抑制基因组的DNA甲基化水平,包括SCGN和ITGA2B。说明EGCG和GA可能通过多种机制调控衰老相关基因的甲基化水平(SCGN)和去甲基化水平(ITGA2B),从而逆转衰老程度。天然化合物EGCG和GA是绿茶提取物和发酵乌龙茶提取物的主要成分,已证明具有逆转DNA甲基化及延缓衰老的功效[20-22],本研究的结果与其相一致。因此,通过检测SCGN和ITGA2B的甲基化水平,可以评估机体的衰老程度,进一步可以作为评估药物、营养品或保健品对细胞、机体或人体的抗衰老作用和功效。
本研究建立的基于SCGN和ITGA2B的甲基化水平衰老预测模型,与实际年龄具有较好的相关性,但标准误差仍然较大,可能与模型建立使用的样本量太小(53例)相关。另一方面,表观遗传学的变化与机体的健康状态相关,我们猜测模型构建的样本人群的健康状态也是导致标准误差较大的主要原因之一,即模型预测值反映的是机体的健康状态,根据模型预测值推算的生物学年龄高于正常值,说明机体可能处于亚健康状态。因此,我们需要大规模收集样本,并了解样本人群的健康状态,整体评估衰老预测模型,同时评估基于SCGN和ITGA2B的甲基化水平衰老预测模型用于评估机体健康状态的可能性。
人体衰老是一个缓慢而复杂的生物进程,涉及遗传学、表观遗传学等因素的作用和相互作用。基因组甲基化调控是表观遗传学的一种重要机制。此项研究验证了文献报道的SCGN和ITGA2B基因甲基化调控与衰老进程的相关性,并建立了一种方便、便捷的甲基化qPCR检测方法及衰老预测模型。借助这一检测方法,我们筛选、验证了抗衰老天然提取物中有效成分对SCGN和ITGA2B基因甲基化调控的逆转效应。此项研究证明了与人体衰老相关的甲基化调控有可能在药物或营养物质的作用下发生逆转,并通过检测特定基因甲基化调控的变化有可能用于监测人体衰老进程,另一方面,检测特定基因甲基化调控的变化有可能用于检测人体的健康状态,这为基于基因甲基化调控机制开发抗衰老或者调节健康状态的药物或产品提供了实验证据和研发工具。
