芹菜线粒体atp6基因的克隆及在花发育过程中的表达
2019-08-03谭国飞钟秀来王天文
谭国飞, 钟秀来, 罗 庆, 王天文
(贵州省农业科学院 园艺研究所, 贵州 贵阳 550006)
芹菜(ApiumgraveolensL.)为伞形科芹属一二年生的蔬菜作物,是世界上重要的蔬菜作物之一。中国是芹菜种植大国,每年栽培面积约为55 hm2,产量约为2 000万t[1]。芹菜由于雄性不育材料的缺乏,以及芹菜育性相关的分子机制研究相对其他蔬菜较少,导致芹菜杂种优势不能较好利用[1]。同为伞形科重要蔬菜作物的胡萝卜,雄性不育材料已得到了很好的利用,育性相关分子方面的研究也有较多报道。为此,借鉴胡萝卜雄性不育材料的研究成果,对芹菜育性进行研究,可以为选育芹菜雄性不育材料提供基础。
通过对胡萝卜雄性不育性状的分子标记、线粒体测序及基因克隆等分析表明,atp6基因可能是引起胡萝卜雄性不育的原因之一[2-4]。其他植物的研究,也同样表明了atp6基因可能参与了植物雄性不育的形成,如水稻[5-6]、高粱[7]、辣椒[8]和萝卜[9]等。线粒体atp6基因是编码ATPase蛋白6的基因,与植物能量代谢相关。植物线粒体atp6基因的缺陷和突变,将导致植物能量代谢失调,尤其是在花发育过程中,很可能导致植物雄性不育。胡萝卜atp6基因在可育材料与雄性不育材料中,具有明显的差别。BACH等[2]研究表明,在胡萝卜雄性不育材料中线粒体atp6基因可阅读框为744 bp。LRIZZO等[10]公布的可育胡萝卜线粒体数据中,atp6基因可阅读框长度为1 152 bp,且为单拷贝。在2016年公布的胡萝卜基因组数据中,atp6基因为双拷贝,可阅读框长度分别为1 152 bp和744 bp[11]。笔者通过设计差异引物,对胡萝卜可育与雄性不育材料研究也表明胡萝卜存在单双拷贝的现象[4]。其中可育材料Kuroda为单拷贝,克隆的atp6基因长度为954 bp,野生可育材料Wuye存在2种atp6基因,克隆得到的长度分别为954 bp和819 bp,但Wuye中筛选到的不育材料Wuye-BY,该基因为单拷贝,克隆得到的长度为819 bp。同时还表明较长片段的atp6基因在胡萝卜花发育过程中,相对较短的atp6基因表达量变化较大,暗示着长片段的胡萝卜atp6基因可能参与了胡萝卜花的发育及与胡萝卜育性相关[4]。
目前,芹菜atp6基因拷贝未见研究报道,芹菜花发育过程中的表达情况也尚未见研究报道。因此,笔者利用2种可育芹菜六合黄心芹(Q1)和津南实芹(Q2)为研究材料,对2种可育芹菜atp6基因进行克隆与分析。在芹菜atp6基因克隆和序列测定的基础上,设计荧光定量检测引物,对芹菜花发育过程中atp6基因表达水平进行检测。通过对芹菜atp6基因与胡萝卜atp6基因的比较研究,为培育芹菜雄性不育材料提供分子基础。
1 材料与方法
1.1 植物材料
六合黄心芹(Q1)和津南实芹(Q2)均为南京农业大学伞形科蔬菜作物遗传与种质创新实验室提纯和保存。
1.2 培育条件
将2种芹菜种子分别播种于营养钵(20 cm× 40 cm× 50 cm)中,培养土为有机质∶蛭石=3∶1。于人工气候室中种植和培养,温度为25℃光照/20℃黑暗,光周期为12 h光照/12 h黑暗,光密度为300 μmol/(m2· s)。5叶期时,分别选取2种芹菜幼嫩的叶片,保存于-80℃冰箱中,用于芹菜线粒体DNA的提取。
当植株长至12叶期时,将芹菜移到实验大棚中,让其低温春化。花期时,分别取不同发育时期的花,用锡箔纸包好后于液氮中速冻,保存于-80℃冰箱中,用于提取植物总RNA。
1.3 芹菜线粒体DNA(mtDNA)的提取及鉴定
按照SCOTTI等[12]的方法制备芹菜mtDNA。将2 g的新鲜芹菜叶片放入加有液氮的研磨中,将其磨成粉末。粉末放入20 mL预冷的匀浆缓冲中[100 mmol/L Tris-HCl(pH 8.0),2.6 mol/L NaCl,50 mmol/L乙二胺四乙酸(EDTA,pH 8.0),0.4% BSA,在使用前加入0.1%半胱氨酸和56 mmol/L的β-巯基乙醇],在200 r/min搅拌机中,均匀搅拌20 min。然后,将混合好的匀浆通过尼龙过滤器(100 um),334 r/min(4℃)离心(eppendorf 5810 R台式高速冷冻离心机,转子型号:1.5/2.0 mL×30固定角转),去除较大的植物细胞。
上清液1 734 r/min(4℃)分别离心15 min和10 min,去除质体;随后在9 667 r/min(4℃)离心15 min,去除裂解核成分;20 mL冷匀浆缓冲液中再悬浮,9 667 r/min(4℃)离心15 min;使用0.5 mL裂解缓冲液[25 mmol/LTris-HCl(pH 8.0),20 mmol/L EDTA(pH 8.0),0.5 % SDS]溶解,蛋白K酶增加到最终浓度为50 μg/mL;然后37℃摇床中轻轻摇动1 h。加入0.1倍体积的2 mol/L醋酸铵,mtDNA与TE(10 mmol/LTris-HCl(pH 8.0),1 mmol/L EDTA饱和酚/氯仿(50∶50)等体积;mtDNA在2倍体积的100%乙醇沉淀,20℃过夜(14 h)孵育,12 000 r/min离心20 min;最后mtDNA使用30 μL灭菌的ddH2O溶解。
提取的mtDNA用1.2%(v/v)的琼脂糖凝胶电泳检测完整性,使用微量分光光度计Nanodrop ND-1000 spectrophotometer(Nanodrop Technologies Inc.,DE,USA)测量提取的浓度。使用公布的芹菜内参基因引物(正向为5′-CTTCCTGCCATATATGATTGG-3′,反向为5′-GCCAGCACCTCGATCTTCATG -3′)[13],检测提取的mtDNA是否含有基因组DNA。对提取的芹菜mtDNA进行PCR检查,程序为94℃预变性5 min;95℃变性30 min,54℃退火30 s,72℃延伸1.5 min,35个循环;72℃延伸10 min后,4℃保存。PCR产物于凝胶电泳上未发现目的片段,表明提取的mtDNA不含或含有的基因组DNA较低,达到试验要求。提取的芹菜mtDNA保存于-20℃冰箱中,用于芹菜atp6基因的克隆。
1.4 芹菜atp6基因的克隆与鉴定
利用对胡萝卜atp6基因的克隆引物(atp6-F1、atp6-F2和atp6-R)[4],进行芹菜atp6基因的克隆。引物序列atp6-F1:5′-ATGGTTAACAGAAGTCCCGACGA-3′;atp6-F2:5′-ATGAAATTAAAAGTTTTTCTTACGATTAC-3′;atp6-R:5′-TCAATTATAAATAACCACTTCACTTTG-3′。其中,atp6-F1+atp6-R和atp6-F2+atp6-R在胡萝卜中分别能克隆954 bp和819 bp的基因片段。
PCR采用PCR聚合酶ExTaq(TaKaRa,大连)对目的片段进行克隆。克隆程序为94℃预变性4 min;然后按照94℃变性30 s,55℃退火30 s,72℃延伸1 min,32个循环;72℃延伸10 min,4℃保存。PCR产物经过1.2%琼脂糖凝胶电泳鉴定正确后,使用Axygen胶回收试剂盒进行目的片段的回收。回收产物连接到pMD19-T载体(TaKaRa,大连)上,使用42℃热激的方法,将构建的克隆载体转化到大肠杆菌DH5α。将菌液PCR正确的单菌落,委托通用生物系统有限公司(滁州)测序。
1.5 芹菜atp6进化分析
将克隆得到的芹菜atp6基因,查找可翻译的阅读框,并推导成对应的氨基酸序列。获得的芹菜atp6氨基酸序列与胡萝卜atp6氨基酸序列进行进化分析。使用MEGA6软件的邻接方法(Neighbor Joining,NJ)法构建系统进化树,Bootstrap检验值设为1 000[14]。
1.6 芹菜总RNA的提取与cDNA的合成
分别选取2种芹菜未开放(设为0 d)、开放(设为5 d)和凋谢(设为10 d)的花,用锡纸包裹后及时放入液氮中速冻,于-80℃超低温冰箱中保存。采集的花,使用液氮将其磨成细小的粉末,采用总RNA提取试剂盒(Tiangen,北京)提取总RNA。提取的植物总RNA,分别使用1.2%琼脂糖凝胶检测总RNA的完整性,以及使用微量分光光度计Nanodrop ND-100(Nanodrop Technologies Inc.,DE,USA)检测总RNA的浓度。最后,提取的总RNA使用反转录试剂盒PrimeScript RT Reagent Kit with a DNA Eraser Kit(Perfect Real-Time)(TaKaRa,大连)反转录成cDNA。反转录的cDNA用灭菌的ddH2O稀释15倍后,于-20℃冰箱保存,用于荧光定量PCR分析。
1.7 荧光定量PCR分析
根据芹菜atp6基因克隆测序结果,设计荧光定量引物。正向引物分别采用atp6-F1和atp6-F2,反向引物序列为5′-GAGAGTGAGTAGCATAAACAAAGAGG-3′。采用SYBR PremixExTaq试剂盒(TaKaRa,大连)进行荧光定量PCR。荧光定量PCR为20 μL体系,其中SYBR Premix Ex Taq10 μL,正向/反向引物各0.5 μL,稀释的模板:2 μL,灭菌的ddH2O 7 μL。使用iQ5 software和iQ5 Real-time PCR System完成荧光定量PCR。以芹菜ACTIN为内参基因(正向为5′-CTTCCTGC CATATATGATTGG-3′,反向为5′-GCCAGCAC CTCGATCTTCATG -3′),与目的基因一起扩增[13]。荧光定量PCR程序:95℃预变性30 s;95℃变性5 s,60℃退火30 s,65℃延伸10 s,40个循环;72℃延伸2 min,4℃保存。相对定量,使用参照基因ΔCT法,表达差异等于2-ΔCT,ΔCT=CT目标基因-CT actin。相对定量是基于处理和对照之间,目标基因对参考基因的表达量的比较[15]。
1.8 数据分析
使用Microsoft Excel 2007进行定量数据和物质含量显著性分析。
2 结果与分析
2.1 芹菜atp6基因的分离
胡萝卜atp6基因不含内含子[4, 10-11],芹菜atp6基因可能也不含内含子。为此,使用芹菜mtDNA作为模板克隆芹菜atp6基因。结果显示,atp6-F1+atp6-R克隆到的2个芹菜品种atp6基因片段较长(图1,泳道1~2),与胡萝卜954 bp的atp6基因片段长度一致(图1,泳道3)。atp6-F2+atp6-R克隆到的2个芹菜品种atp6基因长度较短(图1,泳道4~5),与胡萝卜819 bp的atp6基因片段长度一致(图1,泳道6)。
经基因测序表明,芹菜中atp6基因不含内含子。其中,atp6-F1+atp6-R克隆到的长片段atp6基因(分别为Q1-L和Q2-L),长度均为954 bp(图2)。atp6-F1+atp6-R克隆到的长片段atp6基因(分别为Q1-D和Q2-D),长度均为819 bp(图2),参照公布的胡萝卜atp6基因序列(AY007817和AY007824),该长度的atp6基因可阅读框为744 bp。

注:M,标准分子量;1~2,引物atp6-F1+atp6-R;4~5,引物atp6-F1+atp6-R;1和4,六合黄心芹;2和5,津南实芹;3和6,胡萝卜2种不同长度的atp6基因长度分别为954和819 bp
Note: M was marker. 1~2, using the primers atp6-F1+atp6-R;4~5, using the primers atp6-F1+atp6-R;1 and 4, Liuhe Huangxin Qin;2 and 5, Jinnan Shiqin;3 and 6, two different lengths of atp6 gene was 954 bp and 819 bp,respectively.
图1六合黄心芹和津南实芹atp6基因克隆
Fig.1 PCR amplificationatp6 gene from Liuhe Huangxin Qin and Jinnan Shiqin

注:引物atp6-F1用下划线标注,atp6-F2用方框标注,atp6-R用点标注;箭头标注为Q1-D和Q2-D参考胡萝卜atp6基因(登录号为AY007817.1和AY007824.1)的ORF框起始。
Note: The primers of atp6-F1,atp6-F2and atp6-R were marked by underline, box and dot, respectively. The ORF start of Q1-D and Q2-D were marked by arrow base on carrot’satp6 gene (GenBank:AY007817.1 and AY007824.1).
图2六合黄心芹和津南实芹线粒体mtDNA克隆的atp6基因
Fig.2 Nucleotide acid sequence alignment ofatp6 genes sequences that cloned from the mtDNA of Liuhe Huangxin Qin and Jinnan Shiqin
2.2 芹菜atp6基因编码的氨基酸序列
经克隆得到芹菜atp6基因推导的氨基酸序列,与TAN等[4]对胡萝卜atp6氨基酸序列(Wuye-D、Wuye-BY、Kuroda和Wuye-L,其中Wuye-D和Wuye-BY为较短片段,Kuroda和Wuye-L为较长片段,Wuye-BY为野生胡萝卜雄性不育材料中克隆得到)进行比对显示,较短的芹菜atp6氨基酸序列(Q1-D和Q2-D)与胡萝卜较短的atp6氨基酸序列(Wuye-D和Wuye-BY)长度一致;芹菜较长的atp6氨基酸序列(Q1-L和Q2-L)与胡萝卜较长的atp6氨基酸序列(Kuroda和Wuye-L)长度一致(图3)。同时,2个品种芹菜atp6氨基酸序列(Q1-D、Q2-D、Q1-L和Q2-L)与胡萝卜atp6氨基酸序列(Wuye-D、Wuye-BY、Kuroda和Wuye-L),在3′端高度保守。

图3 六合黄心芹和津南实芹atp6基因推导的氨基酸序列
2.3 芹菜atp6系统进化树
经对芹菜atp6基因推导的氨基酸序列与胡萝卜atp6氨基酸进行进化分析表明,2个芹菜品种长片段atp6基因推导的氨基酸(Q1-L和Q2-L)在进化树上均属于同一分枝(图4)。2个芹菜品种短片段atp6基因推导的氨基酸序列(Q1-D和Q2-D),进化存在一定的距离。进一步分析表明,2种芹菜长片段atp6(Q1-L和Q2-L)与胡萝卜雄性不育品种atp6基因推导的氨基酸(Wuye-BY、AY007817和AY007824)及可育野生种胡萝卜材料较短的atp6基因推导的氨基酸(Wuye-D),进化距离较近;较短的芹菜atp6与可育胡萝卜品种atp6基因推导的氨基酸序列(JQ248474.1、Wuye-L和Kuroda)进化距离较近。表明胡萝卜atp6与芹菜atp6之间,可能存在类似的进化关系。胡萝卜段片段的atp6可能于胡萝卜导致胡萝卜雄性不育,而长片段atp6可能是可育胡萝卜的特征,暗示着芹菜长片段atp6基因的表达于花发育相关。
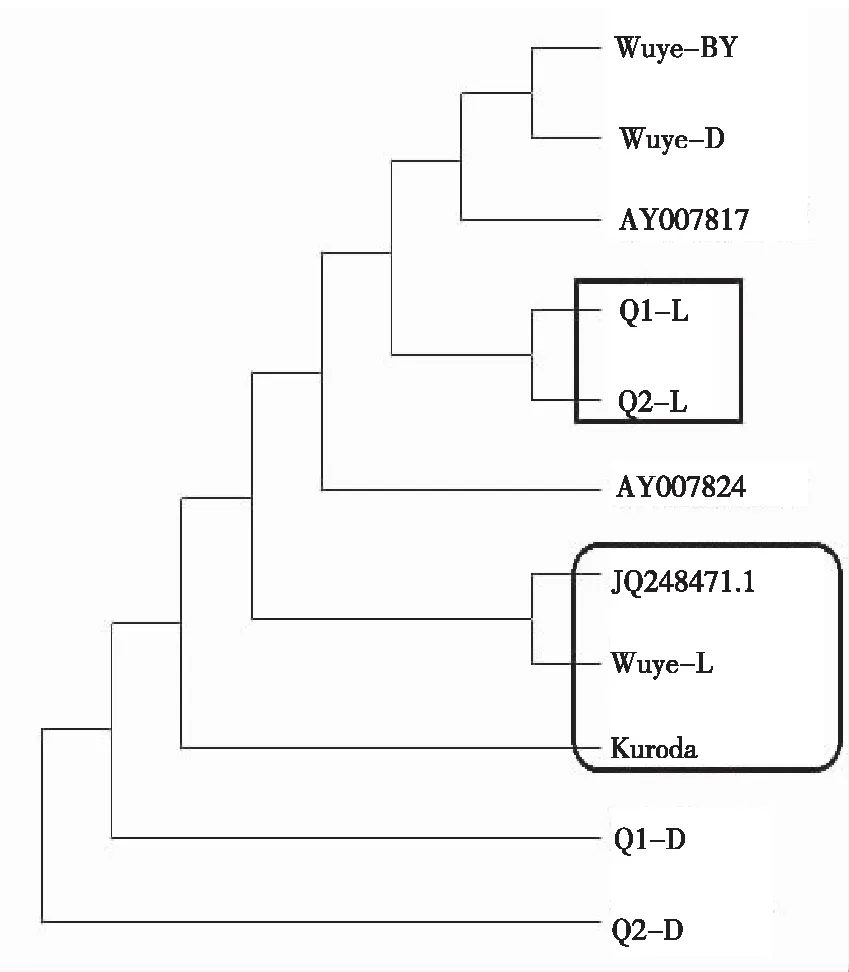
注(Note):Bootstrap was 1000.
图4芹菜及胡萝卜atp6氨基酸的系统进化树
Fig.4 System phylogenetic tree ofatp6 amino acid sequences between celery and carrot
2.4 芹菜atp6基因在花发育过程中的表达
分别于芹菜花未开期(0 d,表达量设为1)、花盛开期(5 d)和花凋谢期(10 d,图5A),使用荧光定量PCR对芹菜花发育的3个阶段,进行atp6基因表达量的检测。结果表明,六合黄心芹(Q1)和津南实芹(Q2)较长片段的atp6基因(Q1-L和Q2-L)表达量在花盛开期表达量最高,其次为花凋谢期,最低为花未开期;而六合黄心芹(Q1)和津南实芹(Q2)较短片段的atp6基因表达量在芹菜花发育过程中变化较小(图5B)。说明,芹菜较长atp6基因片段,可能与芹菜花发育相关。

注:A为津南实芹形态,B为芹菜花atp6基因表达水平。图B中同一品种的同长短中不同大小写字母分别表示表示在芹菜发育过程中有极显著性(P<0.01)和显著性(P<0.05)。
Note:A was the morphology of Jinnan Shiqin and B was the expression level ofatp6 gene in celery flower. In the figure B,the different capital and lower case letters of the same length in the same variety represent extremely significant (P< 0.01) and significant (P< 0.05) during the development of celery.
图5不同发育阶段芹菜的花形态及atp6基因表达水平
Fig.5 Different stages of floral development and expression levels ofatp6 gene in celery flowers
3 结论与讨论
伞形科蔬菜如胡萝卜、芫荽和芹菜等,普遍有花较小、花两性及花发育不一致等特点,严重制约了伞形科蔬菜杂交种的利用和研究进程[16-17]。目前,胡萝卜雄性不育材料的利用,为胡萝卜育种提供很大的便利。据统计[17],目前欧美等发达国家大部分采用胡萝卜雄性不育材料进行育种。芹菜雄性不育材料很少,主要有1986年QUIROS等[18]以及2002年中国于西芹高代自交系发现的芹菜雄性不育[19]。QUIROS等[18]发现的芹菜雄性不育材料,由于不育性稳定性差,很长时间无法利用到芹菜育种中。中国发现的芹菜雄性不育材料,已培育出津奇1号和津奇2号等品种[19]。
试验从六合黄心芹和津南实芹中均能克隆到长短不同的2种atp6基因,且与对应的胡萝卜长度atp6基因长度一致,推导的氨基酸相似度很高。基因表达分析表明,长片段atp6基因在芹菜花发育过程中表达量增加,而短片段atp6基因表达量在花发育过程中变化不大,该结果与胡萝卜研究结果类似[4]。结合对胡萝卜atp6的研究,推测芹菜长片段atp6基因可能与花发育相关。同时,也暗示了利用胡萝卜不育材料的质体与芹菜核进行融合,可能培育出芹菜雄性不育材料。
利用细胞融合技术将不育材料与可育材料进行融合,已培育出很多农作物雄性不育材料。SAKAI和IMAMURA[20]通过细胞融合技术将萝卜不育的质体转移到油菜中,获得了不育系油菜品系。侯喜林等[21]利用非对称细胞融合技术获得的不结球白菜胞质雄性不育系。KANG等[22]通过将细胞融合技术获得了一种新型的细胞雄性不育油菜(INAP CMS)。在培育芹菜雄性不育材料中,谭芳等[23]初步研究了芹菜与CMS胡萝卜原生质体非对称性融合,成功将瓣化型雄性不育基因转移到芹菜中。为此,利用笔者之前获得的野生胡萝卜雄性不育材料线粒体atp6基因与芹菜atp6基因长度和拷贝数的差异,为利用细胞融合技术培育芹菜雄性不育材料提供了分子依据。
