CaMKⅡ在心肌肥大病理性网络机制中的作用
2019-07-31易桂文徐玲文陈如东
何 涛,易桂文,徐玲文,孙 强,陈如东
(1.武汉大学中南医院,湖北 武汉 430071;2.The Heidelberg University Hospital,Heidelberg Germany 69120;3.华中科技大学同济医学院附属协和医院,湖北武汉 430022;4.武汉市第三医院,湖北武汉 430060)
妊娠期高血压是孕期特有疾病,对新生儿出生结局产生严重不良影响[1].有研究[2]发现:妊娠期高血压孕妇及其新生儿心肌损伤风险明显高于正常孕妇.心肌肥大是高血压、缺血性心脏病、心力衰竭等疾病的共同病理基础,在围生儿心血管疾病预测中具有重要价值[3].钙离子/钙调素依赖性蛋白激酶Ⅱ(CaMKⅡ)是一种受钙调蛋白调控的多功能蛋白激酶[4],近年来的研究[5]发现:CaMKⅡ是介导心肌肥大多个信号通路的枢纽.基础研究[6]显示:血管紧张素Ⅱ(AngⅡ)诱导的大鼠心肌肥大模型中CaMKⅡ表达水平明显提升.细胞自噬维持人体内环境稳定方面发挥重要作用,相关研究[7]显示:心肌细胞肥大与细胞自噬明显相关;AngⅡ诱导的心肌肥大过程中存在明显的细胞自噬,导致心肌细胞凋亡[8].本研究通过AngⅡ诱导大鼠胚胎心肌细胞建立心肌细胞肥大模型,探讨CaMKⅡ与AMPK调控的细胞自噬之间的关系.
1 材料与方法
1.1 材料与试剂
大鼠胚胎心肌细胞株(德国海德堡大学自留株);胎牛血清、DMEM培养基、Trizol总RNA提取试剂、RIPA蛋白裂解液、cDNA合成试剂盒(Thermo Fisher Co.,Ltd);p-CaMK Ⅱ 重组质粒(Thr286)、空载质粒、鼠抗人CaMKⅡ,p-CaMKⅡ,AMPK,p-AMPK 单克隆抗体(BIOFINE Co.,Ltd);兔抗人LC3Ⅱ单克隆抗体、HRP标记羊抗鼠IgG、羊抗兔 IgG(BIOFINE Co.,Ltd).
1.2 方 法
1.2.1 细胞培养与转染
大鼠胚胎心肌细胞培养于含10%胎牛血清的DMEM培养基中,37℃ 10%CO2浓度的细胞培养箱中常规培养,每24 h更换细胞培养液,光学显微镜下观察细胞密度大于80%后进行传代.取传至第5代的细胞进行细胞转染,使用p-CaMKⅡ重组质粒转染24 h后更换为正常DMEM培养基,继续培养24 h后用于后续实验.
1.2.2 心肌细胞肥大模型建立与鉴定
使用1 nmol/L AngⅡ处理大鼠胚胎心肌细胞,建立细胞肥大模型,结晶紫染色测定细胞横截面面积.室温下使用4%多聚甲醛固定20 min,磷酸缓冲液洗涤,滴加1%结晶紫染色,室温下静置2 h,倒置显微镜下观察并拍照.随机选取10个视野,测量100个细胞,使用Image Pro Plus 6.0拍照并分析.RT-PCR检测细胞中心肌细胞肥大标志物心钠肽、脑钠肽mRNA的表达水平.
1.2.3 RT-PCR 检测
Trizol法提取大鼠胚胎心肌细胞中的总RNA,反转录得到 cDNA.引物合成由 BIOFINE Co.,Ltd完成,心钠肽引物序列:上游 5'-CCAAGAACTTT AGGTAGTCTA-3',下游 5'-CTTCAGTTGGGCAGAGT CTC-3';脑钠肽引物序列:上游 5'-TCGAAGACG TAGCACCTAACA-3',下游 5'-AGAGTTTCCTGGTTC CGGG-3';β-actin引物序列:上游 5'-CAACTAC TGGTCGAAGGGTA-3',下游 5'-AACACTACCCACA CTTGGTG-3'.反应体系 25 μL,反应条件:94 ℃ 2 min,94℃ 30 s,52 ℃ 30 s,72℃ 45 s,共40 个循环,延伸72℃ 2 min.行2%琼脂糖凝胶电泳,以β-actin为内参,计算心钠肽、脑钠肽mRNA的相对表达量.
1.2.4 Western blot检测
RIPA提取大鼠胚胎心肌细胞中总蛋白,BCA法蛋白定量.蛋白样品行10%聚丙烯酰胺凝胶电泳,湿法将目标蛋白转膜至PVDF,5%脱脂奶粉室温下封闭1 h,滴加鼠抗人 CaMKⅡ,p-CaMKⅡ,AMPK,p-AMPK单克隆抗体(1∶500倍稀释),兔抗人LC3Ⅱ单克隆抗体(1∶200倍稀释),4℃过夜,滴加HRP标记羊抗鼠IgG、羊抗兔IgG(1∶1 0 00倍稀释),ECL显色,避光显影,以β-actin为内参对照,计算各条带灰度值.
1.3 统计学分析
2 结 果
2.1 AngⅡ诱导的心肌细胞肥大及CaMKⅡ的作用分析
AngⅡ处理大鼠胚胎心肌细胞48 h后,结晶紫染色对细胞横截面面积测量显示:模型组细胞横截面面积明显大于对照组,且心肌细胞肥大标志物心钠肽、脑钠肽mRNA相对表达量明显高于对照组,差异具有统计学意义(P<0.01),提示成功构建体外心肌肥大模型.模型+CaMKⅡ抑制剂组细胞横截面面积以及心钠肽、脑钠肽mRNA相对表达量明显低于模型组,差异具有统计学意义(P<0.05),提示CaMKⅡ抑制剂明显抑制了AngⅡ诱导的心肌细胞肥大.见图 1,表 1.

图1 结晶紫染色检测各组细胞横截面面积Fig.1 Cell cross-sectional area measured by crystal violet staining(× 400)
表1 各组心肌细胞横截面面积及心钠肽、脑钠肽mRNA相对表达量Tab.1 Cross-sectional area of myocardial cells and relative expression of atrial natriuretic peptide and brain natriuretic peptide in each group

表1 各组心肌细胞横截面面积及心钠肽、脑钠肽mRNA相对表达量Tab.1 Cross-sectional area of myocardial cells and relative expression of atrial natriuretic peptide and brain natriuretic peptide in each group
注:与对照组比较,a:P<0.05;与模型组比较,b:P<0.05
?
2.2 AngⅡ作用不同时间对 CaMKⅡ及 AMPK信号通路的影响
AngⅡ作用不同时间的p-CaMKⅡ,p-AMPK相对表达量差异具有统计学意义(P<0.01);AngⅡ能够快速诱导CaMKⅡ、磷酸化,作用15 min时 p-CaMKⅡ表达水平即出现明显提升,30 min达到峰值水平,并持续至1 h,之后逐渐下降.AngⅡ作用不同时间的CaMKⅡ,AMPK的相对表达量差异无统计学意义(P>0.05).见图 2,表 2.

图2 AngⅡ作用不同时间CaMKⅡ,AMPK蛋白及磷酸化产物表达情况Fig.2 Expression of CaMK Ⅱ,AMPK protein and phosphorylated products at different times after AngⅡtreatment

表2AngⅡ作用不同时间对CaMKⅡ及AMPK信号通路的影响Tab.2Effects of AngⅡon CaMKⅡand AMPK signaling pathways at different time points(珋x±s)
2.3 p-CaMKⅡ重组质粒转染对心肌细胞 p-CaMKⅡ,p-AMPK,LC3Ⅱ蛋白表达的影响
使用p-CaMKⅡ重组质粒转染大鼠胚胎心肌细胞,使细胞中过表达 p-CaMKⅡ,结果显示:p-CaMKⅡ重组质粒转染组p-AMPK,LC3Ⅱ蛋白相对表达量明显高于空载质粒转染组,差异具有统计学意义(P<0.05);随着p-CaMKⅡ表达水平的提升,p-AMPK,LC3Ⅱ蛋白的相对表达量也逐渐增加.见表 3,图 3.
2.4 心肌肥大过程中CaMKⅡ与AMPK调控的细胞自噬的相关性分析
模型组p-CaMKⅡ,p-AMPK,LC3Ⅱ蛋白相对表达量明显高于对照组,差异具有统计学意义(P<0.01);模型+CaMKⅡ抑制剂组 p-CaMKⅡ,p-AMPK,LC3Ⅱ蛋白相对表达量明显低于模型组,差异具有统计学意义(P<0.05).Pearson相关性分析显示:p-CaMKⅡ表达与AMPK,LC3Ⅱ表达呈正相关(r=0.824,0.750,P<0.01).见表 4,图 4.
表3p-CaMKⅡ重组质粒转染对心肌细胞p-CaMKⅡ,p-AMPK,LC3Ⅱ蛋白表达的影响Tab.3 Effects of p-CaMK Ⅱ recombinant plasmid transfection on the expression of p-CaMK Ⅱ,p-AMPK and LC3Ⅱin cardiomyocytes
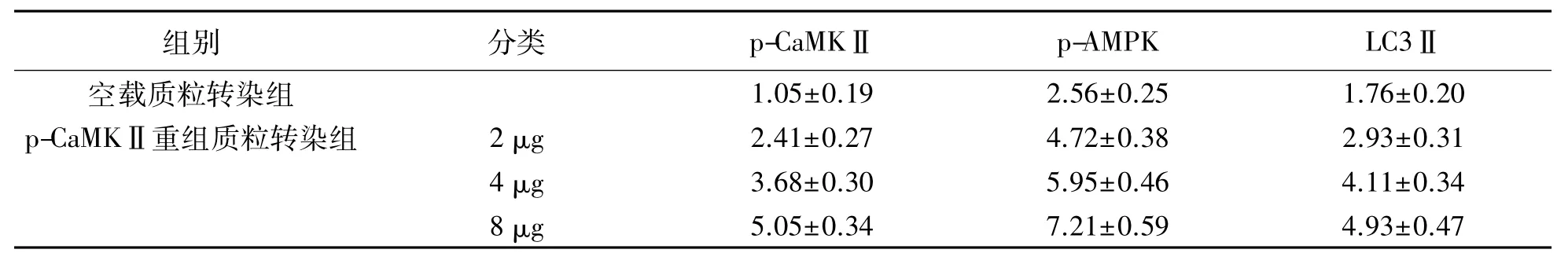
表3p-CaMKⅡ重组质粒转染对心肌细胞p-CaMKⅡ,p-AMPK,LC3Ⅱ蛋白表达的影响Tab.3 Effects of p-CaMK Ⅱ recombinant plasmid transfection on the expression of p-CaMK Ⅱ,p-AMPK and LC3Ⅱin cardiomyocytes
?
表4 各组p-CaMKⅡ,p-AMPK,LC3Ⅱ蛋白相对表达量Tab.4Relative expression of p-CaMKⅡ,p-AMPK and LC3Ⅱin each group

表4 各组p-CaMKⅡ,p-AMPK,LC3Ⅱ蛋白相对表达量Tab.4Relative expression of p-CaMKⅡ,p-AMPK and LC3Ⅱin each group
注:与对照组比较,a:P<0.05;与模型组比较,b:P<0.05
?

图3 p-CaMKⅡ重组质粒转染对心肌细胞p-CaMKⅡ,p-AMPK,LC3Ⅱ蛋白表达情况Fig.3 The expression of p-CaMK Ⅱ,p-AMPK and LC3Ⅱin myocardial cells of each group

图4 各组心肌细胞p-CaMKⅡ,p-AMPK,LC3Ⅱ蛋白表达情况Fig.4 The expression of p-CaMK Ⅱ,p-AMPK and LC3Ⅱin myocardial cells of each group
3 讨 论
妊娠期高血压孕妇体内血流动力学异常改变,影响肾素-血管紧张素系统,导致胎儿心腔容积增加、心肌细胞肥大、收缩和舒张功能改变等一系列形态与功能变化[9].目前将高血压、主动脉狭窄、心肌受损、炎症等神经激素调节信号导致的心肌肥大定义为病理性心肌肥大,可发展为心律失常、心肌病、心力衰竭,导致胎儿宫内生长受限或死亡,同时提升了新生儿出生后的死亡率[10].由于调控病理性心肌肥大的信号网络十分复杂,虽然已有相关[11]研究报道,但仍未阐明信号网络间的相互作用.心肌肥大过程中细胞自噬作用是近年来研究的热点之一,正常生理状态下细胞自噬可保护细胞的正常生理功能,但同时能够促进病理性心肌肥大的发生与发展[12-13].心肌细胞中 AMPK、PI3K/AKT/mTOR、丝裂原活化蛋白激酶信号通路均能被心肌肥大刺激因子激活.其中AMPK信号通路在细胞自噬中的调控作用最为显著,当被刺激因子激活后可生成p-AMPK,下调mTOR表达,进而提升LC3Ⅱ蛋白表达水平,引发细胞自噬[14].本研究显示:AngⅡ诱导大鼠胚胎心肌细胞株建立心肌肥大模型,能够快速诱发AMPK磷酸化,LC3Ⅱ蛋白表达水平也明显提升,提示细胞自噬在心肌肥大发生过程中被激活.
相关研究[15]显示:CaMKⅡ能够介导心肌肥大的发生与发展,但CaMKⅡ在心肌肥大病理性网络机制中的作用仍未明确.本研究使用AngⅡ在体外成功构建心肌细胞肥大模型,AngⅡ能够明显提升CaMKⅡ磷酸化水平,AngⅡ在心肌细胞肥大发生与发展过程中可直接作用于CaMKⅡ,CaMKⅡ经特异性抑制剂干预后,有效抑制了AngⅡ诱发心肌肥大的活性,进一步证实了CaMKⅡ在心肌肥大发生与发展中的调控作用.同时,本研究发现:p-AMPK水平随CaMKⅡ的增加而提升,提示CaMKⅡ活化后可显著提升AMPK磷酸化水平,CaMKⅡ是AMPK的主要调控因子之一.进一步将CaMKⅡ抑制剂与AngⅡ同时作用于大鼠胚胎心肌细胞,结果显示:CaMKⅡ抑制剂在下调CaMKⅡ磷酸化水平的同时,明显抑制了AngⅡ介导的AMPK磷酸化,提示CaMKⅡ是AMPK的上游调控因子.
综上所述,CaMKⅡ作为心肌肥大病理发展中的调控因子,可通过调控AMPK信号通路来影响细胞自噬,介导心肌肥大的发生与发展.本研究为深入探讨妊娠期高血压孕妇胎儿心肌肥大的分子机制提供了新的方向.
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
