电针对颅脑损伤大鼠海马CA1区细胞凋亡的影响*
2019-07-30陈坤黄寓折雪妮王瑞辉
陈坤黄寓,王 东,杨 欢,王 鑫,折雪妮,王瑞辉
(陕西中医药大学,陕西 咸阳 712000)
颅脑损伤(Traumatic brain injury,TBI)是外科常见的且危及生命的疾患之一,不仅会带来身体上的残疾,对大脑学习认知能力亦会产生负面效应,目前,电针对脑损伤的治疗作用已取得肯定的疗效[1-2],但对其机制的研究尚未明确。本实验采用Morris水迷宫测试、HE染色及Western印记分析等测定方法,观察大鼠颅脑损伤前后行为学及凋亡蛋白caspase-3的变化及电针对其影响,以探讨电针对脑损伤大鼠海马区的影响机制。
1 材料和方法
1.1 实验动物
选用SD大鼠60只,体质量210~240 g,由成都达硕试验动物有限公司提供,合格证号SCXK(川)2015-030,自由饮食,(20±3)℃下饲养,造模前禁食12 h,禁水2 h。
1.2 模型制备及分组
使用改良的Feeny自由落体损伤装置建立颅脑损伤模型[3]。大鼠被随机分为:①假手术组20只,沿头顶正中线切开头皮,在左侧颅骨钻孔后缝合头皮,不作打击;②模型组20只,使用改良的Feeny自由落体装置打击左侧大脑,深度约5 mm,后缝合头皮;③电针组20只,在造模24 h后开始针刺治疗。14天后各组分别取材。
1.3 电针处理
在颅脑损伤后第2天,参照《实验针灸学》[4]动物实验定位取穴,电针大鼠“百会”“大椎”“内关”“足三里”穴。用动物固定架固定大鼠,沿皮下缓慢进针,深度5 mm,接通电针仪,正负极连接前肢与后肢针尾。电针仪用华佗牌SDZ-IIA, 频率为5~10次/s,疏密波形,强度以大鼠轻微颤抖为度[5],时间15 min,1次/天,共14天,治疗7次后间隔1天继续电针治疗。
1.4 Morris水迷宫
在造模后第11天,对大鼠进行为期5天的学习训练。在圆筒形水池装满水,分为4个象限,将平台放置于某个象限,让大鼠沿池壁下水,摄像机记录60 s内大鼠登上平台所需时间(逃避潜伏期)。每只大鼠每天从4个象限分别进行1次学习训练,若90 s内未能登上平台,则将大鼠引导至平台以强化记忆15 s。取后3天大鼠逃避潜伏期的均数为大鼠的学习记忆成绩。在第5天训练结束后,撤离平台,记录大鼠60 s内穿越原平台的次数。
1.5 组织灌注和取材
在对大鼠进行学习记忆能力测试结束后,对实验大鼠进行取材。每组抽取10只大鼠取新鲜左脑海马组织,剩余10只大鼠的大脑用石蜡固定用于组织切片。将大鼠麻醉后(10%水合氯醛3.5 mL/kg)固定于动物台,打开胸腔后用灌注针头插入大鼠心尖开始灌注生理盐水,直至大鼠肺脏、肝脏等组织呈白色失血样。随后断头打开颅腔,用直镊小心拨开大脑皮质,分离左侧海马,迅速置于-80℃冰箱中保存。用于石蜡切片的脑组织,将海马剥离后冠状面切块置于4%的多聚甲醛溶液中固定,24 h内脱水包埋后石蜡切片5 μm备用。
1.6 Western-blot
将海马称重,根据1 mg组织加入6 μL裂解液(含1 mM PMSF),进行组织匀浆,离心机转速10 000 r/min离心5 min,提取上清液;按照BCA蛋白浓度试剂盒说明书调整至蛋白浓度一致;制备SDS-PAGE聚丙烯酰胺凝胶(12%分离胶+5%浓缩胶),电泳分离蛋白;湿法转移到PVDF膜上;用5%脱脂奶粉室温摇床封闭2 h,加入兔抗大鼠caspase-3(1∶1 000),4℃孵育过夜;室温复温1 h,洗膜后加入辣根过氧化物酶标记的羊抗兔IgG二抗(1∶500),室温孵育1 h;洗膜后用超敏ECL化学发光试剂盒进行发光显色,拍照记录。
1.7 HE染色
染色前将石蜡切片在65℃烤箱中烤片1 h,于二甲苯、梯度酒精(100%、95%、90%、80%、75%)中脱蜡,纯水冲洗1 min,苏木素先用滤纸滤过杂质,再将切片浸入5 min,纯水冲洗1 min,伊红染色1 min,纯水冲洗清除残留染色液,镜下观察染色情况。染色成功后,分别在80%、95%、100%无水乙醇中浸泡数秒,二甲苯中脱水5 min,中性树胶封片。光学显微镜下拍摄切片海马CA1区,观察该区神经元细胞的损伤程度和形态变化。
1.8 统计学分析
2 结果
2.1 大鼠学习记忆能力、空间探索能力比较
相较于第1天,第2天各组的逃避潜伏期均有所降低,但差异无统计学意义(P>0.05);在第3~5天期间,模型组的逃避潜伏期明显较假手术组更长(P<0.01),电针组逃避潜伏期时间明显较模型组更短(P<0.01);在水迷宫实验第5天,模型组穿越平台次数明显少于假手术组(P<0.01),而电针组穿越平台次数则多于模型组(P<0.05)。见表1。
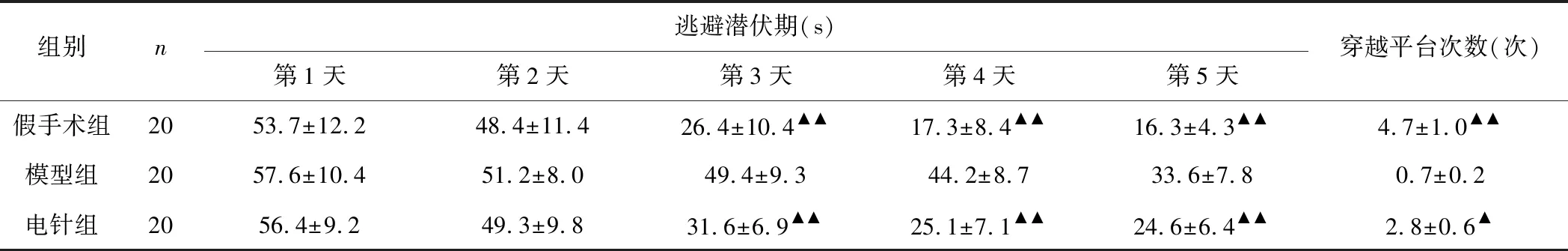
组别n逃避潜伏期(s)穿越平台次数(次)第1天第2天第3天第4天第5天假手术组2053.7±12.248.4±11.426.4±10.4▲▲17.3±8.4▲▲16.3±4.3▲▲4.7±1.0▲▲模型组2057.6±10.451.2±8.049.4±9.344.2±8.733.6±7.80.7±0.2电针组2056.4±9.249.3±9.831.6±6.9▲▲25.1±7.1▲▲24.6±6.4▲▲2.8±0.6▲
注:与模型组比较,▲P<0.05,▲▲P<0.01。
2.2 Western blot法检测海马CA1区caspase-3的表达量比较
模型组的caspase-3蛋白表达量明显高于假手术组,且比电针组表达明显。见图1。

注:A.假手术组;B.模型组;C.电针组。图1 各组大鼠海马CA1区caspase-3蛋白的表达水平
2.3 各组海马病理学检查结果比较
假手术组观察到海马CA1区无细胞及组织结构改变,神经元形态、结构正常,核椭圆蓝染,胞质粉红;模型组海马CA1区组织间质水肿,神经元细胞排列松散,神经细胞萎缩,核固缩严重,空泡较多;电针组脑组织恢复程度明显,水肿几乎消失,细胞层次清晰,损伤组织周围可见完好细胞结构,核固缩现象减少,空泡减少。见封三彩图2。
3 讨论
创伤性颅脑损伤(TBI)常常发生突然,预后不佳。海马结构属于脑的边缘系统中的重要结构,与学习、记忆、认知功能有关[6]。海马组织尤其是CA1区对缺氧等损伤最为敏感,也被称为易损区[7]。TBI发生后其神经破坏和神经功能恢复的过程可概括为:①原发性损伤对脑组织的破坏;②TBI后损伤部位及其周围的神经细胞继续发生坏死或凋亡,继而产生继发脑损伤(Secondary brain injury,SBI);③TBI后神经元的自我修复与再生[8]。细胞凋亡是重要的神经细胞死亡方式,是一系列高度调控的半胱氨酸蛋白酶(caspase)级联反应事件的结果[9]。在线粒体介导的细胞凋亡中,caspase-3位于该反应的下游,与其他下游的caspase成员一起执行凋亡事件[10-11]。本实验通过观察caspase-3在脑损伤大鼠海马CA1区表达量的变化以及细胞病理学改变,揭示电针对颅脑损伤大鼠神经细胞凋亡的影响机制,即通过下调caspase-3的表达来抑制细胞凋亡,促进神经元的恢复与再生。
颅脑损伤在中医里属“脑伤”“跌仆”,病位在脑,病机为血瘀、气滞导致清窍闭阻或气机逆乱,《诸病源候论》说:“夫有瘀血者,令人喜忘”,故治疗应活血化瘀、疏通经络、调理气机[12]。本研究穴选督脉加手足阳明经穴,《难经》曰:“督脉者,起于下极之俞,并于脊里,上至风府,入属于脑”,且督脉与手足三阳经及阳维脉交会,总督一身阳气,统帅整体经脉[13]。百会穴属督脉通于脑,醒神益智、升清降浊。大椎穴能调节脏腑功能,健脑益髓。颅脑外伤后对学习记忆能力有所影响,《黄帝明堂经》中就有内关主“失智”,能“醒脑神”的记载[14]。足三里为阳明经穴,补益气血,为治疗下肢痿痹的要穴。电针上述穴位,给予颅脑损伤大鼠连续电生理刺激,以养血祛瘀、醒神健脑。
本研究从颅脑损伤后电针对大鼠的认知功能和海马CA1区凋亡蛋白caspase-3的表达量的影响,探索了电针对于脑损伤治疗的作用机制,即通过抑制凋亡蛋白caspase-3 的表达抑制细胞凋亡线粒体途径的级联反应,减少细胞凋亡,从而恢复认知功能。
