急性充血性心力衰竭合并利尿剂抵抗的危险因素分析
2019-07-29郑鸿雁王大宇
郑鸿雁 解 强 王大宇 吴 莎
1 广州市番禺区中心医院(广州 511400) 2 广州市番禺区心血管疾病研究所(广州 511400)
利尿剂是急性充血性心力衰竭患者治疗中最重要的药物,其通过短时间内降低容量负荷,迅速减轻患者的心衰症状[1]。但随着心衰的进展恶化及利尿剂的长期应用,近25%~30%患者会出现利尿剂抵抗[2]。利尿剂抵抗与急性和慢性心衰患者的心源性死亡都存在独立相关性,出现利尿剂抵抗往往提示更差的预后[3- 4],因此,如果能在入院后早期识别出易出现利尿剂抵抗的高危心衰患者,可为早期采用其他替代治疗(如血液超滤或血液透析)提供依据[5]。另外,利尿剂抵抗患者独特的临床特点及异常生物学标志物,可提供有关利尿剂抵抗背后病理生理学机制更多的信息。
1 资料与方法
1.1 研究对象
连续性选取2018年1月—2018年6月于我院心血管内科住院治疗的急性充血性心力衰竭的患者,其中利尿剂有效组185人及利尿剂抵抗组83人,入组标准为:①确诊且入院主要诊断为急性充血性心力衰竭;②住院治疗前三天有使用静脉利尿剂。排除标准主要包括:①慢性肾脏病(chronic kidney disease,CKD)≥4期或需透析治疗的患者;②住院时间小于3天。
1.2 方法
1.2.1 数据记录:入院12小时内获取患者相关的临床资料及实检室检查结果。记录患者入院前三天每天使用的袢利尿剂用量,其中静脉托拉塞米20 mg相当于呋塞米40 mg剂量计算,利尿剂口服剂量相当于0.5倍静脉剂量计算。醛固酮拮抗剂螺内酯及噻嗪类利尿剂氢氯噻嗪不纳入利尿剂用量计算中。
1.2.2 分组标准:利尿剂有效组为入院后前三天平均每天尿量>2 500 mL,且平均每天静脉呋塞米用量≤40 mg(托拉塞米20 mg相当于呋塞米40 mg);利尿剂抵抗组为入院后前三天平均每天尿量<1 000 mL,或静脉呋塞米平均每天用量≥80 mg。不符合利尿剂有效或抵抗组的患者排除出研究分析中。
所有患者的治疗原则按2014年中国慢性心衰治疗指南进行。
1.3 统计学方法
本研究应用SPSS 19.0进行数据统计分析。先将各研究指标做单因素分析,对连续变量的因素采用t检验,对非连续变量因素采用卡方检验。再将有统计学意义的因素纳入Logistic模型,进行 Logistic 逐步回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 利尿剂抵抗单因素分析
本研究数据分析结果见表1和表2。研究结果提示,与利尿剂抵抗发生相关的因素有是否合并糖尿病、收缩压和缩张压、入院后前24小时尿量、N-端脑利钠尿肽前体(n-terminal brain natriuretic peptide precursor,NT-proBNP)、血红蛋白浓度、血Na+、尿素氮(blood urea nitrogen,BUN)、肾小球滤过率估计值(estimated glomerular filtration rate, eGFR)、总胆固醇等。
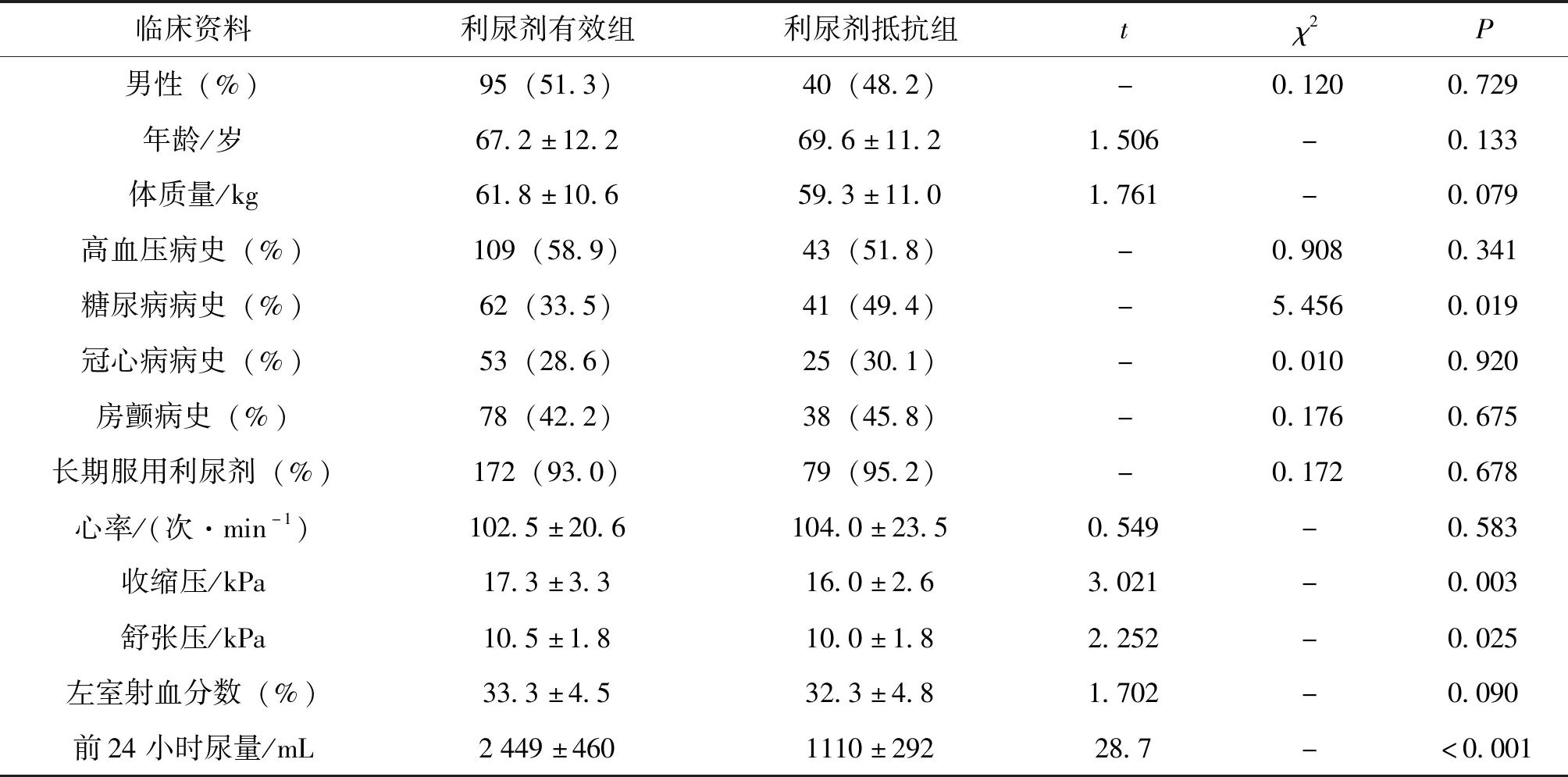
表1 利尿剂有效组与利尿剂抵抗组的临床资料对比
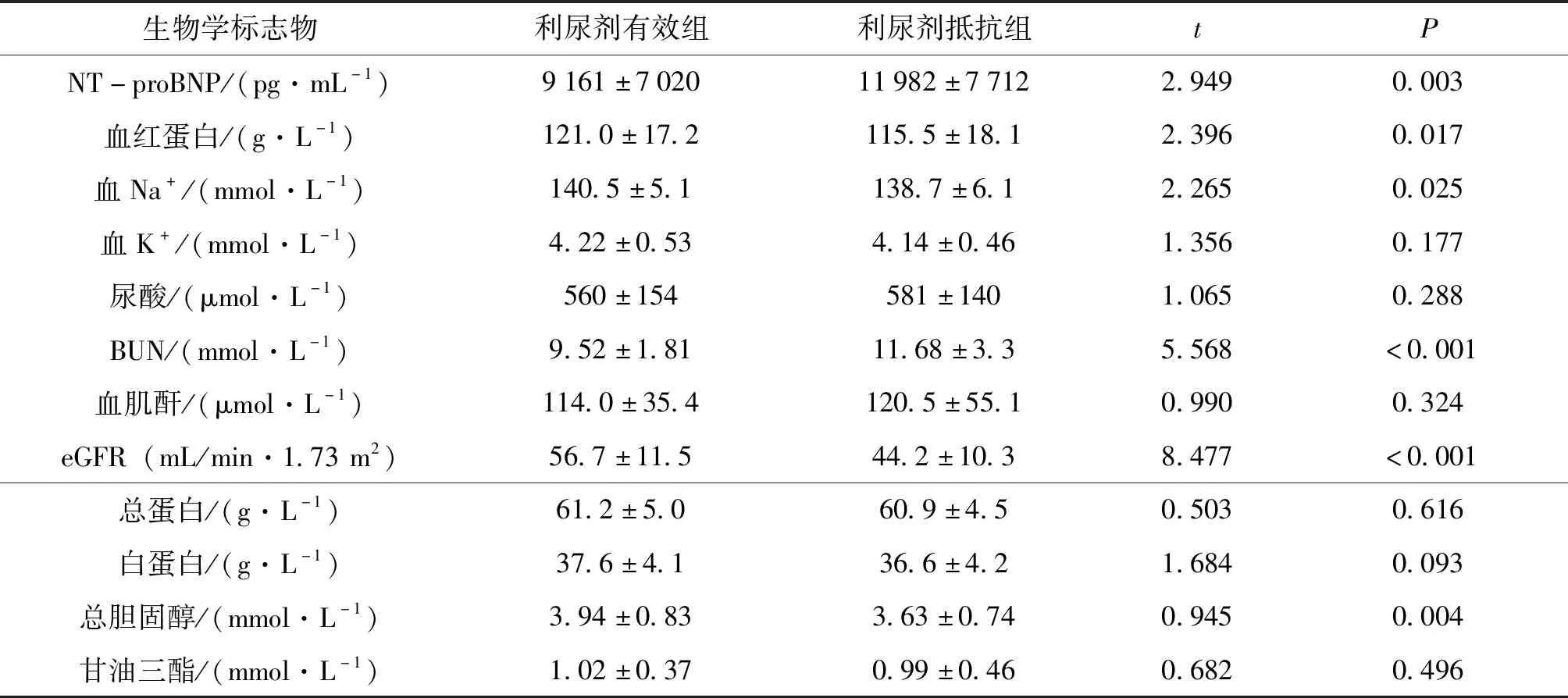
表2 利尿剂有效组与利尿剂抵抗组的生物学标志物对比
2.2 利尿剂抵抗多因素回归分析
将单因素分析中有统计学意义的因素纳入模型,进行多因素Logistic逐步回归分析。引入及剔除变量均取0.05。结果见表3,提示有3个因素进入模型,其中入院后前24小时尿量与利尿剂抵抗发生相关性最大。见表3。
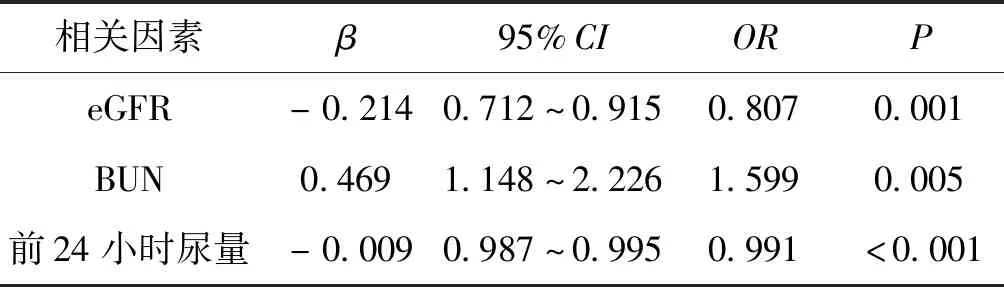
表3 利尿剂抵抗相关因素的多因素Logistic回归分析
3 讨 论
利尿剂抵抗是临床上治疗心力衰竭患者中常见的现象,但这种现象目前仍缺乏足够的重视,也没有统一的标准化定义。不同的学者从各自的研究方向对其进行不同的定义,在生理学上,利尿剂抵抗的标准为钠排泄分数<0.2%[6]。而在临床上,其广泛的定义为:使用足够剂量利尿剂或增加利尿剂剂量也无法解除水肿充血症状的情形。但这种定义缺乏客观的指标,因此不同的临床研究者对利尿剂抵抗的具体标准也不一致,如Kittleson[7]根据的是患者每天口服的利尿剂需求量(每天口服呋塞米超过80 mg或托拉塞米超过40 mg),Valente[3]根据的是患者对利尿剂的敏感程度(每40 mg呋塞米或相当于此剂量的利尿剂可使患者减轻的公斤数)。
本研究综合以上几种对利尿剂抵抗的分类标准,根据每日尿量及使用利尿剂的剂量,从我院近半年来住院治疗的急性充血性心力衰竭患者中分选出对利尿剂反应不佳和对利尿剂反应良好的两大类患者。对比两组患者中的临床特点及生化标志物,希望从中找出能预测利尿剂抵抗发生风险的因素。
研究中发现,利尿剂反应差的那一组患者,更多的有合并糖尿病、低血压、早期的利尿反应差、较高的NT-proBNP、血红蛋白浓度低、血Na+浓度下降、血清尿素氮升高、eGFR下降、总胆固醇升高。这些因素中,大多数并不是独立预测的因素,表明这些变量有较强的共线性,因此,利尿反应可能仅是反应了这些因素的汇合结果。
两组患者有差异的因素中,NT-proBNP升高、血压下降意味着患者心衰程度更为严重,提示利尿剂抵抗更容易出现在严重或终末期的心衰患者中。在充血性心衰患者中,袢利尿剂的药代动力学会发生改变,利尿阀值升高和最大利尿效应下降,这种效应在终末期的心衰患者中表现得更明显。同时,急性心力衰竭的患者,特别是在心衰合并低血压的情况下,会出现各器官灌注不足,以肾脏血流减少最为显著,促使近端小管钠的潴留及醛固酮释放,而醛固酮的增加会进一步加重水钠潴留,造成心肾功能进行性恶化的恶性循环。
利尿剂通过肾脏发生作用,因此,能影响肾功能的因素同时也可以影响利尿剂效应。糖尿病和动脉粥样硬化(高胆固醇血症)均可引起肾小球损害及和肾小球硬化,两者影响利尿剂效应的作用机制可能是通过影响肾功能(eGFR)来实现[8]。
心力衰竭的患者易发生低钠血症,原因主要是因为心输出量减少刺激血管加压素分泌量增多,血管加压素可使远曲小管对水重吸收增加,同时增加渴感,引起水摄入增多,导致低钠血症的发生。低钠血症患者因远端小管排钠能力减退和继发性高醛固酮血症,使利尿剂作用减退。
本研究中发现利尿剂抵抗组的患者血红蛋白浓度较利尿剂有效组低,具体原因不详,可能是因为利尿剂抵抗组的患者心衰程度更重,营养状况更差,以及利尿剂抵抗组肾功能更差,出现肾性贫血可能性也较高。
在直接反应肾功能的几个指标中,血清肌酐与患者利尿反应并不相关,可能是肌酐作为肾功能标志物,并没有提供关于肾小管功能或损伤的直接信息。而eGFR和BUN可较肌酐更好的反应肾小管功能情况[9]。在国外其他几个研究中也提及了,在利尿剂抵抗的患者中,血清BUN可较肌酐升高更为明显[10-11]。
在本研究最后得出的三个可独立预测利尿剂抵抗的因素中,入院后前24小时的利尿反应与利尿剂抵抗发生的相关性最大。得出这个结论并不奇怪,但在还没找到一个可特异性预测出利尿剂抵抗的生物学标志物前,这个因素可提供重要的临床应用价值。首先,监测入院后前24小时的尿量易于实行,可在所有急性心衰住院治疗的患者中应用。其次,这个因素的监测并不提高患者的住院费用。最后,这个指标的获取可在患者入院后24小时内完成,一旦出现患者早期利尿反应不佳,提示该患者具有高危利尿剂抵抗风险,有利于临床治疗中及时更改治疗方案,及早采取更为积极的策略,如肾替代治疗等,也可以在早期鉴别出远期预后不良的患者。
除了本研究中纳入的几项临床常见的生物因子外,国外一些研究发现髓过氧化物酶、中性粒细胞明胶酶相关脂质运载蛋白、内皮细胞选择性粘附分子(ESAM),淋巴毒素β受体(LTbR)、可溶性ST2、嗜中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、肾损伤分子(KIM-1)等反映动脉粥样硬化或肾小管功能的生物标志物与心衰患者的利尿剂效应相关[11],但无论是单一的生物学标志物或几个生物学标志物联合应用均无法准确的预测利尿反应,这些新发现的生物学因子能为临床治疗提供的参考价值极其有限。
本研究是有关心衰患者利尿剂抵抗相关危险因素分析的研究,国内少见相关的研究,具有创新性,但同时也存在不少限制因素,首先研究纳入的是单中心的样本,样本量并不大;研究中对利尿效应观察的指标是尿量,并没有考虑患者的水摄入量;本研究仅纳入了部分对利尿剂反应抵抗或良好的心衰患者,而对其中间的一部分人群,并没有纳入研究,这样的设计方案可以提高寻找到利尿剂抵抗预测因子的敏感度,但同时可能也会降低其特异度。
综上所述,利尿剂抵抗可能与心衰的严重程度、电解质异常和肾小球和肾小管功能障碍相关。血清尿素氮、肾小球滤过率等因素可用于预测急性充血性心力衰竭患者对利尿剂的反应情况。而早期的利尿反应可有效筛选出心衰合并利尿剂抵抗的高危患者。
