高海拔地区藏族和汉族乳腺浸润性导管癌凋亡相关蛋白及凋亡指数的研究*
2019-07-29杨娟李亚飞宋晓燕袁青玲祁玉娟
杨娟,李亚飞,宋晓燕,袁青玲,祁玉娟
(青海省人民医院,青海 西宁 810007)
乳腺癌是女性常见的恶性肿瘤,其发病率逐年上升[1],其在不同地域、种族和民族间存在差异[2]。肿瘤大小、淋巴结阳性率、激素受体、HER-2及Ki-67指数是乳腺癌预后因素[3]。Bcl-2作为一种凋亡抑制基因,对乳腺癌的预后及转移具有预测作用[3-4]。本研究通过免疫组织化学法研究世居青海的藏族和汉族乳腺浸润性导管癌Bcl-2、Bax、Caspase-3及凋亡指数(apoptosis index, AI)的表达,探究高海拔地区藏族与汉族乳腺癌生物学行为的差异。
1 资料与方法
1.1 一般资料
选取2012年12月—2015年12月在青海省人民医院接受手术治疗的藏族和汉族乳腺浸润性导管癌患者各60例。临床分期按美国癌症联合会第7版临床分期[5]。以Bloom-Richardson系统方案对乳腺癌组织学进行分级[6]。本研究通过医院伦理委员会批准,患者及其家属签署知情同意书。
1.2 试剂与仪器
Bcl-2鼠抗人单克隆抗体(丹麦DAKO公司),Caspase-3、Bax 兔抗人单克隆抗体(北京中山生物技术有限公司),免疫组织化学实验采用丹麦DAKO公司ChemMate EnVision检测系统K500711检测试剂盒,原位DNA缺口末端标记(terminal deoxynucleotidy transferase-mediated digoxigenin-11-dUTP nick end labeling, TUNEL)选用瑞士罗氏公司诊断试 剂盒。
1.3 方法
1.3.1 标本收集及处理手术切除的新鲜乳腺浸润性导管癌标本,取组织中心部分,10%中性甲醛溶液固定,分别用于苏木精-伊红(hematoxylin-eosin, HE)染色、免疫组织化学染色及AI研究。
1.3.2 HE染色将已固定的组织标本经梯度脱水、浸蜡及包埋后,以4μm厚度为标准进行连续切片,常规HE染色。
1.3.3 免疫组织化学染色检测Bcl-2、Bax及Caspase-3的表达高压处理组织切片后,修复暴露抗原。设置阳性和阴性对照,阳性对照为已知阳性切片,空白对照用磷酸盐缓冲溶液代替一抗,严格遵守试剂盒说明书操作。DAB显色,苏木精轻度复染,脱水、透明,中性树脂封片,显微镜 观察。
1.3.4 TUNEL检测AI严格遵守TUNEL试剂盒说明书进行制作石蜡切片,脱蜡、水化后细胞通透,加入TUNEL反应液加入Converter-POD,与底物DAB反应显色,光学显微镜计数并拍照,分析结果;实验同时设置阳性及阴性对照。
1.4 结果判定
染色阴性:无目标细胞染色;染色阳性:弱阳性(+)(1%~25%);阳性(++)(26%~50%);强阳性(+++)(51%~75%);强阳性(++++)(>75%)。染色强度:弱染色:细胞染色在40物镜视野才能看到;强染色:细胞染色在4倍或10倍物镜视野能看到;中等染色:介于强染色与弱染色之间。细胞凋亡阳性判断:光学显微镜观察肿瘤细胞核,细胞核棕黄色为阳性细胞,呈均匀染色或颗粒状。AI:阳性细胞在肿瘤中所占的百 分比。
1.5 统计学方法
数据分析采用SPSS 17.0统计软件。计数资料以构成比或率(%)表示,比较用χ2检验,P <0.05为差异有统计学意义。
2 结果
2.1 乳腺浸润性导管癌组织中Bcl-2、Bax及Caspase-3的染色情况
Bcl-2染色阳性主要表达于细胞核和细胞浆,Caspase-3和Bax染色阳性主要表达于细胞浆和细胞核。见图1。
2.2 TUNEL的染色情况
以光学显微镜或电子显微镜对原位凋亡细胞的观察为金标准。细胞凋亡在形态学上可表现为细胞核崩解、核膜消失、染色质凝聚、凋亡小体形成、细胞皱缩及碎裂等。见图2。
2.3 藏族、汉族乳腺浸润性导管癌患者临床资料比较
高海拔地区藏族、汉族乳腺浸润性导管癌患者年龄、肿瘤大小、组织学分级、临床分期、淋巴结是否转移、雌激素阴性与阳性受体、孕激素阴性与阳性受体、Ki-67不同比例及Her-2阴性与阳性等构成比比较,经χ2检验,差异无统计学意义(P >0.05)。见 表1。

图1 乳腺浸润性导管癌中Bcl-2、Bax及Caspase-3的阳性表达 (免疫组织化学染色)

图2 乳腺浸润性导管癌细胞形态 (TUNEL染色)

表1 高海拔地区藏族、汉族乳腺浸润性导管癌患者临床资料比较 (n =60,例)
2.4 不同临床病理特征乳腺浸润性导管癌患者的Bcl-2、Bax及Caspase-3阳性表达
120例乳腺浸润性导管癌组织中Bcl-2、Bax及Caspase-3的阳性表达率分别为45.0%(54/120)、69.2%(83/120)和59.2%(71/120)。乳腺浸润性导管癌Bcl-2阳性患者淋巴结是否结转移、雌激素受体阴性与阳性及孕激素受体阴性与阳性等构成比比较,经χ2检验,差异有统计学意义(P <0.05)。乳腺浸润性导管癌Caspase-3阳性患者雌激素受体阴性与阳性构成比比较,经χ2检验,差异有统计学意义(P <0.05)。120例乳腺浸润性导管癌患者其他临床病理特征的Bcl-2、Bax及Caspase-3阳性表达比较,经χ2检验,差异无统计学意义(P >0.05)。见 表2。

表2 不同临床病理特征乳腺浸润性导管癌患者的Bcl-2、Bax及Caspase-3阳性表达比较 例(%)
2.5 高海拔地区藏族乳腺浸润性导管癌患者不同临床病理特征的Bcl-2、Bax及Caspase-3阳性表达
高海拔地区藏族乳腺浸润性导管癌Bcl-2阳性患者淋巴结是否转移及雌激素受体阴性与阳性等构成比比较,经χ2检验,差异有统计学意义(P <0.05)。高海拔地区藏族乳腺浸润性导管癌Caspase-3阳性患者雌激素受体阴性与阳性构成比比较,经χ2检验,差异有统计学意义(P <0.05)。高海拔地区藏族乳腺浸润性导管癌患者其他临床病理特征的Bcl-2、Bax及Caspase-3阳性表达比较,经χ2检验,差异无统计学意义(P >0.05)。见表3。
2.6 高海拔地区藏族、汉族乳腺浸润性导管癌组织中Bcl-2、Bax及Caspase-3的阳性表达
高海拔地区藏族、汉族乳腺浸润性导管癌患者Bcl-2、Bax及Caspase-3阳性表达比较,经χ2检验,差异无统计学意义(P >0.05)。见表4。
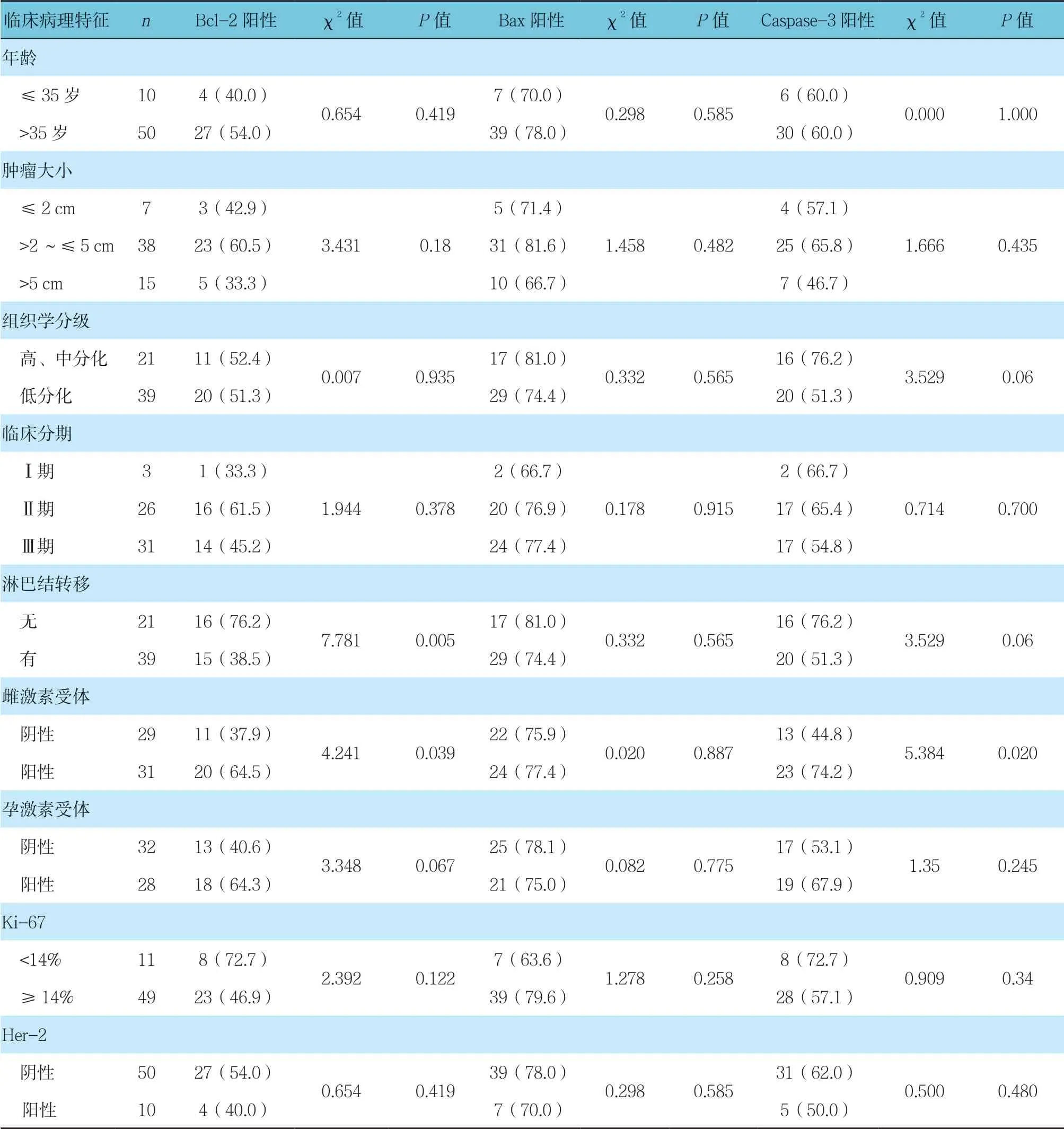
表3 藏族乳腺浸润性导管癌患者不同临床病理特征的Bcl-2、Bax及Caspase-3的表达情况比较 例(%)
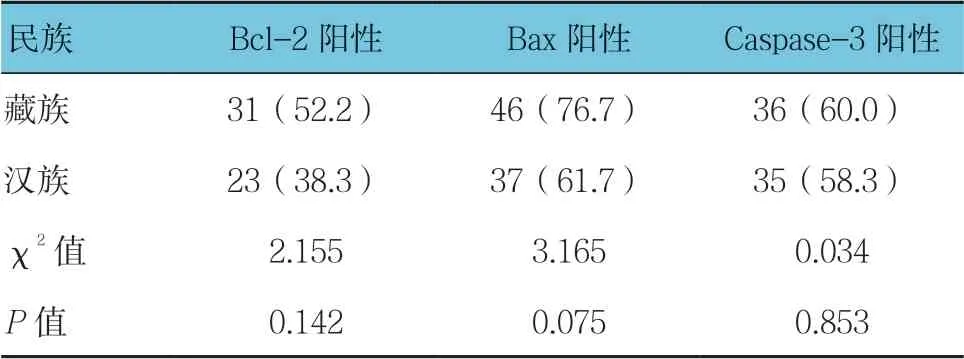
表4 高海拔地区不同民族乳腺浸润性导管癌中Bcl-2、Bax及Caspase-3的阳性表达比较 [n =60,例(%)]
2.7 高海拔地区乳腺浸润性导管癌Bcl-2、Bax及Caspase-3的比较
高海拔地区浸润性乳腺癌Bcl-2阳性与阴性患者的Caspase-3表达比较,经χ2检验,差异有统计学意义(P <0.05)。藏族乳腺浸润性导管癌Bcl-2阳性与阴性患者的Bax、Caspase-3表达比较,经χ2检验,差异有统计学意义(P <0.05)。见表5、6。
2.8 高海拔地区藏族乳腺浸润性导管癌患者AI与临床病理特征的关系
高海拔地区藏族乳腺浸润性导管癌患者AI阳性与阴性构成比分别为37/23和36/24,经χ2检验,差异无统计学意义(χ2=0.035,P =0.852)。
高海拔地区藏族乳腺浸润性导管癌患者AI阳性与阴性患者肿瘤大小、临床分期及孕激素受体阴性与阳性等构成比比较,经χ2检验,差异有统计学意义(P <0.05);但年龄、组织学分级、淋巴结是否转移、雌激素受体阴性与阳性、Ki-67不同比例及Her-2阴性与阳性等构成比比较,差异无统计学意义(P >0.05)。见表7。
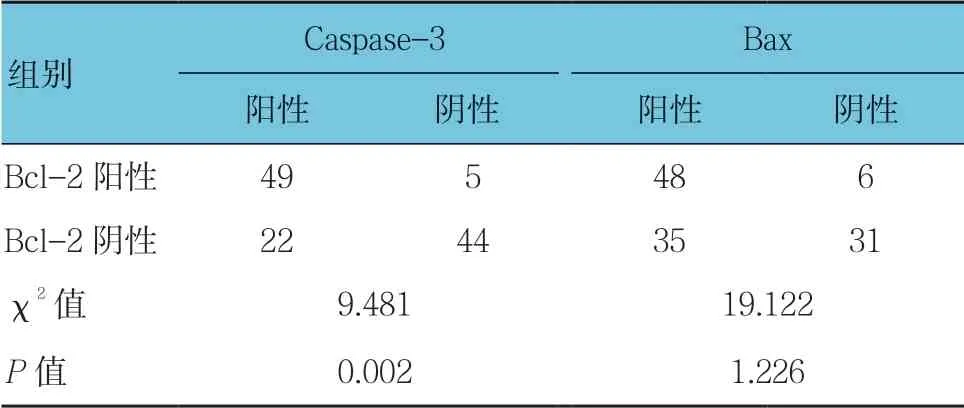
表5 高海拔地区乳腺浸润性导管癌组织中Bcl-2表达与Bax、Caspase-3表达的关系 例
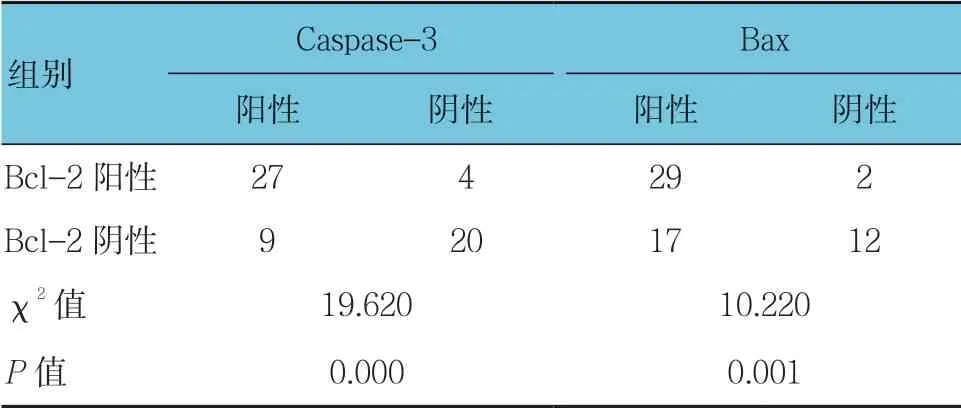
表6 高海拔地区藏族乳腺浸润性导管癌组织中Bcl-2表达与Bax、Caspase-3表达的关系 例

表7 高海拔地区藏族乳腺浸润性导管癌患者AI与临床病理特征的关系 例(%)
3 讨论
乳腺癌的发生、发展与多个癌基因和抑癌基因的失活及细胞增殖与凋亡的失衡有关。高海拔地区独特的高寒、缺氧环境,是该地区藏族乳腺癌的高发病率及高病死率的重要原因。不同民族间凋亡相关蛋白的表达差异的研究相对较少。
Bcl-2在调控细胞凋亡方面起重要作用[7],其表达程度与p53的表达呈负相关,并且与乳腺癌预后呈正相关[8]。体外实验的不同细胞模型中Bcl-2的高表达导致生长抑制,这与Bcl-2抑制细胞凋亡,还与延长细胞周期有关[9]。有研究表明,腋窝淋巴结阳性乳腺癌患者中,Bcl-2的高表达水平对总生存的延长有独立的预测作用[10]。杨黎等[11]研究认为,Bcl-2可用于判断乳腺癌生存预后,并与肿瘤大小、临床分期及淋巴结转移等临床病理因素无关。本研究提示,Bcl-2表达与雌激素受体、孕激素受体表达及淋巴结转移相关,而与年龄、肿瘤大小、组织学分级、临床分期、Ki-67及Her-2表达无关。也有研究表明,Bcl-2表达受雌激素调节。Bcl-2在雌激素受体、孕激素受体阳性乳腺癌中高表达[12-13],这与本研究的结果一致,提示Bcl-2高表达乳腺癌患者采用内分泌治疗效果会更好。
Bax是诱导凋亡基因,其和Bcl-2共同平衡细胞的生存与凋亡。既往研究表明,Bax表达与肿瘤大小相关,>5 cm的乳腺肿瘤中Bax表达更高[14]。SHARIFI等[15]研究认为,Bcl-2/Bax比例影响紫杉醇在乳腺癌化疗中的疗效。杨黎等[11]研究表明,Bax表达与淋巴结转移及肿瘤分期晚有关,并认为Bax与不良的生物学特性相关。本研究结果提示,Bax表达与年龄、肿瘤大小、组织学分级、临床分期、淋巴结转移、雌激素受体、孕激素受体、Ki-67及Her-2表达无关,这可能是由于本研究相关较小的样本量导致,在今后的研究中会考虑扩大样本量来进一步观察结果。
Caspase-3是细胞凋亡的效应器。黑静雅等[16]研究认为,Caspase-3是凋亡的核心蛋白酶,其表达下调和缺失与恶性肿瘤逃避细胞凋亡的自我调节相关。本研究结果提示,高海拔地区乳腺癌Caspase-3的表达与组织学分级、淋巴结转移及雌激素受体表达相关。Caspase-3是乳腺癌临床评价肿瘤生物学及判断预后的参考指标。肿瘤组织AI对肿瘤的发生、发展及预后具有重要作用[17]。本研究结果认为,高海拔地区藏族乳腺浸润性导管癌AI与肿瘤大小、临床分期、孕激素受体表达相关,且AI的表达与民族无关。
综上所述,凋亡相关蛋白的表达对乳腺浸润性导管癌的治疗及预后具有一定的提示作用。中国汉族乳腺癌的研究较多,而少数民族乳腺癌的研究报道相对较少。本研究的结果对高海拔地区的乳腺浸润性导管患者个体化治疗方案的制定,以及预后判断具有提示作用。
