山羊Kruppel样转录因子家族在前体脂肪细胞分化中的表达模式及相关性分析
2019-07-29朱江江林亚秋王永林森
朱江江,林亚秋,王永,,林森
山羊Kruppel样转录因子家族在前体脂肪细胞分化中的表达模式及相关性分析
朱江江1,林亚秋1,王永1,2,林森2
(1青藏高原动物遗传资源保护与利用四川省重点实验室,成都 610041;2青藏高原动物遗传资源保护与利用教育部重点实验室,成都 610041)
【】优化山羊前体脂肪细胞体外培养体系,揭示Kruppel样转录因子家族(KLFs)成员在前体脂肪细胞分化过程中的表达模式。于四川省简阳大哥大牧业有限公司随机选取3只7日龄简州大耳羊为研究对象。放血致死并清洗后,在无菌环境中取其皮下脂肪组织。利用Ⅰ型胶原酶消化法获得其皮下前体脂肪细胞,待细胞长至细胞密度为80%时传代至6孔培养板中(F3代),以“150 μmol·L-1油酸+10 mg·L-1胰岛素”前体脂肪细胞进行成脂诱导,并在诱导分化后0 d、3 d、5 d、7 d收集细胞,Trizol法提取细胞总RNA,利用实时荧光定量PCR(RT-qPCR)检测KLF2-10, KLF 12和KLF15共11个KLF转录因子家族成员在不同分化阶段细胞中的表达水平,并利用皮尔逊系数分析各个成员mRNA总体表达水平之间的相关性。150 μmol·L-1油酸+10 mg·L-1胰岛素处理前体脂肪细胞24 h后细胞中开始出现小脂滴,48 h后脂滴数量增多、体积增大,诱导120 h后脂肪细胞分化程度显著增加。RT-qPCR结果显示,脂肪分化标志基因过氧化物酶体增殖物活化受体γ(PPARγ)基因随着诱导分化的进行其表达水平持续上升,其中在第7天时其表达水平极显著高于其他各组(<0.01)。、、、、和在脂肪细胞中表达水平显著(<0.05)或极显著(<0.01)高于前体脂肪细胞中表达水平,其中和在分化5 d时表达水平最高,和表达水平在7 d时最高,而则在3 d时表达水平最高;和在前体脂肪细胞中的表达水平极显著高于分化后脂肪细胞中的表达水平(<0.01),其中、和的表达水平均在5 d时达到最低,而和则在7 d时表达水平最低;相关性分析结果显示KLF家族各成员mRNA在山羊前体脂肪细胞分化过程中总体表达水平存在相关性,与6个基因具有较强的相关性,其次为和,分别与5个成员具有较强的相关性,而与其他基因均没有较强的相关性。明确了KLF家族在山羊前体脂肪细胞分化过程中的表达模式,解析了各个成员mRNA表达之间的相关性,为阐明山羊前体脂肪细胞分化的分子机制提供重要的基础数据。
山羊;前体脂肪细胞;分化;KLF
0 引言
【研究意义】脂肪组织在动物体内的分布及沉积是影响动物肉质性状的关键因素,其中前体脂肪细胞分化造成细胞体积增大, 是影响动物脂肪沉积的主要方式。前体脂肪细胞分化是一个伴随着细胞形态结构和功能变化的复杂生物过程,是诸多转录因子协同作用的结果[1]。近年越来越多的研究表明Kruppel样转录因子家族(KLFs)可独立或者协同其他转录因子调控脂肪细胞分化[2-3]。探讨KLF家族基因对于脂肪细胞分化的调控作用和理清脂肪细胞分化的调控机制具有重要意义。【前人研究进展】KLF家族是一类具有锌指结构的转录因子,在哺乳动物细胞生长、分化和疾病中发挥重要的调控作用[4]。截止目前KLF家族共有18个成员(即)被发现[5],其中有10个成员(—)可能参与脂肪细胞分化[6],但该结论以小鼠前脂肪细胞系研究结果为主,而且关于同一成员的调控作用存在分歧。BIRSOY等指出是3T3-L1前体脂肪细胞早期分化所必需的转录因子,然而PARK等在2017年却提出了相反的观点,即对3T3-L1前体脂肪细胞分化无影响[7-8]。JIANG等[9]指出可通过调控过氧化物酶体增殖物活化受体γ基因()的表达从而促进猪前体脂肪细胞分化,但对小鼠3T3-L1前体脂肪细胞分化却没有影响,表明该基因作用存在种属特异性。GUO等[10]发现可通过结合的启动子从而促进的转录。青藏高原动物遗传资源保护与利用四川省重点实验室前期分别克隆了藏山羊[11]及简州大耳羊[12]、和[13]序列,并进行了组织表达分析。而对于其他成员而言,是机体红细胞生成的主要调控因子[6],在细胞增殖等方面具有重要的调控作用[14],可调控机体糖酵解过程[15],在神经细胞突出生长具有重要调控作用[16],可抑制肿瘤细胞的增殖和恶化[17],而则是刚发现的家族新成员[5]。目前还没有关于在山羊前体脂肪细胞分化中的研究。因此,在已有研究的基础上,在山羊前体脂肪细胞中验证KLFs家族特别是等脂肪分化相关基因的功能对揭示山羊肌内脂肪沉积的分子调控机制具有重要意义。【本研究切入点】青藏高原动物遗传资源保护与利用四川省重点实验室前期RNA-Seq测序发现转录因子家族基因可能参与山羊脂肪沉积过程,然而其功能研究并不能完全参照鼠源细胞系中的研究结果,必须以体外培养的山羊前体脂肪为研究对象来进行。KLFs家族各个成员的生物学功能不同,有的激活靶基因表达,有的抑制靶基因表达[18]。并且各个成员之间存在相互调控的网络关系[19-20]。然而,KLFs家族各成员在脂肪细胞分化中的表达情况及相关性究竟如何还不清楚。【拟解决的关键问题】为了探究KLFs家族基因在山羊肌内脂肪沉积中的作用,本研究以山羊前体脂肪细胞分化调控为切入点,在优化山羊前体脂肪细胞体外培养的基础上,选择目前已经报道的对细胞分化可能具有调控作用的和(除已有报道外)[13]11个KLFs家族成员为研究对象,利用实时荧光定量PCR(RT-qPCR)检测它们在不同成脂诱导分化阶段细胞中的表达水平,明确在分化过程中的表达模式,分析各个成员之间基因表达的相关性,为进一步阐明KLF转录因子家族网络调控山羊脂肪沉积的作用及分子机制提供重要的基础数据。
1 材料与方法
1.1 试验动物与样品采集
试验于2017年在西南民族大学生命科学与技术学院完成。于四川省简阳大哥大牧业有限公司随机选择3只7日龄的简州大耳羊羔羊为试验动物。羔羊带回实验室后放血致死,消毒后解剖取其皮下脂肪组织用于细胞培养。
1.2 主要试剂
I型胶原酶、油酸、牛血清白蛋白和胰岛素购自Sigma公司产品,胰蛋白酶和DMEM/ F12培养基购自Hyclone公司产品,胎牛血清购自Gemini公司产品。SYBR®Premix ExTM (2×)购自大连TaKaRa公司,2×PCR Master Mix和Revert Aid First Strand cDNA Synthesis Kit购自Thermo公司。总RNA提取试剂盒购自天根生化科技(北京)有限公司。
1.3 山羊前体脂肪细胞的分离培养
将3只7日龄的简州大耳羊颈动脉放血后用新洁而灭清洗2—3次,再用75%酒精擦拭消毒,在无菌环境中取其皮下脂肪组织,用含3倍双抗的PBS清洗3次后将其剪碎,等量混合3只羔羊组织样品后加入2倍体积的I型胶原酶消化1 h(每5 min震荡一次),并加入等体积的10%胎牛血清培养液终止消化。滤液分别过200目和400目后分装到离心管中,2 000 r/min离心5 min,弃上清,加入红细胞裂解液静置5 min,2 000 r/min离心5 min,弃上清,用PBS洗3遍后,取适量的重悬液分别接种到25 cm2的培养瓶中,加入适量完全培养基混匀后,于37℃,5% CO2的培养箱中培养,隔2 d更换新鲜培养基。
1.4 山羊前体脂肪细胞的传代培养及诱导分化
当原代细胞长至80%细胞密度时,用0.25%胰蛋白酶消化2 min,弃掉胰蛋白酶,加入适量完全培养基终止消化,1 000 r/min离心3 min,加入适量完全培养基混匀后,按照1﹕3传代接种于25 cm2的培养瓶中在37℃,5% CO2的培养箱中培养,隔2 d换液。待细胞长至80%细胞密度时再传代2次最后至6孔培养板中(即F3代),然后用含150 μmol·L-1油酸+10 mg·L-1胰岛素的完全培养基培养至不同时间收集用于基因表达模式的检测。
1.5 基因表达检测
分别取诱导0、3、5和7 d的F3代细胞(每个时间点3个重复),利用RNA提取试剂盒提取总RNA,按照反转录试剂盒说明书以 Oligo (dT) 为引物合成cDNA第一链。利用 Primer Premier5.0 软件,根据本实验室前期提交GenBank数据库的山羊(、和)序列设计特异引物(表1),利用RT-qPCR检测它们在不同成脂诱导分化时间段中的表达水平。RT-qPCR反应体系如下:SYBR®Premix ExTM (2×) PCR 10 μL,10 μmol·L-1上下游引物各0.5 μL,模板cDNA 1 μL,ddH2O 8 μL。二步法PCR反应条件:预变性95℃ 1 min;PCR过程95℃ 30 s,60℃/62℃ 30 s,40个循环;添加溶解曲线95℃15 s,60℃30 s,95℃15 s;保存4℃forever。
1.6 数据统计分析
时序表达数据定量分析以诱导分化0 d的细胞Ct值为对照来计算,结果用2−△△Ct法进行统计分析。最终结果以SPSS 18.0软件中的One-way ANOVA进行显著性检验分析,采用Duncan法对各阶段mRNA表达进行多重比较。并利用SPSS对各时期基因表达水平总体数据进行相关性分析,利用r值代表基因表达水平相关性。利用Cytoscape3.2.0对得到的相关性结果进行网络分析,设置阈值位r>0.7。
2 结果
2.1 山羊前体脂肪细胞分化过程中的形态学变化
当细胞传至F3代长至80%细胞密度后,加入诱导分化液培养24 h后细胞中开始出现小脂滴(图1-A),48 h后脂滴数量增多、体积增大(图1-B、C),诱导120 h后脂肪细胞分化程度显著增加(图1-D),脂滴经油红O染色后可被染成橘红色。

表1 引物信息
S:正义链引物; A:反义链引物; GAPDH:甘油醛-3-磷酸脱氢酶
S: Sense primer; A: Antisense primer; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase
2.2 转录因子KLF家族成员的表达模式
RT-qPCR结果显示,PPARγ基因随着诱导分化的进行其表达水平持续上升,其中在第7天时其表达水平极显著高于其他各组(<0.01)(图2)。家族11个成员在山羊前体脂肪细胞分化过程中均被检测到,其表达模式可大概分为两种,一种是在脂肪细胞中的表达水平显著或极显著高于前体脂肪细胞中表达水平(、、、、和);另外一种是在前体脂肪细胞中的表达水平极显著高于脂肪细胞中的表达水平(、、、和)(图3、4)。
其中在第一种表达模式中和的表达趋势相似,均是随着分化的进行其表达水平逐渐升高,且第7天表达水平最高,极显著高于在前体脂肪细胞中的表达水平(<0.01);和表达趋势相似,均是诱导分化第5天的表达水平显著高于在前体脂肪细胞中的表达水平(<0.05);同时结果显示,在诱导分化第3天的表达极显著高于其在前体脂肪细胞中的表达水平(<0.01),在诱导分化的第3天和第5天的表达水平极显著高于其在前体脂肪细胞中的表达水平(<0.01)。
另外一种表达模式比较单一,均是在前体脂肪细胞中的表达水平极显著高于诱导分化后各个时间段的表达水平(<0.01)。

A. 诱导培养第24小时;B. 诱导培养48 h;C. 诱导培养72 h;D. 诱导培养120 h

不同大写字母表示P<0.01,不同小写字母表示P<0.05。下同
2.3 转录因子KLF家族各成员间表达相关性分析
本试验分析了家族各成员在山羊前体脂肪细胞分化过程中基因表达水平之间的相关性,结果显示家族这11个成员的mRNA表达水平均存在正相关或负相关,且与之间存在极显著正相关(<0.01),与存在显著负相关(<0.05);与、、、和之间存在极显著的负相关(<0.01);和、存在显著的正相关(<0.05),与和存在极显著的正相关(<0.01),与存在显著的负相关(<0.05);与存在显著的正相关(<0.05),与存在极显著的负相关(<0.01);与、、存在显著或极显著的正相关(<0.05或<0.01),与和存在极显著的负相关(<0.01)。相关性网络分析发现,与6个基因具有较强的相关性,其次为和,分别与5个成员具有较强的相关性,而与其他基因均没有较强的相关性(表2,图5)。
3 讨论
3.1 山羊前体脂肪细胞体外培养体系的优化
建立动物前体脂肪细胞体外培养模型是阐明动物脂肪沉积分子机理的重要手段,本实验室前期试验发现体外培养的简州大耳羊前体脂肪细胞传至第3代后,其自发分化能力则显著下降。因此确定适合山羊前体脂肪细胞的有效诱导剂对阐明脂肪细胞分化机制具有非常重要的理论与实际意义。综合目前国内外不同动物前体脂肪细胞诱导分化的方法,发现不同动物(如猪、牛、鸡、草鱼和绵羊等)所用的诱导剂存在差别[21-24]。本试验发现“油酸+胰岛素”可有效诱导简州大耳羊前体脂肪细胞分化,且在诱导分化的第5天分化率达到90%以上。这与曲贞晓和杜琛等[25-26]在崂山奶山羊和内蒙古绒山羊所用的方法相比缩短了前体脂肪细胞完全分化的时间,为进一步研究山羊脂肪细胞分化、脂代谢的分子机制提供更好的模型。CHEGURU等[27]也指出油酸+胰岛素可有效促进3T3- L1前体脂肪细胞中脂滴的积聚并伴随着、aP2转录因子()和硬脂酰辅酶A去饱和酶1()基因表达的升高。SHANG等[21]指出160 μmol·L-1油酸可诱导鸡前体脂肪细胞分化,DING等[28]指出50—300 μmol·L-1油酸可通过促进aP2基因的表达(但、转录因子CCAAT/增强子结合蛋白α()和脂蛋白脂酶()基因表达未发生变化)进而促进猪前体脂肪细胞分化。本研究发现不同浓度的油酸(0、50、100、150、300 μmol·L-1)对山羊前体脂肪细胞的成脂诱导效果并不相同,使用150 μmol·L-1具有最好的成脂诱导效果。此外,ADINA等[29]发现使用10 mg·L-1的胰岛素具有较好的诱导成脂分化的效果。因此本研究在前期试验和前人研究结果的基础上,选择150 μmol·L-1油酸+10 mg·L-1胰岛素处理山羊前体脂肪细胞,结果显示成脂诱导效果良好。综上所述,不同动物前体脂肪细胞具有最适合的独特诱导剂,即使同一诱导剂其最佳浓度也可能存在差异。

不同大写字母表示P<0.01,不同小写字母表示P<0.05
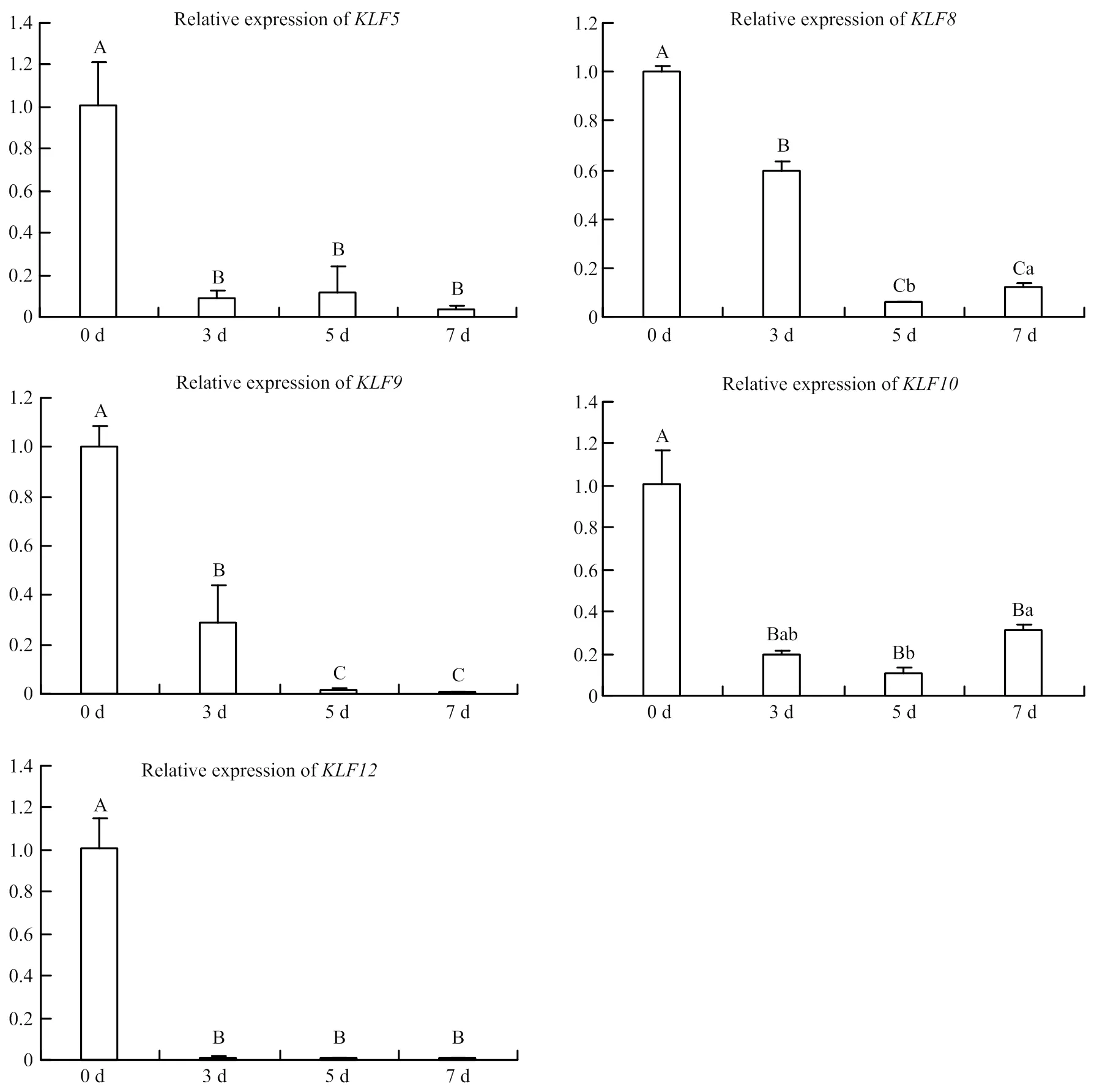
不同大写字母表示<0.01,不同小写字母表示<0.05
Different capital letters represents<0.01, different lower-case letters represents<0.05
图4 山羊脂肪细胞分化过程中、、、和的表达情况
Fig. 4 The expression of,,,andduring preadipocyte differentiation

表2 KLF家族各成员间表达水平的相关性
*表示差异显著(<0.05),**表示差异极显著(<0.01);#表示进行相关分析的诱导分化时间为0—5 d,其余的为0—7 d
*represents<0.05, ** represents<0.01, #represents the analyses based on 0-5 days after cell differentiation inducing, the rest data based on 0-7 days after cell differentiation inducing

图5 山羊KLF家族基因相互关系网络图
3.2 KLFs在山羊前体脂肪细胞分化过程中的表达模式
基于转录因子在前体脂肪细胞分化中所占的重要地位,检测转录因子在山羊前体脂肪细胞中的表达模式是阐明山羊前体脂肪细胞分化分子机理的基础。本研究检测了脂肪细胞分化标志基因、脂肪细胞确定分化依赖因子1()和在山羊成脂分化过程中的表达谱。结果发现和(数据未显示)的表达水平随着分化的进行而持续增高,从而进一步证明了本文所选诱导剂的可行性。家族成员在山羊成脂分化过程中的表达模式可大概分为两类,一类是分化的脂肪细胞中表达水平显著或极显著高于前体脂肪细胞中表达水平(、、、、和),推测这些成员可能在山羊前体脂肪细胞分化中发挥正调控作用;另一类是前体脂肪细胞中的表达水平极显著高于分化的脂肪细胞中的表达水平(、、、和),推测这些成员可能在山羊前体脂肪细胞分化中发挥负调控作用。这些结果与其他学者在人、小鼠和鸡上的研究结果存在着一些相似及不同之处,下面分别就相似及不同之处进行对比分析。
3.2.1、、、、和表达模式分析 本研究发现在诱导分化第7天的山羊脂肪细胞中表达极显著高于其在前体脂肪细胞中的表达水平,这与其他学者提出的在人和小鼠的前体脂肪细胞中存在高水平表达的结果不同[30-31]。SUE等[32]指出随3T3-L1前体脂肪分化,表达水平呈下降趋势,且可能依赖于C-末端结合蛋白()蛋白来抑制在3T3-L1前体脂肪细胞分化。但本文却发现其在诱导分化第5天的山羊脂肪细胞中的表达显著高于在前体脂肪细胞中的表达。随山羊前体脂肪细胞分化的进行其表达水平逐渐升高,这与Birsoy等[7]在3T3-L1中的报道相似,但与EISENSTEIN等[33]在小鼠中的报道不同。在诱导分化第3天的山羊脂肪细胞中表达极显著高于其在前体脂肪细胞中的表达水平,这与其在鸡前体脂肪细胞中高表达的报道不同[34]。和在山羊前体脂肪细胞成脂分化过程中的表达模式与它们在3T3-L1前体脂肪细胞分化中的表达模式相似,并且研究指出可能通过抑制前脂肪细胞因子1(PREF1)来促进3T3-L1前体脂肪细胞分化[35]。在鸡前体脂肪细胞分化中表达量显著增加,但在不同发育阶段皮下脂肪组织中表达水平却无变化[36],推测其可能在动物组织与细胞中存在不同的调控途径。此外,研究发现除了自身可调控脂肪细胞分化外,还可作为关键的转录因子介导其他调控因子对脂肪细胞分化的调控[3,37],进一步证明了该基因的重要作用。
3.2.2、、、和表达模式分析、、、和在山羊前体脂肪细胞中的表达水平均极显著高于在诱导分化细胞中的表达水平。OISHI 等[38]指出在3T3-L1前体脂肪细胞被诱导1 h后就检测到表达,诱导3 h检测到表达峰值,且可协同C/EBPβ和C/EBPδ激活PPARγ来促进3T3-L1脂肪细胞分化。本研究结果与之不同的原因可能是检测的诱导分化时间点跨度较大,推测可能在前体脂肪细胞诱导早期发挥作用[39]。和在山羊和3T3-L1前体脂肪细胞分化中的表达模式不同。Lee等[40]指出在3T3-L1前体脂肪细胞诱导36 h后检测到表达,并且荧光素酶报告实验证明超表达可促进和启动子的活性,提示可能通过促进和的表达来促进脂肪细胞分化。Pei等[41]指出可能是调控3T3-L1前体脂肪细胞中期分化阶段的重要转录因子,且这种调控作用主要通过影响和的表达水平来进行的。目前尚未见和在脂肪细胞分化、脂代谢和脂肪沉积中的相关报道。
3.3 KLF家族各成员在山羊前体脂肪细胞分化过程中相关性
研究表明,KLFs家族有些成员的表达可以调控同一家族其他成员的表达,即等级调控,在功能上体现为协同或者拮抗作用[19-20]。但目前关于KLFs各个成员之间的网络调控关系报道在脂肪细胞分化中研究较少,无法精确构建其调控网络。因此本研究系统分析了家族11个成员在山羊前体脂肪细胞分化过程中的相关性,结果指出这11个成员均存在正相关或负相关即可能发挥协同或者拮抗作用,并且与、和这三个成员存在显著相关的成员较多,推测它们可能在网络级联中处于重要位置。与在红细胞生成中具有相互调控作用[19,42]。Eaton等[21]在小鼠胎儿肝脏细胞系中研究表明可以激活和的表达,而则可以抑制介导的的活化,三者之间形成了交互调控的网络。FUNNELL等[43]发现和在胚胎发育过程中具有重叠作用。本研究也发现与在山羊前体脂肪细胞分化过程中也存在显著相关,推测在这个过程中可能具有相互调控作用。本文还发现、和处于相关性网络的中心位置,分别与6个、5个、5个基因具有较强的相关性,推测这些基因可能在山羊前体脂肪细胞分化过程中具有重要作用。
4 结论
油酸+胰岛素可有效诱导山羊前体脂肪细胞分化;、、、、和在分化的脂肪细胞中表达水平显著或极显著高于前体脂肪细胞中表达水平;、、、和在前体脂肪细胞中的表达水平显著或极显著高于分化的脂肪细胞中的表达水平。、和在山羊前体脂肪细胞分化调控过程中可能具有重要的调控作用。这些结果为进一步阐明转录因子家族在山羊前体脂肪细胞分化中的调控作用提供重要的数据支撑。
[1] STEPHENS J M. The fat controller: adipocyte development., 2012, 10(11): e1001436.
[2] KACZYNSKI J, COOK T, URRUTIA R. Sp1 and Kruppel-like transcription factors., 2003, 4(2): 206.
[3] LEE D S, CHOI H, HAN B S, Kim W K, Lee S C, Oh K J, Bae K H. c-Jun regulates adipocyte differentiation via the KLF15-mediated mode., 2016, 469(3): 552-558.
[4] WU Z N, WANG S Q. Role of kruppel-like transcription factors in adipogenesis., 2013, 373(2): 235-243.
[5] PEI J, GRISHIN N V. A new family of predicted Krüppel-like factor genes and pseudogenes in placental mammals., 2013, 8(11): e81109.
[6] WEI S J, ZHANG L F, ZHOU X, DU M, JIANG Z H, HAUSMAN G J, BERGEN W G, ZAN L S, DODSON M V. Emerging roles of zinc finger proteins in regulating adipogenesis., 2013, 70(23): 4569-4584.
[7] BIRSOY K, CHEN Z, FRIEDMAN J. Transcriptional regulation of adipogenesis by KLF4., 2008, 7(4): 339-347.
[8] PARK Y K, WANG L M, GIAMPIETRO A, LAI B B, LEE J E, GE K. Distinct roles of transcription factors KLF4, Krox20 and PPARγ in adipogenesis., 2017, 37(2): e00554-16.
[9] JIANG S Z, WEI H K, SONG T X, YANG Y, ZHAGN F, ZHOU Y F, PENG J, JIANG S W. KLF13 promotes porcine adipocyte differentiation through PPARγ activation., 2015, 5: 28.
[10] GUO H F, KHAN R, RAZA S H A, NING Y, WEI, D W, HOSSEINI S M, ULLA I, GARCIA M D, ZAN L S. KLF15 promotes transcription of KLF3 gene in bovine adipocytes., 2018, 659(15): 77-83.
[11] 池永东, 王永, 朱江江, 林森, 赵越, 林亚秋. 藏山羊KLF8基因克隆及组织表达分析. 基因组学与应用生物学, 2019, 38(2): 478-502.
CHI Y D, WANG Y, ZHU J J, LIN S, ZHAO Y, LIN Y Q. Cloning and tissue expression analysis of klf8 gene in Tibetan goat., 2019, 38(2): 478-502. (in Chinese)
[12] 田苗, 左璐璐, 张小玉, 柏雪, 江明锋, 林亚秋. 牦牛基因克隆及组织表达分析. 黑龙江畜牧兽医, 2017, 17(09/1): 234-236.
TIAN M, ZUO L L, ZHANG X Y, BAI X, JIANG M F, LIN Y Q. Cloning and tissue expression analysis ofgene in Yak., 2017, 17(09/1): 234-236. (in Chinese)
[13] 朱江江, 林亚秋, 王永, 李倩, 林森, 熊朝瑞, 俄木曲者. 山羊KLF13 基因的克隆及表达分析. 农业生物技术学报. 2017, 25(1): 102-109.
ZHU J J, LIN Y Q, WANG Y, LI Q, LIN S, XIONG C R, EMU Q Z. Cloning and expression analysis of goat ()gene., 2017, 25(1): 102-109. (in Chinese)
[14] NEVE B, FERNANDEZ-ZAPICO M E, ASHKENAZI-KATALAN V, DINA C, HAMID Y H, JOLY E, VAILLANT E, BENMEZROUA Y, DURAND E, BAKAHER N, DELANNOY V, VAXILLAIRE M, COOK T, DALLINGA-THIE G M, JANSEN H, CHARLES M A, CLEMENT K, GALAN P, HERCBERG S, HELBECQUE N, CHARPENTIER G, PRENTKI M, HANSEN T, PEDERSEN O, URRUTIA R, MELLOUL D, FROGUEL P. Role of transcription factor KLF11 and its diabetes-associated gene variants in pancreatic beta cell function.2005, 102(13): 4807-4812.
[15] Wu G, YUAN S, CHEN Z, CHEN G, FAN Q, DONG H, YE F, LI J, ZHU X. The KLF14 transcription factor regulates glycolysis by downregulating LDHB in colorectal cancer., 2019, 15(3): 628-635.
[16] WANG J, GALVAO J, BEACH K M, LUO W, URRUTIA R A, GOLDBERG J L, OTTESON D C. Novel roles and mechanism for Kruppel-like Factor 16 (KLF16) regulation of neurite outgrowth and ephrin receptor A5 (EphA5) expression in retinal ganglion cells., 2016, 291(35): 18084-18095.
[17] ALI A, ZHANG P, LIANGFANG Y, WENSHE S, WANG H, LIN X, DAI Y, FENG X H, MOSES R, WANG D, LI X, XIAO J. KLF17 empowers TGF-β/Smad signaling by targeting Smad3-dependent pathway to suppress tumor growth and metastasis during cancer progression., 2015, 6(3): e1681.
[18] PEARSON R, FLEETWOOD J, EATON S, CROSSLEY M, BAO S. Krüppel-like transcription factors: a functional family., 2008, 40(10): 1996-2001.
[19] FUNNELL A P W, MALONEY C A, THOMPSON L J, KEYS J, TALLACK M, PERKINS A C, CROSSLEY M. Erythroid Kruppel- like factor directly activates the basic Kruppel-like factor gene in erythroid cells., 2007, 27(7): 2777-2790.
[20] EATON S A, FUNNELL A P W, SUE N, NICHOLAS H, RICHARD C M, CROSSLEY M. A network of Krüppel-like factors (Klfs)., 2008, 283(40): 26937-26947.
[21] 郭红芳, 昝林森, 孙永刚. 牛前体脂肪细胞的分离培养及诱导分化. 西北农林科技大学学报(自然科学版), 2012, 42(2): 1-6.
GUO H F, ZAN L S, SUN Y G. Primary culture and differentiation of bovine preadipocytes., 2012, 42(2): 1-6. (in Chinese)
[22] SHANG Z C, GUO L, WANG N, SHI H, WANG Y X, LI H. Oleate promotes differentiation of chicken primary preadipocytes., 2014, 34(1): e00093.
[23] 吉红, 曹艳姿, 林亚秋, 刘品, 卢荣华, 苏尚顺, 杨公社, 奥宏海. 草鱼前体脂肪细胞的原代培养. 水生生物学报, 2009, 33(6): 1226-1230.
JI H, CAO Y Z, LIN Y Q, LIU P, LU R H, SU S S, YANG G S, AO H H. Primary culture of grass carp preadipocyte in vitro., 2009, 33(6): 1226-1230. (in Chinese)
[24] 蔡勇, 阿依木古丽, 杨具田, 马忠仁, 卢建雄, 臧荣鑫, 吴建平. 绵羊前体脂肪细胞的原代培养及分化. 动物营养学报, 2010, 22(6): 1768-1774.
CAI Y, AYIMUGULI, YANG J T, MA Z R, LU J X, ZANG R X, WU J P. Primary culture and differentiation of Ovine preadipocytes., 2010, 22(6): 1768-1774. (in Chinese)
[25] 曲贞晓, 刘金凤, 姜颖, 潘庆杰. 山羊前体脂肪细胞体外培养试验. 青岛农业大学学报(自然科学版), 2013, 30(1): 1-5.
QU Z X, LIU J F, JIANG Y, PAN Q J. The culture experiment of goats preadipocytes in vitro., 2013, 30(1): 1-5. (in Chinese)
[26] 杜琛, 付绍印, 韩志玲, 孟丽云, 爱伦高娃, 高丽霞, 成立新, 张文广, 李金泉. 绒山羊肌内前体脂肪细胞的基因表达分析. 畜牧兽医学报, 2013, 44(10): 1532-1538.
DU C, FU S Y, HAN Z L, MENG L Y, AILUN G W, GAO L X, CHENG L X, ZHANG W G, LI J Q. Gene expression analysis on intramuscular preadipocytes in the cashmere goats., 2013, 44(10): 1532-1538. (in Chinese)
[27] CHEGURU P, CHAPALAMADUGU K C, DOUMIT M E, MURDOCH G K, HILL R A. Adipocyte differentiation-specific gene transcriptional response to C18 unsaturated fatty acids plus insulin., 2012, 463(3): 429-447.
[28] DING S T, WANG J C, MERSMANN H J. Effect of unsaturated fatty acids on porcine adipocyte differentiation., 2003, 23(8): 1059-1069.
[29] ADINA K S, ROBERT Y H, M. DANIEL L. Induction of fatty acid synthetase synthesis in differentiai 3T3-Ll preadipocytes., 1980, 255(25): 4745-4750.
[30] BANERJEE S S, FEINBERG M W, WATANABE M, GRAY S, HASPEL R L, DENKINGER D J, KAWAHARA R, HAUNER H, JAIN M K. The Kruppel-like factor KLF2 inhibits peroxisome proliferator-activated receptor-gamma expression and adipogenesis., 2003, 278(4): 2581-2584 .
[31] LEE H, KANG R, KIM Y S, CHUANG S I, YOON Y. Platycodin D inhibits adipogenesis of3T3-L 1 cells by modulating kruppel-like factor 2 and peroxisome proliferator-activated receptor γ., 2010, 24(S2): S161-S167.
[32] SUE N,JACK B H A,EATON S A,PEARSON R C M, FUNNELL A P W, TURNER J, CZOLIJ R, DENYER G, BAO S S, MOLERO-NAVAJAS J C, PERKINS A, FUJIWARA Y, ORKIN S H, BELL-ANDERSON K, CROSSLEY M. Targeted disruption ofthe basic Kriippel-like factor gene (Klf3) reveals a role in adipogenesis., 2008, 28(12): 3967-3978.
[33] EISENSTEIN A, CARROLL S H, JOHNSTON-COX H, FARB M, GOKCE N, RAVID K. An adenosine receptor-Krüppel-like factor 4 protein axis inhibits adipogenesis., 2014, 289(30): 21071-21081.
[34] ZHANG Z W, WANG H X, SUN Y N, LI H, WANG N. Klf7 modulates the differentiation and proliferation of chicken preadipocyte., 2013, 45(4): 280-288.
[35] LI D, YEA S, LI S, CHEN Z, NORLA G, BANCK M, LABORDA J, TAN S, FRIEDMAN J M, FRIEDMAN S L, WALSH M J. Kruppel- like factor-6 promotes preadipocyte differentiation through histone deacetylase 3-dependent repression of DLK1., 2005, 280(29): 26941-26952.
[36] MATSUBARA Y, AOKI M, ENDO T, SATO K. Characterization of the expression profiles of adipogenesis-related factors, ZNF423, KLFs and FGF10, during preadipocyte differentiation and abdominal adipose tissue development in chickens., 2013, 165(3): 189-195.
[37] AHMED M, GAFFEN S L. IL-17 inhibits adipogenesis in part via C/EBPα, PPARγ and Krüppel-like factors., 2013, 61(3): 898-905.
[38] OISHI Y, MANABE I, TOBE K, SHINDO T, FUJIU K, NISHIMURA G, MAEMURA K, YAMAUCHI T, KUBOTA N, SUZUKI R, KITAMURA T, AKIRA S, KADOWAKI T, NAGAI R. Kruppel-like transcription factor KLF5 is a key regulator of adipocyte differentiation., 2005, 1(1): 27-39.
[39] CERVANTES-CAMACHO C, BELTRÁN-LANGARICA A, OCHOA- URIBE A K, Marsch-Moreno M, Ayala-Sumuano JT, Velez- delValle C, Kuri-Harcuch W. The transient expression of Klf4 and Klf5 during adipogenesis depends on GSK3β activity., 2015, 4(4): 248-255.
[40] LEE H, KIM H J, LEE Y J, LEE M Y, CHOI H, LEE H, KIM J W. Krüppel-like factor KLF8 plays a critical role in adipocyte differentiation., 2012, 7(12): e52474.
[41] PEI H, YAO Y, YANG Y, LIAO K, WU J R. Krüppel-like factor KLF9 regulates PPARγ transactivation at the middle stage of adipogenesis., 2011, 18(2): 315-327.
[42] ILSLEY M D, GILLINDER K R, MAGOR G W, Huang S, Bailey T L, Crossley M, Perkins A C . Krüppel-like factors compete for promoters and enhancers to fine-tune transcription., 2017, 45(11): 6572-6588.
[43] FUNNELL A P, MAK K S, TWINE N A, PELKA G J, NORTON L J, RADZIEWIC T, POWER M, WIKINS M R, BELL-ANDERSON K S, FRASER S T, PERKINS A C, TAM P P, PEARSON R C M, CROSSLEY M. Generation of mice deficient in both KLF3/BKLF and KLF8 reveals a genetic interaction and a role for these factors in embryonic globin gene silencing., 2013, 33(15): 2976-2987.
Expression Profile and Correlations of Kruppel Like Factors During Caprine () Preadipocyte Differentiation
ZHU JiangJiang1, LIN YaQiu1, WANG Yong1,2, LIN Sen2
(1Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Utilization Key Laboratory of Sichuan Province, Chengdu 610041;2Key Laboratory of Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Utilization (Southwest Minzu University), Ministry of Education, Chengdu 610041)
【】The aim of this study was to optimize the culture system of goat preadipocytes in vitro and elucidate the expression patterns of Kruppel like factors (KLFs) during preadipocytes differentiation.】Three 7-day-old Jianzhou Big-Eared goats were selected randomly from Sichuan Jianyang DAGEDA Animal Husbandry Co. Ltd. as experimental animal. After bloodletting death of goats, their subcutaneous fat tissues were collected in a sterile room. The goat subcutaneous preadipocytes were collected using collagenase I digestion method. The cells at Generation Three were then passaged to a 6-well plate when the cells were grown to 80% density. The combined use of were used for preadipocytes differentiate inducing. The cells were then collected after cultivation for 0 d, 3 d, 5 d and 7 d. The total RNA was extracted by using Trizol method. Real-time fluorescent quantitative PCR (RT-qPCR) was performed to determine the expression levels of 11 members of KLFs, including KLF2-10, KLF12 and KLF15, during goat preadipocytes differentiation. Pearson correlation coefficient was used for expression correlation analysis between KLF individuals.【】The results showed that the combined use of 150 μmol·L-1oleic acid and 10 mg·L-1insulin promoted the formation of small lipid droplets after 24 h cultivation. After 48 h, the lipid droplets became bigger and much more. The differentiation of the preadipocytes were enhanced significantly after 120 h comparing with preadipocytes at 0 h. The results of RT-qPCR showed that the combined use of oleic acid and insulin stimulated the expression of peroxisome proliferator-activated receptor-gamma () continuously companying the differentiation of preadipocytes, and toped at 7 d which significantly higher than other groups (<0.01). The expression levels of,,,,and<0.05) or extremely significantly (<0.01) higher than those in preadipocytes. While the expression of,andwere topped at 5 d, theandtoped at 7 d. However, theexpressed most at 3 d. For the other KLF individuals, the expression levels of,,,andextremely significantly higher (<0.01) than those in adipocytes. The expression of,andbottomed at 5 d, while that of theandbottomed at 7 d. Correlation analysis showed that KLF individual significantly (<0.05) correlated with each other across cell differentiation.was strongly correlated with 6 individuals, followed byandboth of which were significantly correlated with 5 individuals. However,was not significantly correlated with other individuals. 【】In this study, the expression patterns of KLFs during goat preadipocytes differentiation were clarified, and also the correlations among KLF individuals. These results provided important basic data for elucidating the molecular mechanism of goat preadipocytes differentiation.
goat; preadipocytes; differentiation; Kruppel like factors
10.3864/j.issn.0578-1752.2019.13.012
2018-01-24;
2019-05-10
国家重点研发计划(2018YFD0502002)、国家自然科学基金(31672395)、四川省“十三五”畜禽育种攻关项目(2016NYZ0045)、中央高校基本科研业务费专项基金(2017NGJPY06)、青藏高原生态畜牧业协同创新中心开放基金(QZGYXT01)
朱江江,E-mail:zhujiang4656@hotmail.com。
林亚秋,E-mail:linyq1999@163.com
(责任编辑 林鉴非)
