水稻裂颖突变体sh1的鉴定及基因定位
2019-07-29潘孝武刘文强黎用朝熊海波盛新年段永红余亚莹赵文锦魏秀彩李小湘
潘孝武 刘文强 黎用朝 熊海波 盛新年 段永红 余亚莹 赵文锦 魏秀彩 李小湘
水稻裂颖突变体的鉴定及基因定位
潘孝武 刘文强 黎用朝 熊海波 盛新年 段永红 余亚莹 赵文锦 魏秀彩 李小湘*
(湖南省农业科学院 水稻研究所/农业部长江中下游籼稻遗传育种重点实验室, 长沙 410125;*通讯联系人, E-mail: xiaoxiang66196@126.com)
【】本研究旨在定位和克隆水稻裂颖基因,为解析水稻裂颖性的遗传机制提供依据。从籼稻品种湘早籼6号突变体库中筛选出一个裂颖突变体(,),观察突变体的花器官和浆片形态,利用突变体与02428的F2群体定位目标基因,进一步通过定量PCR分析相关基因的表达情况。突变体的颖花形态与野生型基本一致,能正常开花,但不能正常闭颖,裂颖的主要原因是浆片不能在开颖后正常萎蔫。突变体的有效穗数增加,但结实率和千粒重显著下降;遗传分析表明,的裂颖表型受一对隐性核基因控制。将基因定位在ID19827与ID19884两个InDel标记之间,物理距离约为110 kb。定位区间测序发现,突变体中丙二烯氧化合酶编码基因发生单碱基突变,导致氨基酸发生改变;基因的突变显著降低了花器官中的茉莉酸含量,进而影响了茉莉酸合成及信号转导相关基因的表达。基因通过影响茉莉酸的合成和信号转导调控水稻闭颖,可能是基因的候选基因。
水稻;颖花闭合;浆片;基因定位;茉莉酸
水稻种子裂颖(不闭合或不完全闭合)是水稻生产中一种常见的现象,特别是在不育系中广泛存在。裂颖会引起水稻种子霉变、穗上发芽、耐储性下降等[1-2],已经成为杂交水稻种子生产及储藏的重要限制因素。因此,鉴定和克隆水稻裂颖基因,对于水稻遗传研究和种子生产都具有重大的意义。
水稻的颖花从外到内依次由1个外稃、1个内稃、2个浆片、6枚雄蕊和1枚雌蕊构成。颖花开放时,浆片快速吸水膨大,使外稃和内稃的钩合点松开,同时花丝快速伸长,使花药伸出颖壳并裂开,花粉散落,完成授粉过程[3];授粉完成后,浆片失水萎缩使内外颖重新闭合并相互钩合。部分颖花的内外颖不能完全闭合,或内外颖虽能勉强闭合但不能严密勾合而形成裂颖种子[4]。水稻的裂颖性在不同的品种资源中差异较大[5]。但由于水稻的裂颖性易受到环境因素的影响[6],目前利用品种间自然变异开展裂颖性基因定位的研究还未见报道。发掘裂颖相关突变体,是研究裂颖性遗传机制的重要途径。孙廉平等[7]筛选到一个颖花发育异常的突变体(),其内外稃开裂不抱合,且在雄蕊和柱头之间形成类似于内外稃的结构,该突变表型与陈立凯等[8]发掘的突变体的表型一致,都是由于基因的突变引起的。曾生元等[9]发现一个裂颖突变体,该突变体不仅颖壳不闭合,且伴随着生育期提前、植株变矮、颖花退化等,目标基因定位在第1染色体上一个约47 kb的区间内。沈亚林等[10]利用持续开颖突变体,将目标基因定位到第5染色体上一个约113 kb的区间内。另外,Li等[11]筛选到裂颖突变体,突变体的颖壳形态正常,但不能正常闭合且结实率降低,候选基因编码12-氧代植物二烯酸还原酶,在植物体内参与茉莉酸(Jasmonic acid,JA)的生物合成。利用另一个开颖突变体,Li等[12]进一步证明通过影响浆片中的代谢过程,调控浆片萎蔫和颖壳闭合。
茉莉酸是一类重要的植物激素,参与植物的生长发育、次生代谢等多种生物学过程,并介导植物对生物逆境和非生物逆境的应答反应[13-15]。植物体内的茉莉酸由游离的亚麻酸经过脂肪氧合酶途径合成[14, 16-17]。叶绿体膜脂在脂酶的催化下生成α-亚麻酸(linolenic acid,LA),然后在脂氧合酶(lipoxygenase,LOX)的催化下转化成13-氢过氧化亚麻酸(13-hydroperoxylinolenic acid,13-HPOT),后者在AOS以及丙二烯氧化环化酶(allene oxide cyclase,AOC)的催化下生成12-氧代植物二烯酸(12-oxophytodienoic acid,OPDA);OPDA随后运输至过氧化物酶体中,经过12-氧代植物二烯酸还原酶(OPDA reductase,OPR)的还原作用,再经过3步β-氧化过程最终形成茉莉酸。拟南芥的一个磷脂酶基因突变后,花器官中的茉莉酸含量下降,引起花药开裂受阻,花粉活力和育性明显下降[18]。拟南芥AOS的突变同样引起相似的表型,外源施用茉莉酸或者茉莉酸甲酯(Methyl jasmonate,MeJA)均可回复突变体的表型[19]。在水稻中,外源JA能够诱导颖花开放[20],且细胞质雄性不育系比普通水稻对茉莉酸更加敏感[21]。Liu等[22]的研究表明,细胞质雄性不育系的花时比较分散,主要是因为浆片中的茉莉酸含量下降,引起花丝伸长和浆片膨胀受阻。另外,水稻花器官中的茉莉酸含量在开花时明显上升[23],大量与茉莉酸合成及信号转导相关的基因在开花前后差异表达[24]。这些研究都表明,茉莉酸在颖花开放和闭合过程中扮演重要作用。
本实验室利用化学诱变水稻品种湘早籼6号,获得了一个裂颖突变体。我们对突变体开展了形态学观察、遗传分析、基因定位和相关基因的表达分析,以期为进一步克隆该基因和阐明水稻裂颖的分子机制奠定基础。
1 材料与方法
1.1 试验材料
利用0.5%的甲基磺酸乙酯处理籼稻湘早籼6号,在M2代中发现一株裂颖突变体,经连续与野生型回交后获稳定遗传植株,命名为()。利用突变体与野生型湘早籼6号正反交,观察F1的表型,并统计F2群体中正常株和突变株的分离比例,通过卡方检验进行遗传分析;利用突变体与广亲和粳稻品种02428杂交构建F2群体,用于基因定位。
1.2 形态学特性观察
于抽穗开花期观察颖花形态和闭颖情况,成熟期观察水稻种子形态;于盛花期早上在田间取水稻主茎,带回室内置于盛有清水的三角瓶中,剪去剑叶。分别选取开颖前30 min、开颖后10 min、开颖后60 min的颖花,采用徕卡S9体式显微镜观察浆片形态。开花期结束后,调查裂颖和闭合颖花的数量,统计野生型与突变体的裂颖比例。
1.3 农艺性状调查
于成熟期考查野生型和突变体的株高和产量性状,同时调查突变体种子的裂颖情况,3次重复,每次重复取5株考种。产量性状包括有效穗数、每穗总粒数、结实率和千粒重。其中突变体的千粒重通过挑选1000粒正常闭颖且饱满的稻谷称重获得。利用DPS 14.10分析野生型与突变体之间的差异显著性。
1.4 基因定位和候选基因预测
以突变体与02428杂交的F2群体为定位群体,采用混合群体分离分析法开展基因的初定位。采用CTAB法提取亲本及群体植株的DNA。从F2群体中分别选取10株正常株和10株裂颖株,各单株取等量DNA混合,构建正常基因池和突变基因池;首先在亲本间进行SSR引物的多态性筛选,再利用多态性引物扩增两个基因池,筛选与目标基因连锁的SSR标记,并利用少量隐性单株进行初定位;在初定位区间设计InDel标记,扩大定位群体进行精细定位。PCR总体积10 μL。含2×Taq PCR预混试剂5 μL,正反向引物各1 μL(5 μmol/L),DNA模板1 μL,去离子水2 μL。PCR程序如下:94℃下预变性5 min;94℃下变性30 s、55℃下退火30 s,72℃下延伸30 s,33个循环;72℃下延伸5 min。在精细定位区间内,根据基因的功能注释预测候选基因,并比较野生型与突变体的序列差异。
1.5 茉莉酸含量测定
于盛花期,取开颖后约30 min的野生型和颖花各0.5 g,液氮速冻后置于−80℃下保存,用于内源茉莉酸含量的测定。样品经液氮研磨后转移到离心管中,加入3 mL预冷的提取液(甲醇∶水∶乙酸= 90∶9∶1),4℃避光浸提24 h;4℃、12 000 r/min下离心15 min,转移上清液;再加入2 mL提取液重复提取和离心1次;合并两次提取液,在室温下用氮气吹干;加入400 μL甲醇溶解,经0.22 μm滤膜过滤;参考Fu等[25]的方法,利用高效液相色谱-质谱联用仪进行检测。3次生物学重复。
1.6 基因表达检测
取样时间及方法同1.5。使用RNA提取试剂盒(美国Omega公司)抽提颖花中的总RNA,使用1%的琼脂糖凝胶电泳,检测RNA样品的完整性,同时使用微量分光光度计(NanoDrop 2000,Thermo)测定RNA样品在260、280、230 nm下的吸光度;RNA检测合格后,使用反转录试剂盒(日本ToYoBo公司)获得cDNA;cDNA模板稀释一定倍数后用于荧光定量PCR分析。使用SYBR qPCR Master Mix (Vazyme)作为荧光染料,反应体系为20 μL,在荧光定量PCR仪上进行(IQ5,Bio-Rad,美国)。PCR条件如下:94℃下预变性1 min;94℃下变性15 s,56℃下退火15 s,72℃下延伸30 s,40个循环。以作为内参,基因表达的相对量采用2−法计算。大部分引物参考黄俊宝等[23],其余引物见表1。样本间的差异显著性分析采用检验。
2 结果与分析
2.1 sh1突变体的表型分析
如图1-A所示,突变体的颖花形态、穗型与野生型基本一致,颖花具有正常的内外稃、雄蕊、花丝和柱头。野生型在开颖后1 h基本能完成闭颖,突变体能正常开花,但不能正常闭颖(图1-B)。突变体的裂颖比例达到37.1%。一部分颖壳始终保持裂开状态直到灌浆结实期,种子裸露在外,由于没有颖壳的保护,遇阴雨天气常导致霉变(图1-C),种子活力在储存阶段下降迅速。

图1 野生型和突变体颖花的形态学观察
Fig. 1. Morphological observation of florets of wild type andmutant.

表1 基因定位及表达分析引物信息

表2 野生型与突变体sh1的主要农艺性状比较
*,**分别表示野生型与突变体间差异达0.05和0.01显著水平。
*,**Significant difference between the mutant and its wild type at 0.05 and 0.01 levels, respectively.
浆片的膨胀和萎蔫是颖壳开闭的主要动力。如图1-D所示,开花前30 min,野生型和突变体的浆片较瘪,随后快速吸水膨胀,开花后表现出充盈饱满的状态。在开花前和开花后10 min,野生型与突变体的浆片之间都没有明显的差异。开颖后60 min,野生型的浆片已失水萎蔫,但突变体的浆片仍然处于膨大状态,野生型此时已完成闭颖,而突变体的颖花则继续保持张开。这些结果表明,突变体的浆片不能在开颖后正常萎蔫,导致突变体不能正常闭颖。
成熟期的农艺性状调查结果表明(表2),突变体的株高和每穗总粒数与野生型没有显著差异,但结实率和千粒重显著下降,其中结实率的降幅最明显,突变体的结实率仅为25.1%;相反,突变体的有效穗数显著多于野生型。
2.2 突变体的遗传分析及基因定位
将突变体与野生型湘早籼6号正反交,杂种F1均表现正常,湘早籼6号的F2群体中正常株1145株,裂颖株365株,分离比例经卡方检验符合3∶1(χ2=0.55 < χ2 0.05=3.84);在湘早籼6号/的F2群体中,正常株1024株,裂颖株315,卡方检验正常株与裂颖株的分离比例同样符合3∶1(χ2=1.55 < χ2 0.05=3.84),表明突变体的裂颖表型受一对隐性核基因控制。
利用突变体与02428的籼粳交F2群体进行基因定位。在亲本湘早籼6号和02428之间,共筛选到168对多态性SSR引物,均匀分布在12条染色体上。在F2群体中分别选取10株正常株和10株裂颖株构建DNA混池,使用亲本间的多态性引物扩增两个DNA混池,发现第3染色体上的SSR引物RM293在两个混池之间呈多态。随后在RM293周围增加SSR标记,利用34份裂颖F2材料,将目标基因定位在RM15967和RM1352两个SSR标记之间,物理距离约为701 kb。进一步扩大隐性单株数量到285个,并在初定位区间内加密标记,最终将基因定位在ID19827与ID19884两个InDel标记之间,物理距离约为110 kb(图2)。参考日本晴的基因组序列,此区间内共有14个开放阅读框(Open Reading Frame, ORF)。根据基因的功能注释,发现ORF5(LOC_Os03g55800)编码丙二烯氧化合酶(OsAOS1),属于细胞色素P450家族成员,是茉莉酸合成途径中的关键酶。基因测序分析发现,突变体在该基因编码区的第1241个碱基由A突变成G,导致编码蛋白的第414个氨基酸由谷氨酰胺突变为精氨酸。蛋白结构域分析发现,该蛋白第32−512位氨基酸为丙二烯氧化合酶结构域,非常保守。因此,预测该基因为裂颖突变的目标基因。
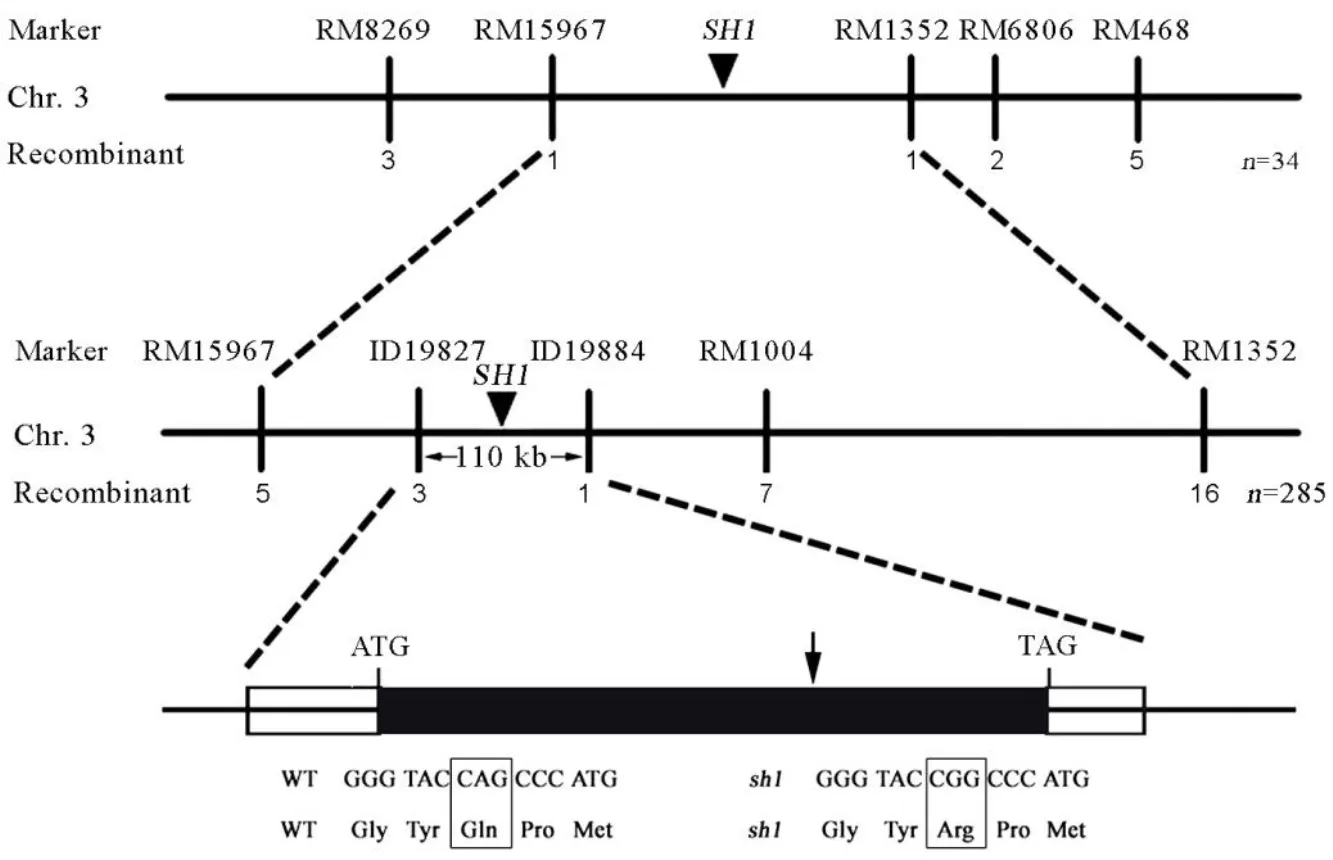
图2 水稻SH1基因的精细定位
Fig. 2. Fine mapping of the ricegene.

**表示突变体与野生型之间的差异达0.01显著水平。
Fig. 3. JA content in florets of wild type andmutant.
2.3 茉莉酸含量及相关基因的表达分析
茉莉酸是水稻开花过程中的重要调节物质,茉莉酸含量的变化直接影响颖壳的开闭。我们进一步分析了突变体在颖花开放时的茉莉酸含量及相关基因的表达变化。如图3所示,突变体中的茉莉酸含量明显降低,约为野生型的1/15,表明突变严重影响了花器官中的茉莉酸含量。基因表达分析结果表明,茉莉酸合成基因和的表达水平在突变体中极显著下降,但其他合成基因包括、、以及的表达在野生型和突变体之间差异不显著(图4-A);另外,参与催化茉莉酸与异亮氨酸形成活性共轭物(JA-Ile)的基因和,其表达水平在突变体中也没有明显变化(图4-B)。有意思的是,茉莉酸信号转导基因及受体蛋白基因、在突变体中显著诱导表达,但另一个茉莉酸受体蛋白基因的表达无差异。JAZ(Jasmonate ZIM-domain)蛋白是植物中调控茉莉酸激素应答的关键因子。除和以外,其他基因的表达水平在野生型和突变体中差异显著,其中大部分基因在突变体中下调表达,但和的表达水平在突变体中显著升高(图4-C)。综上,基因的突变显著降低了花器官中的茉莉酸含量,进而影响了茉莉酸合成及信号转导相关基因的表达。

*表示突变体与野生型之间的差异达0.05显著水平;**表示突变体与野生型之间的差异达0.01显著水平。
Fig. 4. Relative expression level of genes related to JA synthesis and signal transduction.
3 讨论
本研究鉴定了一个水稻裂颖突变体,突变体花器官中的JA含量显著下降,候选基因编码丙二烯氧化合酶(allene oxide synthase,AOS)。突变体是基因的等位突变体,该基因已被报道是JA生物合成途径中的关键酶基因,且已完成该基因相关的表达分析[26]。水稻中共有4个AOS同源基因[27],其中已被证明参与水稻的光形态建成[28]以及由营养生长向生殖生长的转换过程[29]。
在水稻JA合成相关突变体中,基因突变引起JA含量下降,突变体的护颖和稃片比野生型更长,而且在护颖和稃片之间长出额外的苞叶状组织,花药和柱头的数量也有所增加[30]。与突变体类似,本研究中突变体的JA含量也显著下降,但花器官形态没有明显的变化,推测可能是因为水稻基因只有一个拷贝,而基因有4个拷贝,存在互补效应,因此基因的突变对花器官的影响更严重。大部分水稻JA合成突变体都表现育性下降[28,30],突变引起千粒重显著下降,但花粉育性并未受到影响[11-12]。在本研究中,突变体的结实率和千粒重显著下降,但有效穗数增加,表明不同JA合成基因扮演的作用并不完全一致。JA本身是没有活性的,需要与异亮氨酸形成共轭物JA-Ile[13]。基因编码JA-氨基酸合成酶,水稻基因突变引起JA-Ile等共轭物含量明显下降,浆片不能正常萎蔫,导致颖花开放后不闭合[31-32]。水稻闭颖是花器官各组织部位协同作用的结果,其中浆片的程序性死亡(programmed cell death,PCD)在水稻闭颖过程中起重要作用,突变体中的PCD延迟导致闭颖失败[12]。本研究同样发现,突变体的浆片在开颖后维持膨大状态,这可能是突变体裂颖的主要原因。JA对其合成途径具有正反馈效应,JA合成相关基因的表达都受到JA的诱导;拟南芥AOC基因的表达水平在JA过量合成突变体中上调,相反在JA缺失突变体中则下调[17]。与这些研究结果一致,本研究中等JA合成基因在突变体中表达显著下调。JA含量的下降影响了下游的信号转导途径,大量参与JA信号转导的基因在野生型与突变体间差异表达。这些信号转导基因可能影响下游功能基因的表达和生理代谢,从而调控颖花的开闭过程。例如,钾离子运输基因在突变体表达上调,引起浆片中钾离子浓度明显升高[33]。等糖运输相关基因在突变体中表达下调,影响浆片中的糖类物质含量,进而影响浆片的正常萎蔫和颖壳闭合[12]。基因是否通过类似的机制调控水稻颖花闭合,浆片中的组织细胞结构和JA含量在突变体中是否发生变化,这些具体的生物学机制还有待于进一步的基因功能研究。
[1] 陈柏原, 符辰建, 秦鹏, 张海清, 杨远柱. 水稻种子裂颖性的研究进展. 杂交水稻, 2014, 29(3): 6-9.
Chen B Y, Fu C J, Qin P, Zhang H Q, Yang Y Z. Advances in studies on split husk of rice seeds., 2014, 29(3): 6-9. (in Chinese with English abstract)
[2] 杨建菊. 杂交水稻种子的裂颖及其危害. 杂交水稻, 2006, 21(1): 57-60.
Yang J J. Split husk and its harm in hybrid rice seeds., 2006, 21(1): 57-60. (in Chinese with English abstract).
[3] 曾晓春, 周燮, 吴晓玉. 水稻颖花开放机理研究进展. 中国农业科学, 2004, 37(2): 188-195.
Zeng X C, Zhou X, Wu X Y. Advances in study of opening mechanism in rice florets., 2004, 37(2): 188-195. (in Chinese with English abstract).
[4] 管恩相, 李勇, 刘陵武, 姚仁祥, 郭君, 唐海燕. 三系不育系种子裂颖形成的原因及防治措施研究. 中国种业, 2010(1): 42-43.
Guan E X, Li Y, Liu L W, Yao R X, Guo J, Tang H Y. Study on causes and control measures of split husk in three-line male sterile line seeds., 2010(1): 42-43. (in Chinese with English abstract).
[5] 朱伟, 童继平, 吴跃进. 水稻品种抗裂颖资源的筛选与初步研究. 植物遗传资源学报, 2004, 5(1): 52-55.
Zhu W, Tong J P, Wu Y J. Preliminary study and selection of rice germplasm with glume gaping resistance., 2004, 5(1): 52-55. (in Chinese with English abstract).
[6] 彭柏池, 刘晓霞, 张桂莲, 陈立云. 授粉期气象因子对水稻细胞质雄性不育系种子裂颖特性的影响. 中国农业气象, 2008, 29(3): 308-311.
Peng B C, Liu X X, Zhang G L, Chen L Y. Influence of meteorological factors during pollination stage on characters of glume-gaping grains of cytoplasmic male sterile lines in rice., 2008, 29(3): 308-311. (in Chinese with English abstract).
[7] 孙廉平, 张迎信, 张沛沛, 杨正福, 占小登, 沈希宏, 张振华, 胡霞, 轩丹丹, 吴玮勋, 曹立勇, 程式华. 一个由可变剪接造成的水稻开颖不育突变体的鉴定及基因定位. 中国水稻科学, 2015, 29(5): 457-466.
Sun L P, Zhang Y X, Zhang P P, Yang Z F, Zhan X D, Shen X H, Zhang Z H, Hu X, Xuan D D, Wu W X, Cao L Y, Cheng S H. Characterization and gene mapping of an open hull male sterile mutantcaused by alternative splicing in rice., 2015, 29(5): 457-466. (in Chinese with English abstract).
[8] 陈立凯, 黄明, 刘永柱, 王慧, 陈志强, 郭涛. 水稻开颖半不育突变体的观察、遗传分析和基因定位. 中国农业科学, 2016, 49(1): 1-13.
Chen L K, Huang M, Liu Y Z, Wang H, Chen Z Q, Guo T. Observation, genetic analysis and gene mapping of an open hull semi-sterility mutant in rice ()., 2016, 49(1): 1-13. (in Chinese with English abstract).
[9] 曾生元, 郭旻, 李荣德, 盛生兰, 龚红兵, 严长杰. 水稻新裂颖突变体的遗传分析与基因定位. 中国水稻科学, 2015, 29(1): 22-27.
Zeng S Y, Guo M, Li R D, Sheng S L, Gong H B, Yan C J. Genetic analysis and fine mapping for a novelmutant in rice., 2015, 29(1): 22-27. (in Chinese with English abstract).
[10] 沈亚林, 庄慧, 陈欢, 曾晓琴, 李香凝, 张君, 郑昊, 凌英华, 李云峰. 水稻颖花持续开放突变体()的鉴定与基因. 作物学报, 2017, 43(8): 1122-1127.
Shen Y L, Zhuang H, Chen H, Zeng X Q, Li X N, Zhang J, Zheng H, Ling Y H, Li Y F. Characterization and gene mapping ofmutant in rice (L.)., 2017, 43(8): 1122-1127. (in Chinese with English abstract).
[11] Li L, Shi C H, Zeng D D, Jin X L, Wu J G. Morphogenesis and molecular basis on the unclosed glumes, a novel mutation related to the floral organ of rice., 2015, 33(3): 480-489.
[12] Li X, Wang Y, Duan E, Qi Q, Zhou K, Lin Q, Wang D, Wang Y, Long W, Zhao Z. OPEN GLUME1: A key enzyme reducing the precursor of JA, participates in carbohydrate transport of lodicules during anthesis in rice., 2018, 37(2): 329-346.
[13] Dhakarey R, Kodackattumannil P P, Riemann M. Functional analysis of jasmonates in rice through mutant approaches., 2016, 5(1): 1-15.
[14] Wasternack C, Song S. Jasmonates: Biosynthesis, metabolism, and signaling by proteins activating and repressing transcription., 2016, 68(6): 1303-1321.
[15] Cai Q, Yuan Z, Chen M, Yin C, Luo Z, Zhao X, Liang W, Hu J, Zhang D. Jasmonic acid regulates spikelet development in rice., 2014, 5(3): 3476.
[16] 冯孟杰, 徐恒, 张华, 朱英. 茉莉素调控植物生长发育的研究进展. 植物生理学报, 2015, 51(4): 407-412.
Feng M J, Xu H, Zhang H, Zhu Y. Recent progress in jasmonates regulation of plant growth and development., 2015, 51(4): 407-412. (in Chinese with English abstract).
[17] Wasternack C. Jasmonates: An update on biosynthesis, signal transduction and action in plant stress response, growth and development., 2007, 100(4): 681-697.
[18] Ishiguro S, Kawai-Oda A, Ueda J, Nishida I, Okada K. Thegene encodes a novel phospholipase A1 catalyzing the initial step of jasmonic acid biosynthesis, which synchronizes pollen maturation, anther dehiscence, and flower opening in., 2001, 13(10): 2191-2209.
[19] Park J H, Halitschke R, Kim H B, Baldwin I T, Feldmann K A, Feyereisen R. A knock-out mutation in allene oxide synthase results in male sterility and defective wound signal transduction indue to a block in jasmonic acid biosynthesis., 2002, 31(1): 1-12.
[20] Zeng X C, Zhou X. Methyl jasmonate induces the opening of spikelets in rice., 1999, 41(5): 560-562.
[21] Song P, Xia K, Wu C W, Bao D P, Chen L P, Zhou X, Cao X Z. Differential response of floret opening in male-sterile and male-fertile rice to methyl jasmonate., 2001, 43(5): 480-485.
[22] Liu L, Zou Z, Qian K, Xia C, He Y, Zeng H, Zhou X, Riemann M, Yin C, Zhang D. Jasmonic acid deficiency leads to scattered floret opening time in cytoplasmic male sterile rice Zhenshan 97A., 2017, 68(16): 4613-4625.
[23] 黄俊宝, 何永明, 曾晓春, 向妙莲, 付永琦. 水稻颖花开放前花器官茉莉酸水平变化及浆片茉莉酸信号基因表达分析. 中国农业科学, 2015, 48(6): 1219-1227.
Huang J B, He Y M, Zeng X C, Xiang M L, Fu Y Q. Changes of JA levels in floral organs and expression analysis of JA signaling genes in lodicules before floret opening in rice., 2015, 48(6): 1219-1227. (in Chinese with English abstract)
[24] 付永琦, 向妙莲, 蒋海燕, 何永明, 曾晓春. 水稻颖花开放前浆片转录组变化. 中国农业科学, 2016, 49(6): 1017-1033.
Fu Y Q, Xiang M L, Jiang H Y, He Y M, Zeng X C. Transcriptome profiling of lodicules before floret opening inL., 2016, 49(6): 1017-1033. (in Chinese with English abstract).
[25] Fu J, Chu J, Sun X, Wang J, Yan C. Simple, rapid, and simultaneous assay of multiple carboxyl containing phytohormones in wounded tomatoes by UPLC-MS/MS using single SPE purification and isotope dilution., 2012, 28(11): 1081-1087.
[26] 韩同凯, 周晋军, 薛彦久, 陈翠霞, 谢先芝. 水稻丙二烯氧化物合成酶基因的表达研究. 山东农业科学, 2013, 45(5): 1-5.
Han T K, Zhou J J, Xue Y J, Chen C X, Xie X Z. Expression analysis of allene oxide synthase gene,, in rice., 2013, 45(5): 1-5. (in Chinese with English abstract)
[27] Ken H, Moritoshi I. Phytochrome-mediated transcriptional up-regulation ofin rice seedlings., 2004, 45(2): 119-128.
[28] Biswas K K, Ralf N, Ken H, Osamu Y, Moritoshi I. Photomorphogenesis of rice seedlings: A mutant impaired in phytochrome-mediated inhibition of coleoptile growth., 2003, 44(3): 242-254.
[29] Hibara K I, Isono M, Mimura M, Sentoku N, Kojima M, Sakakibara H, Kitomi Y, Yoshikawa T, Itoh J I, Nagato Y. Jasmonate regulates juvenile-adult phase transition in rice., 2016, 143(18): 3407-3416.
[30] Michael R, Ken H, Takafumi S, Kazunori O, Sugihiro A, Susumu M, Yoko N, Utako Y, Peter N, Masahiro Y. Identification of ricemutants and the function of jasmonate for defence against., 2013, 74(2): 226-238.
[31] Riemann M, Takano M. Riceis involved in phytochrome and jasmonate signaling., 2010, 31(6): 783-792.
[32] Xiao Y, Chen Y, Charnikhova T, Mulder P P J, Heijmans J, Hoogenboom A, Agalou A, Michel C, Morel J B, Dreni L.is required for JA-regulated floret opening and anther dehiscence in rice., 2014, 86(1-2): 19-33.
[33] Chen Y, Ma J, Miller A J, Luo B, Wang M, Zhu Z, Ouwerkerk P B. OsCHX14 is involved in the K+homeostasis in rice () flowers., 2016, 57(7): 1530-1543.
Identification and Genetic Analysis of Split Husk Mutantin Rice
PAN Xiaowu, LIU Wenqiang, LI Yongchao, XIONG Haibo, SHENG Xinnian, DUAN Yonghong, YU Yaying, ZHAO Wenjin, WEI Xiucai, LI Xiaoxiang*
(,/,,410125, China; Correspondingauthor, E-mail:)
【】The objective of the research is to identify and clone a rice split-husk gene, providing support for elucidating the genetic mechanism of rice floret closing. 【】A split husk mutant,, was isolated from an ethylmethylsulfone (EMS) mutagenic population ofcultivar Xiangzaoxian 6. The morphological characteristics of florets and lodicules were observed. Thegene was identified by map-based cloning using an F2population of a cross betweenand 02428. In addition, expression levels of related genes were analyzed by quantitative PCR. 【】Themutant showed normal floral morphological characteristics, but failed to close the lemma and palea after floret opening, which was caused by delay of lodicule dehydration. Themutant was also featured by increased number of effective panicles, obviously decreased seed-setting rate and 1000-grain weight. Genetic analysis indicated that the mutant phenotype was controlled by a pair of recessive nuclear gene. Thegene was fine-mapped to a 110 kb interval between markers ID19827 and ID19884 on the chromosome 3. After sequencing of this region, we found that there is a single base transition in the coding region of(), which resulted in an amino acid substitution. Correspondingly, the mutant showed reduced content of jasmonic acid (JA) and differential expression of genes related to JA synthesis and signal transduction. 【】Thegene regulates rice floret closing through JA synthesis and signal transduction, andis the candidate gene for.
rice; floret closing; lodicule; gene mapping; jasmonate
Q343.5; S511.01
A
1001-7216(2019)04-0323-08
10.16819/j.1001-7216.2019.9027
2019-03-07;
2019-04-17。
湖南省重点研发计划资助项目(2017NK2020);国家自然科学基金资助项目(31801335);湖南省农业科学院科技创新项目(2017JC10);长沙市杰出创新青年培养计划资助项目(KQ1707008)。
