亚硝酸盐胁迫对草鱼肝脏泛素-蛋白酶体系统的影响
2019-07-26孙怡晴ONXAYVIENGKommaly李大鹏
孙怡晴,梁 骁,熊 梅,ONXAYVIENG Kommaly ,2,汤 蓉,李大鹏
(1.华中农业大学水产学院,池塘健康养殖湖北省工程实验室,武汉 430070;2.家畜和渔业部,农林部,老挝万象 6644)
亚硝酸盐是生态系统中氮循环的重要中间产物,也是水产养殖过程中常见的污染物。在池塘精养过程中,由于投饵量大以及残饵粪便大量沉积会产生大量的氨,缺氧时硝化作用受阻,会引起亚硝酸盐在水环境中积累。养殖水体中较高浓度的亚硝酸盐通常会对鱼类引起毒理效应,导致应激反应,危害养殖鱼类存活和健康。环境应激通常会直接或间接地引起细胞内蛋白质代谢的改变,影响动物的生长和发育。
在脊椎动物中,有三个主要的系统对蛋白质降解起关键作用,即泛素-蛋白酶体系统,溶酶体自噬系统和钙蛋白酶系统。泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)是一个调节蛋白质降解与功能的重要系统[1]。UPS降解细胞内聚集的或错误折叠的蛋白质以调节细胞周期、凋亡、代谢、免疫应答、信号传递、转录控制、应激应答等生物学过程[2]。泛素-蛋白酶体系统由泛素(Ub)、泛素活化酶(E1)、泛素结合酶(E2)、泛素连接酶(E3)和26S蛋白酶体等组成。泛素化是一个ATP依赖型的耗能过程,主要包括两个步骤:首先,通过E1、E2、E3使目标蛋白与泛素形成一条多聚泛素链;其次,多聚泛素链被26S蛋白酶体识别并降解为小肽或氨基酸[3]。E3连接酶可以对不同的底物进行特异性的识别,表现了蛋白降解的高度选择性。
UPS的核心组分可以作为应激传感器直接参与应激感知,如E3连接酶CRL3KEAP1、SCFMET30和SCFFBXL5。Nrf2是由E3连接酶调控的典型转录因子,同时是氧化应激的重要传感器[4]。各种应激条件如热、渗透、氧化和重金属引起的应激反应可能会导致蛋白损伤,从而引起蛋白质的错误折叠。作为第一反应,不同的伴侣系统(如HSP70、HSP90)尝试重新折叠蛋白;当重折叠不成功时,这些蛋白通过CHIP(E3)的作用被UPS降解[5]。研究表明,生活在0 ℃以下的南极鱼类鳃和肝脏中20S蛋白酶体活性随着温度升高而增强[6]。在酵母中的研究结果表明蛋白酶体与Hul5(HECT型泛素连接酶)在清除细胞质内错误折叠蛋白质时发挥积极作用[7]。
草鱼(Ctenopharyngodonidellus)是我国主要的大宗淡水养殖种类,也是世界上养殖产量最大的水产品种。急性亚硝态氮浓度的升高会使草鱼免疫性能下降、氧化应激反应加强[8]、甲状腺激素代谢平衡被扰乱及甲状腺功能减退[9]。虽然泛素-蛋白酶体系统在鱼类蛋白质代谢中具有重要的作用,但亚硝酸盐胁迫对鱼类该系统的影响目前了解甚少。本研究以草鱼幼鱼为实验对象,进行亚硝酸盐的急性胁迫实验,探究亚硝酸盐胁迫对草鱼肝脏泛素-蛋白酶体系统的影响,旨在为养殖环境控制和提升养殖鱼类品质提供基础科学依据。
1 材料与方法
1.1 实验鱼与实验设计
实验用草鱼(94.88±16.54 g)购自湖北省黄冈市团风县百容良种场,实验前暂养1周,养殖用水为曝气的自来水。实验采用亚硝酸钠溶液作为亚硝酸盐胁迫溶液,设置对照组和实验组,对照组亚硝酸钠浓度为0 mg/L,实验组暴露浓度为0.5 mg/L和20 mg/L。在暴露12、24 、48和96 h后,分别从每组采集8尾鱼麻醉(MS-222,250 mg/L)后采集组织样品,用于生物化学、组织学、分子生物学的检测。实验期间,水温24.0~26.0 ℃,pH值为7.5±0.3,24 h连续曝气,溶氧保持在7 mg/L以上,每12 h更换试液一次以保证实验暴露浓度的稳定性。
1.2 实验方法
1.2.1 血液生化指标测定
葡萄糖(GLU)、总蛋白(TP)、白蛋白(ALB)、胆固醇(CHO)、甘油三酯(TG)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)在全自动生化分析仪(Selectra XL,荷兰威图科学公司)上测定,试剂盒购自武汉康瑞嘉科技有限公司。皮质醇的测定采用放射性免疫法(RIA),试剂盒购自北京北方生物技术研究所。
1.2.2 相关基因表达水平检测
总RNA提取及cDNA合成:取约80 mg样品使用Trizol(Vazyme)提取总RNA,在1.1%琼脂糖凝胶电泳中检测样品RNA完整性,并通过分光光度计法测定浓度。使用带有gDNA Eraser(Perfect Real Time)(Takara)的PrimeScript RT试剂盒,根据说明书进行逆转录。
基因的引物设计:根据GenBank中相关基因序列,使用Primer Premier 5.0软件设计引物(表1)。选用β-actin为实时荧光定量PCR内参基因,引物由上海生工生物工程技术服务有限公司合成。选取psma2(20S proteasome subunit alpha type 2)和psmc1(26S proteasome subunit ATPase 1)分别代表26S 蛋白酶体的20 S亚基和19 S亚基。
实时荧光定量PCR:反应体系包括10 μL HieffTMqPCR SYBRGreen Master Mix(No Rox Plus)(YEASEN),各0.4 μL上、下游引物,7.2 μL双蒸水,2 μL cDNA模板,在QuantStudio 6 Flex Real-Time PCR Detection System(Applied Biosystems,USA)进行荧光定量反应。反应程序:首先95 ℃预变性5 min,再进行95 ℃变性10 s,57 ℃退火20 s,72 ℃延伸20 s,循环40次。

表1 实验所用引物序列
1.2.3 泛素化蛋白含量测定
使用Dot-Blot 方法测定肝脏组织泛素化蛋白含量。用RIPA 裂解缓冲液(广州捷倍斯生物科技有限公司)提取肝脏中的总蛋白,BCA蛋白测定试剂盒(广州捷倍斯生物科技有限公司)测定浓度,PBS调节样品蛋白浓度,使浓度保持一致(0.67 μg/μL)。移取100 μL样品至Bio-Dot(Bio-Rad),通过抽滤装置将蛋白质转移到硝化纤维素膜(Millipore)。将NC膜置于封闭液中孵育1 h以阻断非特异性结合,然后多聚泛素化蛋白抗体(FK1)(Biomol,BML-PW8805-0500)4 ℃孵育过夜。FITC标记的二抗(BOSTER,BA1101)孵育2 h后,通过Odyssey CLx(LI-COR,CLx-0813)显影分析,使用Image J读取各斑点灰度值。
1.2.4 肝脏组织学观察
实验96 h后,采集20 mg/L暴露组草鱼肝脏样品保存于多聚甲醛中,制作石蜡组织切片,用苏木素-伊红染色。在Nikon Eclipse 80i显微镜下观察组织学结构,并进行拍照分析。
1.3 数据统计及分析
基因相对表达量采用2-ΔΔCt法计算,采用SPSS 18.0统计分析软件对数据进行单因素方差分析(One-way ANOVA),当P<0.05时,差异显著。使用Graphpad PrismV5.0作图。
2 结果
2.1 血液生化指标
由图1-A可知,在实验12、24和48 h时,亚硝酸盐胁迫显著提高了草鱼血清皮质醇含量;在96 h时恢复至对照水平。在0.5 mg/L亚硝酸盐胁迫下,血清葡萄糖的含量在24、48和96 h时均出现显著性下降(图1-B)。血清中胆固醇的含量在亚硝酸盐胁迫期间,无显著性变化(图1-C)。在0.5 mg/L暴露组,甘油三酯和总蛋白的含量在24 h显著降低(图1-D、E)。在0.5 mg/L暴露组,血清中白蛋白含量在24 h显著低于对照组,在48 h和96 h显著高于对照组(图1-F)。

图版1 亚硝酸盐暴露对草鱼幼鱼血清生化指标的影响Plt.1 Serum biochemical parameters of C.idellus juveniles exposed to different nitrite concentration*表示同一暴露时间内与0 mg/L组比较有显著差异(P<0.05),结果以均值±标准误的形式表示(n=8),图版2、图版3同。
20 mg/L亚硝酸盐胁迫24 h后ALP的含量显著性升高(图1-G)。在0.5 mg/L暴露组中,血清中ALT含量与暴露时间负相关,在12 h与24 h显著性升高,在48 h与96 h显著性降低。在20 mg/L暴露组中,其含量在48 h和96 h显著性低于对照组(图1-H)。20 mg/L亚硝酸盐胁迫24 h时,血清AST的含量显著升高;但在12 h及96 h时,其含量显著降低。0.5 mg/L亚硝酸盐胁迫12 h时,AST含量显著高于对照水平;在48 h和96 h时,其含量与对照组相比显著降低(图1-I)。
2.2 Nrf2 和hsp70的表达
20 mg/L亚硝酸盐胁迫下,nrf2的表达量在12 h与48 h出现显著性升高;在0.5 mg/L暴露组,其表达量在24 h显著降低,在48 h显著升高(图2-A)。在20 mg/L暴露组,hsp70的表达量在12、24和48 h均显著性升高,在96 h恢复至对照水平;在0.5 mg/L暴露组,hsp70的表达量在12、48和96 h显著升高,在24 h其表达量显著低于对照组(图2-B)。
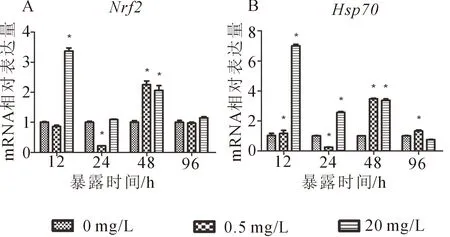
图版2 亚硝酸盐暴露对草鱼幼鱼肝脏nrf2,hsp70相对表达量的影响Plt.2 Relative expression of nrf2 and hsp70 in the liver of C.idellus exposed to nitrite基因的表达量以0 mg/L组为1。
2.3 泛素-蛋白酶体系统的活性
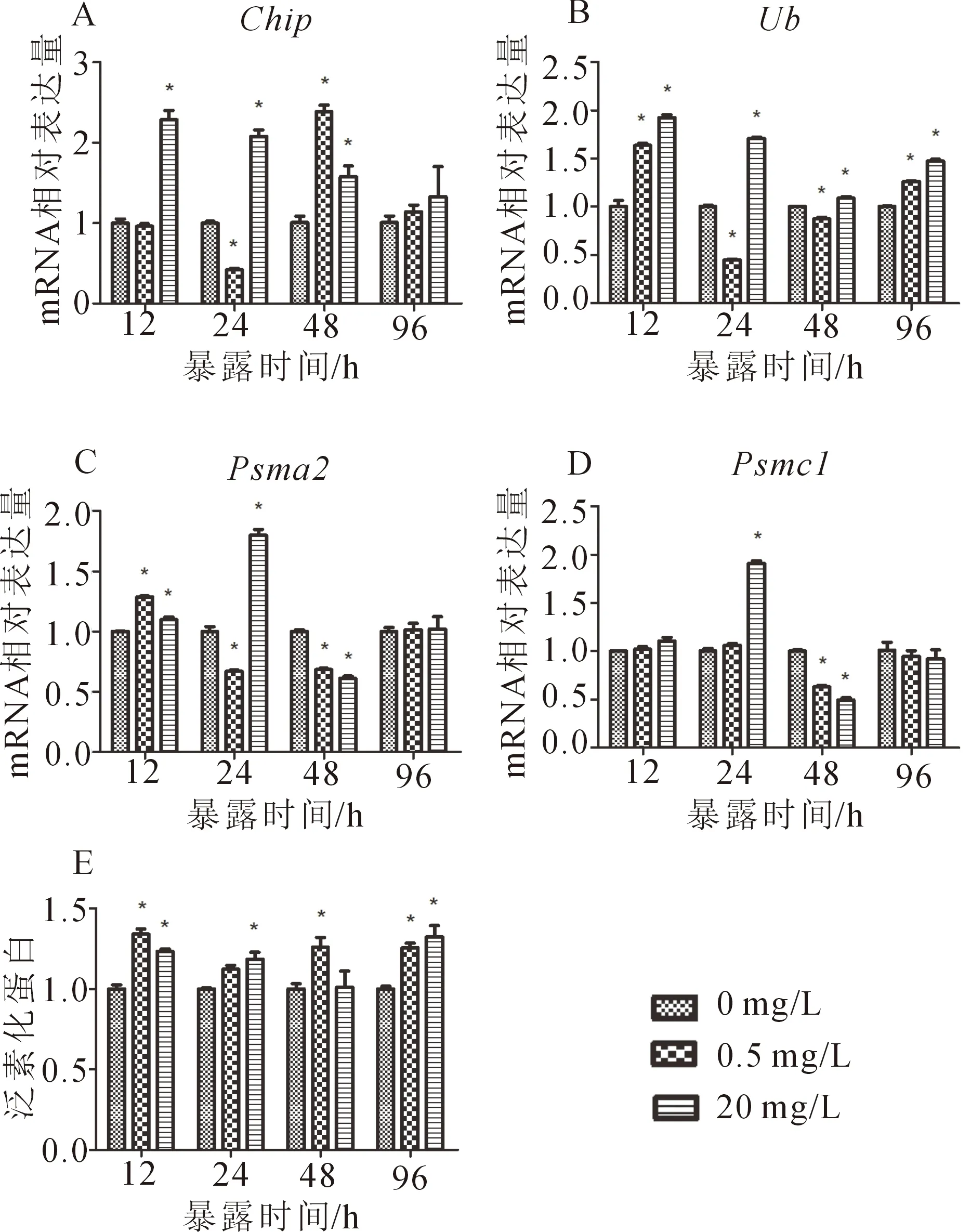
图版3 草鱼幼鱼肝脏UPS相关基因的相对表达量和泛素化蛋白的相对含量Plt.3 Relative expression of genes and ubiquitinated proteins in the liver of grass carp 泛素化蛋白的表达量以0 mg/L组为1。
在20 mg/L暴露组,chip的mRNA水平在12、24和48 h显著升高,在96 h与对照组相比无显著不同(图3-A)。Ub的表达量在亚硝酸盐胁迫的不同时间点均存在剂量依赖式上升(图3-B);0.5 mg/L暴露组,其表达量在24 h和48 h显著降低,在12 h和96 h显著性升高;在20 mg/L暴露组中ub的表达水平均显著高于对照组。在20 mg/L暴露组,psma2的mRNA水平在24 h显著升高,在48 h显著下降;0.5 mg/L亚硝酸盐胁迫使psma2表达量在12 h显著升高,24 h和48 h显著降低(图3-C)。psmc1的mRNA水平在0.5 mg/L胁迫48 h显著降低;在20 mg/L胁迫24 h其表达水平显著升高,在48 h显著降低(图3-D)。在0.5 mg/L亚硝酸盐胁迫12、48和96 h,肝脏泛素化蛋白的含量显著性升高。在20 mg/L暴露组中,泛素蛋白含量在12、24和96 h显著高于对照组(图3-E)。
2.4 肝脏组织病理学观察
由图4-A可观察到,对照组的肝细胞形状正常,总体形态规律,细胞核位置明显;而草鱼肝细胞在20 mg/L的亚硝酸盐胁迫96 h后,肝细胞出现明显脂肪空泡化现象(图4-B)。
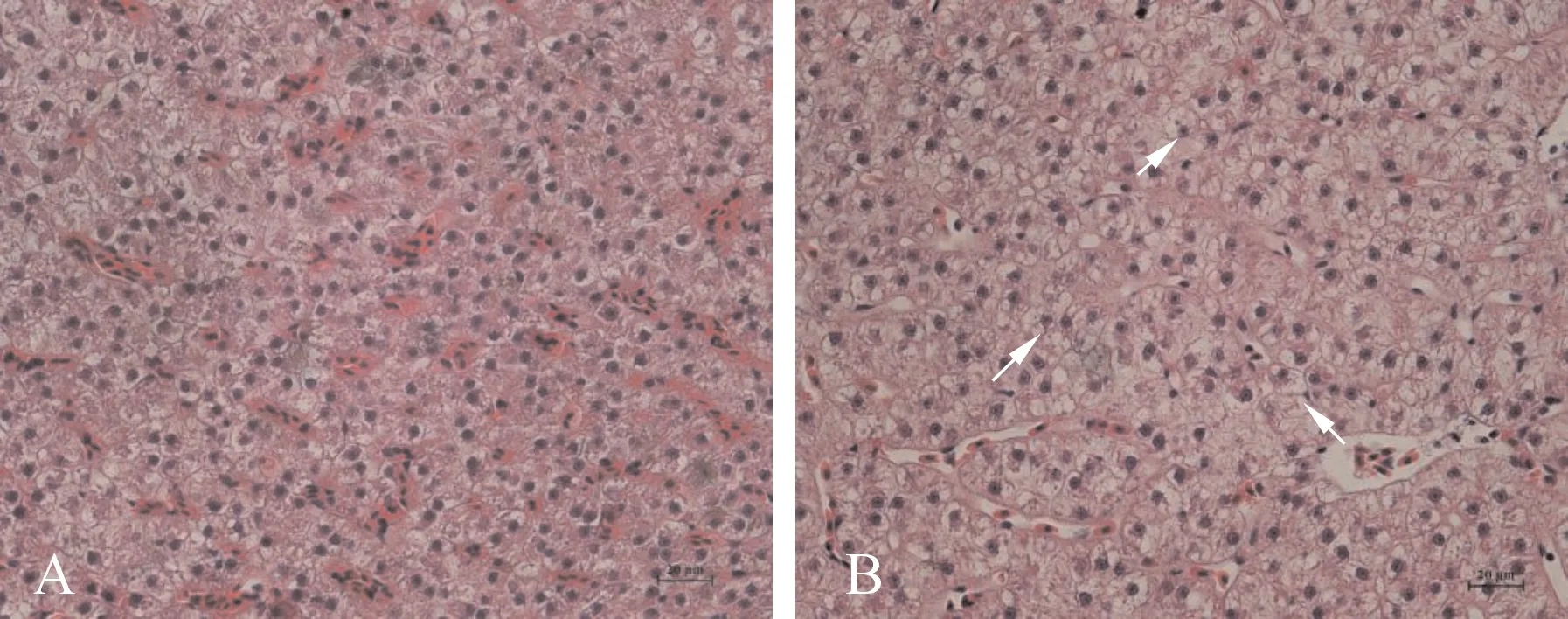
图4 20 mg/L亚硝酸盐暴露96 h对草鱼幼鱼肝脏的组织学影响Fig.4 The hepatic histological change in grass carp exposed to 20 mg/L of nitrite for 96 h.A:对照组;B:暴露组;HE×200。
3 讨论
3.1 血清生化指标
鱼类的血液承担机体营养代谢和信息传递的重要作用,在生理学研究中,可以通过鱼类血液生化指标的变化来衡量其应激水平、营养状况、代谢状态等。皮质醇的含量变化作为检测应激反应重要的指标之一,在鱼体受到外界环境刺激后,通过下丘脑-垂体-肾间组织轴(HPI)分泌,可帮助机体对抗环境应激[10]。草鱼在高浓度的亚硝酸盐胁迫短时间内血清皮质醇含量上升,表明草鱼产生了应激反应,实验后期已恢复至对照水平,在鳙(Aristichthysnobilis)的研究中也发现了相似的结果[11],大菱鲆(Scophthalmusmaximus)在急性的亚硝酸盐暴露下血清皮质醇水平也显著升高[12]。有研究指出,亚硝酸盐胁迫可以通过激活HPI轴使皮质醇分泌增多,从而提高葡萄糖水平[13]。本实验中,0.5 mg/L亚硝酸盐暴露组的葡糖糖含量在24、48、96 h均呈现显著下降,这可能是由于鱼体内能量物质的大量消耗。在暗纹石斑鱼(Sebastesinermis)的研究中也发现血清中葡萄糖的含量随着亚硝酸盐暴露时间的延长而明显下降[14]。
甘油三酯和胆固醇作为鱼类脂质代谢中的重要物质,在抵抗外界环境应激的时候发挥重要作用,碱性磷酸酶是一种代谢调节酶,可以促进鱼体营养的吸收和利用[11],亚硝酸盐暴露浓度及时间对草鱼血清中甘油三酯,胆固醇和碱性磷酸酶影响不大。在本研究中0.5 mg/L的亚硝酸盐胁迫提高了血清中白蛋白的含量,白蛋白作为血清中主要的蛋白质成分能够维持渗透压平衡[15]。
谷草转氨酶和谷丙转氨酶是肝脏、心肌组织中的重要转氨酶,在正常生理状态下,这些酶在血清中活性稳定,当肝细胞受应激等引起病变或损伤时,组织细胞膜的通透性增加,细胞内的这两种酶释放到血液中。鳙在48.634 mg/L亚硝酸盐氮暴露下其血清中这两种酶的含量在48 h显著升高,在恢复12 h 后达到对照水平[11]。强俊等[15]发现高温胁迫尼罗罗非鱼(Oreochromisniloticus)12 h 后,其血清中这两种酶的含量显著上升并在胁迫24 h 后降低。本实验中草鱼血清谷草、谷丙转氨酶的含量先升高后下降,可能是因为短期内亚硝酸盐胁迫会使肝脏损伤加重,而胁迫后期,鱼体基本适应胁迫环境。
3.2 肝脏hsp70 和nrf2的相对表达
通常,除了血液中皮质醇及葡萄糖的含量,HSP70和Keap1-nrf2通路的表达水平也可以反映鱼类的应激状态[16]。在鱼类中,热休克蛋白(HSPS)的调控受机体本身的遗传特性与外界环境的共同影响,HSP70可以作为分子伴侣参与细胞内的蛋白质合成,以及对错误折叠蛋白质的调节、降解[15,17]。在本实验中,hsp70在肝脏中的表达量受高浓度亚硝酸盐胁迫影响巨大。草鱼受到亚硝酸盐的胁迫后,hsp70 mRNA被诱导高表达以保护鱼体减小损伤,环境应激引起机体hsp70 mRNA表达上升可以在许多研究中发现。例如,大菱鲆在亚硝酸盐胁迫96 h后血液中的hsp70的表达量出现显著上调[12],团头鲂(Megalobramaamblycephala)在34 ℃的热应激条件下其肝脏hsp70基因的表达量在6 h达最高,随后开始下降[18]。除了热休克蛋白,氧化应激反应同样受到抗氧化转录因子Nrf2的调节,通过Nrf2/ARE通路,激活靶基因,积极发挥抗氧化作用[19]。Nrf2的表达趋势与hsp70相似,在高浓度亚硝酸盐胁迫短期内大幅度上调,96 h后恢复至对照水平,与镉胁迫斑马鱼(Daniorerio)实验的结果相似,这可能与抗氧化基因的增强密切相关[20]。叶元土等[21]发现,灌喂氧化鱼油显著改变了草鱼“Keap1-Nrf2-ARE”调控的下游靶向通路,谷胱甘肽/谷胱甘肽转移酶、热休克蛋白和蛋白质泛素化通路的基因均显著性上调,用于清除氧化损伤的物质和修复氧化损伤的细胞等。
3.3 UPS活性的检测
在应激反应中产生的错误折叠蛋白与未折叠蛋白首先被HSP70等热休克蛋白重新折叠,当HSP70不能对其进行重新折叠时,CHIP作为HSP70的分子伴侣及重要的E3连接酶,可以识别HSP70-底物复合物,诱导该底物蛋白多聚泛素化并被UPS降解[5,17]。草鱼肝组织中chip的表达趋势与hsp70和nrf2的基本一致。我们发现肝脏中ub的表达量与亚硝酸盐的胁迫浓度有显著的正相关;psmc1和psma2的表达水平在20 mg/L亚硝酸盐胁迫下在24 h显著升高,因此UPS的活性在亚硝酸盐胁迫短时间内出现显著的增强。有文献指出温度升高10 ℃显著提高了南极鱼类的肝脏及鳃组织中20S蛋白酶体活性[6];蓝绿光鳃鱼(Chromisviridis)在高温暴露12 h后,其血糖水平、鳃热休克蛋白及泛素化蛋白的含量出现显著上升[22]。本实验中亚硝酸盐胁迫提高了草鱼肝脏中的泛素化蛋白含量。当草鱼肠道黏膜受到严重的氧化损伤后,它产生许多损伤细胞及损伤蛋白质,从而激活黏膜细胞中泛素蛋白酶体系统和热休克蛋白显著上调,以清除损伤或错误蛋白[21]。
3.4 组织病理学变化
鱼类肝脏在调控基础代谢、降解与排泄外源有毒物质中发挥重要作用,并且可以作为鱼体健康状况的指示性参数,肝脏对于外界环境污染物特别敏感,这种敏感表现在肝脏组织所产生的实质性的变化[23]。本实验中,肝脏在高浓度亚硝酸盐胁迫96 h后出现明显的空泡化,鲶(Clariasgariepinus)和团头鲂(Megalobramaamblycephala)在亚硝酸盐胁迫下其肝脏也表现相似的损伤[24-25]。Saraste等[26]认为,肝脏中细胞凋亡引发的一些形态学特征变化可能导致细胞形态的不规则,脂滴和空泡的形成。肝脏的抗氧化状态与肝组织学存在一致性变化,在肝脏的解毒过程中可能产生ROS并导致对机体的氧化损伤。Zhang 等[27]发现当抗氧化系统不能及时消除肝脏中过量的ROS时,为避免羰基蛋白(CP)的积累造成氧化损伤风险加剧,组织中酶催化活性被降低,最终引起蛋白酶作用加强,加快降解蛋白质。
综上所述,急性亚硝酸盐胁迫导致草鱼产生应激反应,肝脏hsp70、nrf2的表达量显著上升,造成了肝脏细胞损伤;泛素-蛋白酶体系统的活性加强,通过清除损伤或错误蛋白来降低氧化损伤风险。
