沙参麦冬汤联合碘 [131 I] 化钠口服溶液对甲状腺癌术后患者的临床疗效
2019-07-23王德平郭长秀王彤彤孙毓晗
王德平, 郭长秀, 王彤彤, 关 悦, 孙毓晗
(牡丹江医学院附属红旗医院,黑龙江 牡丹江157011)
甲状腺癌是最常见的头颈部和内分泌系统恶性肿瘤,女性发病率普遍高于男性[1-2],并且呈上升趋势[3-4]。目前,甲状腺癌治疗可采用手术切除,并以131I 进行清甲[5],具有清甲成功率高、治疗次数少等优点[6],但潜在的不良反应依然不容忽视,如免疫功能抑制、局部炎症反应等。
中医药治疗甲状腺癌时,具有疗效确切、减少复发转移、提高患者生活质量、不良反应少等优点[7-8]。沙参麦冬汤源自《温病条辨·上焦篇·秋燥》,具有养阴清热、润燥生津润喉之功效,用于治疗温热和燥热之邪伤[9],对改善甲状腺癌术后患者气阴两虚证具有良好的疗效[10],但鲜有其对清甲治疗所引起免疫功能低下、炎症反应影响的报道。本研究探讨沙参麦冬汤联合碘[131I] 化钠口服溶液对甲状腺癌术后患者的临床疗效,为其临床推广应用提供理论支持,现报道如下。
1 资料与方法
1.1 一般资料 2015 年10 月至2017 年10 月收治于牡丹江医学院附属红旗医院的76 例甲状腺癌术后患者,采用随机数字表法分为观察组和对照组,每组38 例。研究经牡丹江医学院附属红旗医院伦理委员会批准,并监督全过程。
1.2 纳入、排除标准
1.2.1 纳入标准 ①符合《甲状腺结节和分化型甲状腺癌诊治指南》[11]相关规定;②经针吸活组织检查(FNA)、电子计算机断层扫描(CT)、病理组织学共同确诊;③TNM 分期Ⅰ~Ⅲ期,符合手术治疗指征并进行手术治疗,无远处病灶转移;④生存期预计>6 个月;⑤符合西医甲状腺癌术后131I 清甲治疗致局部炎症反应的诊断标准;⑥符合气阴两虚证的诊断标准,即胸闷气短,声嘶口干,烦躁易怒,神疲乏力,懒言少气,舌淡尖红、少苔,多汗消瘦,脉细无力;⑦入组前1 个月内未使用本研究同类药物治疗;⑧卡氏功能状态评分(KPS) ≥70 分;⑨患者或家属签字同意,积极配合本研究。
1.2.2 排除标准 ①心、肝、肾功能衰竭或合并其他恶性肿瘤;②妊娠或计划妊娠或哺乳期妇女,精神病患者;③有远处病灶转移;④生存期预计<6 个月;⑤正在参加其他药物临床研究;⑥入组前1 个月内使用其他药物影响局部炎症反应治疗;⑦过敏体质或对本研究药物成分过敏;⑧拒绝参加或不能如期完成本研究。
1.3 治疗方案
1.3.1 对照组 伤口愈合后或停用左甲状腺素钠3 周以上,维持3 ~4 周低碘饮食,促甲状腺激素(TSH) 检测>30 mU/L,检测血常规、肝肾功能等指标,育龄期妇女需检测尿HCG 以排除妊娠,检测完毕后全面评估患者病情以确认无明显131I 治疗禁忌证。所有患者禁食禁水2 h 后,给予碘[131I]化钠口服溶液(原子高科股份有限公司,国药准字H10960247,925 MBq)(2.96~5.55) ×103MBq,2 h 后大量饮水;给予复方川芎吲哚美辛胶囊(海南博大制药厂,国药准字H46020617,0.3 g) 以预防炎症,一次1 粒,每天2 次,症状缓解时可减少药量;炎症严重者给予醋酸泼尼松片(广东华南药业集团有限公司, 国药准字H44020682,5 mg),一次1~2 片,每天2 次。1 周后,给予左甲状腺素钠片(优甲乐,德国Merck KGaA 公司,进口药品注册号H20140052,50 μg/片) 替代治疗,一次1 片,每天1 次,根据甲状腺功能检测结果调整用量。
1.3.2 观察组 在对照组基础上加用沙参麦冬汤,组方为北沙参15 g、麦冬12 g、浙贝母15 g、夏枯草15 g、白花蛇舌草15 g、猫爪草15 g、炮山甲15 g、怀山药15 g、 百合15 g、 太子参10 g、 炒白术10 g、牡蛎20 g、米仁30 g、茯苓12 g、川贝母12 g、玄参6 g,水煎服,1 剂/d,分早、晚2 次温服,疗程14 d,连续3 个疗程。以上中药饮片均来自牡丹江医学院附属红旗医院中药房,经牡丹江医学院附属红旗医院中西医结合科卢晋教授鉴定为正品,均符合2015 年版《中国药典》 要求。
1.4 中医证候疗效评价 观察患者术后心悸、声嘶、口疮、大便干结等临床症状,参考《中药新药临床研究指导原则》[12]计分:无症状0 分,轻度1 分,中度2 分,重度3 分,按单项症状评分的总积分来进行评价。证候积分值下降≥70%,为显效;30%≤证候积分值下降<70%,为有效;证候积分值下降<30%,为无效;证候积分值上升≥30%,为恶化。总有效率= [ (显效例数+有效例数) /总例数] ×100%。
1.5 生活质量评价 治疗前后采用KPS 评分评价患者生活质量, KPS 评分越高, 表明生活质量越好。
1.6 血清标本采集 治疗前后采集患者空腹静脉血各8 mL, 置于抗凝管中, 3 000 r/min 离心15 min,取上清于EP 管中,-80 ℃冰箱中保存。
1.7 T 淋巴细胞亚群检测 CytoFLEX 流式细胞仪(由牡丹江医学院医药研究中心协助) 检测CD3+、CD4+、CD8+,并计算CD4+/CD8+。
1.8 炎症因子检测 酶联免疫吸附(ELISA) 法检测白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、高敏C 反应蛋白(Hs-CRP) 水平,相应试剂盒由上海晶抗生物工程有限公司提供,严格按照说明书进行操作。
1.9 肿瘤标志物检测 ELISA 法检测血清糖类抗原50(CA50)、糖类抗原125(CA125)、癌胚抗原(CEA) 水平,相应试剂盒由上海朗顿生物科技有限公司提供,严格按照说明书进行操作;化学发光免疫分析 (CLIA) 法检测甲状腺球蛋白(TG) 水平,相应试剂盒由北京华夏远洋科技有限公司提供,严格按照说明书进行操作。
1.10 统计学分析 通过SPSS13.0 软件进行处理,计量资料采用表示,各组数据符合正态分布,方差齐时采用单因素方差分析,组间两两比较采用LDS 检验,而方差不齐时采用Games-Howell检验;计数资料采用卡方检验或Fisher 精确概率法。P<0.05 表示差异有统计学意义。
2 结果
2.1 一般资料 表1 显示,2 组患者年龄、性别、病理分型、TNM 分期、手术方式、淋巴清扫情况、术后时间等比较,差异无统计学意义(P>0.05),具有可比性。
表1 2 组一般资料比较Tab.1 Comparison of general data between the two groups
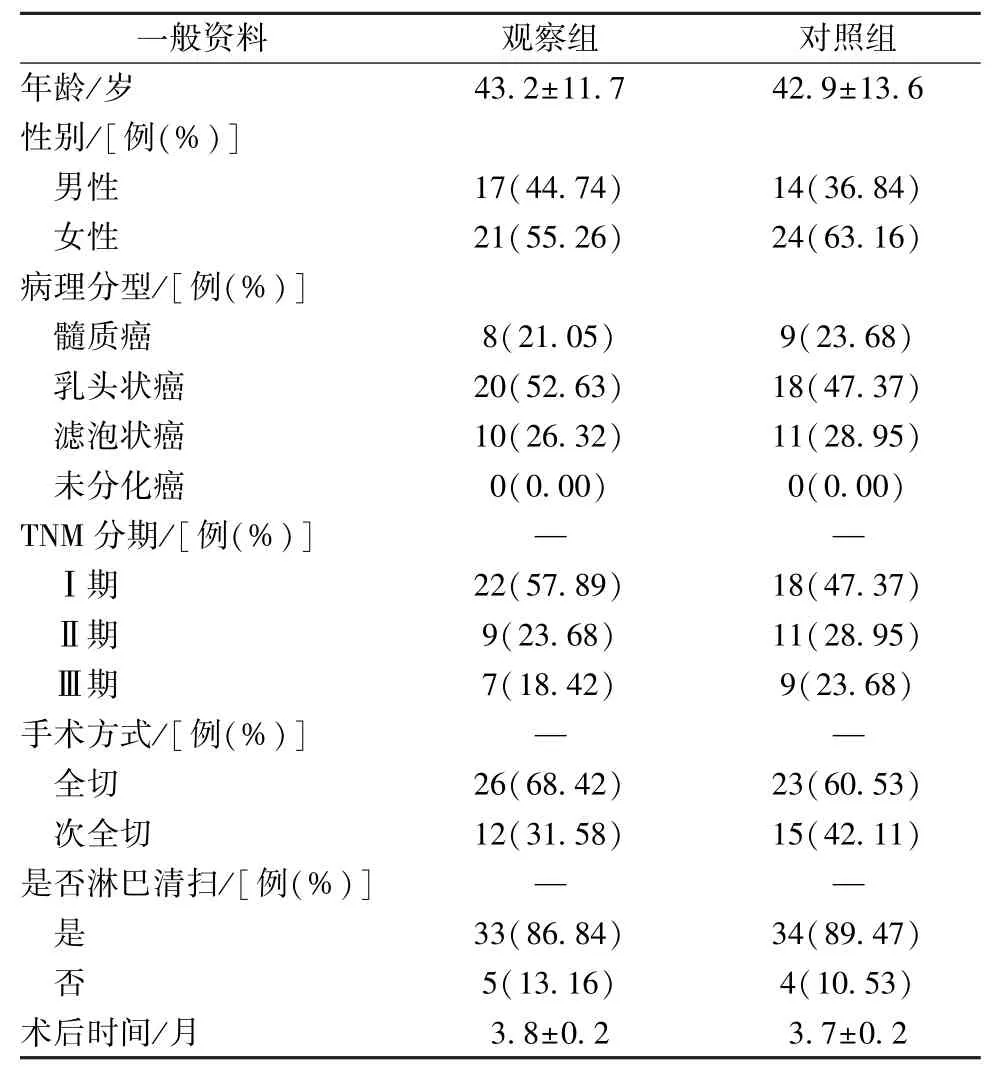
表1 2 组一般资料比较Tab.1 Comparison of general data between the two groups
一般资料 观察组 对照组年龄/岁 43.2±11.7 42.9±13.6性别/[例(%)]男性 17(44.74) 14(36.84)女性 21(55.26) 24(63.16)病理分型/[例(%)]髓质癌 8(21.05) 9(23.68)乳头状癌 20(52.63) 18(47.37)滤泡状癌 10(26.32) 11(28.95)未分化癌 0(0.00) 0(0.00)TNM 分期/[例(%)] — —Ⅰ期 22(57.89) 18(47.37)Ⅱ期 9(23.68) 11(28.95)Ⅲ期 7(18.42) 9(23.68)手术方式/[例(%)] — —全切 26(68.42) 23(60.53)次全切 12(31.58) 15(42.11)是否淋巴清扫/[例(%)] — —是 33(86.84) 34(89.47)否 5(13.16) 4(10.53)术后时间/月 3.8±0.2 3.7±0.2
2.2 中医证候疗效比较 表2 显示,观察组总有效率显著高于对照组(P<0.05)。

注:与对照组比较,∗P<0.05
2.3 生活质量 表3 显示,治疗后2 组KPS 评分显著升高(P<0.01),以观察组更明显(P<0.05)。
表3 2 组KPS 评分比较Tab.3 Comparison of KPS scores between the two groups

表3 2 组KPS 评分比较Tab.3 Comparison of KPS scores between the two groups
注:与同组治疗前比较,∗P<0.05,∗∗P<0.01;与对照组治疗后比较,#P<0.05
组别 时间 KPS 评分/分观察组 治疗前 76.83±5.29治疗后 88.04±8.91∗∗#对照组 治疗前 77.21±5.23治疗后 82.65±8.36∗
2.4 T 淋巴细胞亚群 表4 显示,治疗后观察组CD3+、CD4+、CD4+/CD8+显著升高 (P <0.05),CD8+显著降低(P<0.05),对照组恰好相反(P<0.05);观察组前三者显著高于对照组 (P <0.01),后者显著低于对照组(P<0.01)。
表4 2 组T 淋巴细胞亚群比较Tab.4 Comparison of T lymphocyte subsets between the two groups
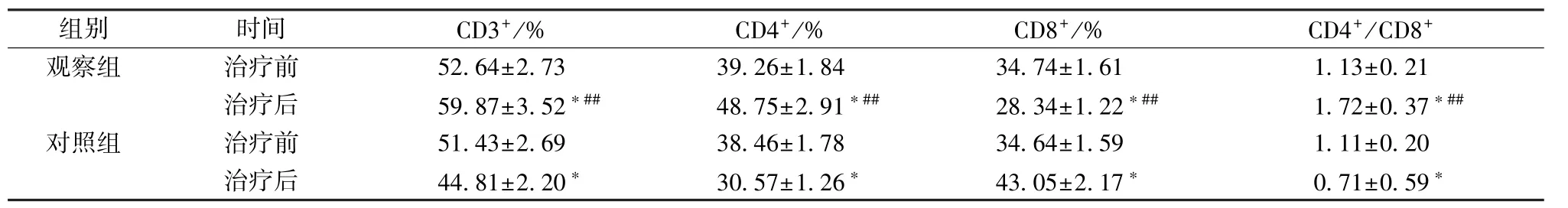
表4 2 组T 淋巴细胞亚群比较Tab.4 Comparison of T lymphocyte subsets between the two groups
注:与同组治疗前比较,∗P<0.05;与对照组治疗后比较,##P<0.01
组别 时间 CD3+/% CD4+/% CD8+/% CD4+/CD8+观察组 治治疗疗前后 55 29..68 47± ±23..75 32 ∗##34 98..27 65± ±12..89 41 ∗##32 48..73 44± ±11..62 12 ∗##11..17 32± ±00..23 1 7∗##对照组 治治疗疗前后 54 14..48 31± ±22..62 90 ∗ 33 80..45 67± ±11..72 86 ∗ 34 43..60 45± ±12..51 97 ∗ 10..17 11± ±00..25 0 9∗
2.5 血清炎症因子 表5 显示,治疗后2 组IL-1、IL-6、TNF-α、Hs-CRP 水平显著降低 (P <0.05,P<0.01),以观察组更明显(P<0.05)。
表5 2 组血清炎症因子比较Tab.5 Comparison of serum inflammatory factors between the two groups
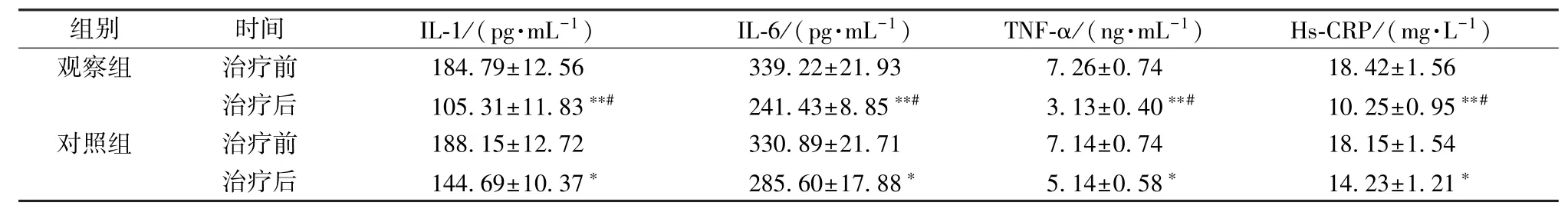
表5 2 组血清炎症因子比较Tab.5 Comparison of serum inflammatory factors between the two groups
注:与同组治疗前比较,∗P<0.05,∗∗P<0.01;与对照组治疗后比较,#P<0.05
组别 时间 IL-1/(pg·mL-1) IL-6/(pg·mL-1) TNF-α/(ng·mL-1) Hs-CRP/(mg·L-1)观察组 治治疗疗前后 11 80 45..73 91± ±11 21..58 63 ∗∗#32 34 91..24 23± ±28 1..8 95 3∗∗ # 73..21 63± ±00..74 40 ∗∗#11 80..42 25± ±10..59 6 5∗∗#对照组 治治疗疗前后 11 84 84..16 59± ±11 20..73 27 ∗ 32 38 05..86 90± ±21 17..78 18 ∗ 75..11 44± ±00..75 48 ∗ 11 84..12 53± ±11..52 4 1∗
2.6 血清肿瘤标志物 表6 显示,治疗后观察组CA50, CA125, CEA、 TG 水 平 显 著 降 低 (P <0.01),而对照组CA50、CA125、CEA 显著降低(P<0.05),TG 水平无显著变化(P>0.05);观察组四者显著低于对照组(P<0.05)。
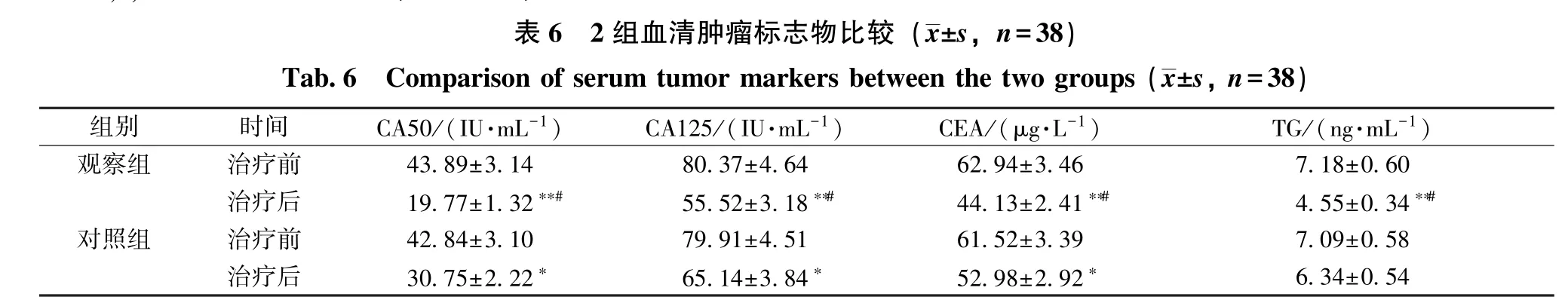
注:与同组治疗前比较,∗P<0.05,∗∗P<0.01;与对照组治疗后比较,#P<0.05
3 讨论
中医认为,甲状腺癌属于“瘿病” 范畴,与机体正气密切相关,其根本在于机体阴阳气血亏虚、正气不足[13],患者经手术和131I 治疗后,可导致气、血、津液大量耗伤和功能紊乱,故术后以气虚、阴虚表现为主,提示上述治疗手段也是重要致病因素[14-15]。研究表明,甲状腺癌术后患者在治疗过程中会产生各种不良反应,加之生理功能减弱,心理情绪调节能力下降,生活能力降低,均会严重影响生活质量[16]。本研究发现,沙参麦冬汤联合碘[131I] 化钠口服溶液治疗甲状腺癌术后患者疗效确切,可明显改善患者生活质量,与文献[10] 报道一致。
甲状腺癌手术是一种特殊形式的创伤,结合术后放化疗时可影响机体神经内分泌反应,导致免疫功能被破坏,炎症反应加重,从而影响预后[17-18]。免疫抑制因子的大量生成会使T 淋巴细胞等人体免疫细胞减少,亚群明显失调,主要表现为CD3+、CD4+、CD4+/CD8+明显降低,CD8+明显升高,对机体免疫功能造成损害[19];甲状腺癌患者外周血NK 细胞比、CD3+、CD4+、CD4+/CD8+较正常人降低,而CD8+升高[19-20];清甲治疗后极易引起局部炎症反应,严重者可存在呼吸困难,使患者内心恐慌,对其生命安全造成威胁[21]。本研究发现,观察组治疗后CD3+、CD4+、CD4+/CD8+较对照组明显升高,CD8+及血清IL-1、IL-6、TNF-α、Hs-CRP水平明显降低,提示沙参麦冬汤可增强甲状腺癌术后患者免疫功能,抑制炎症因子释放,有助于减轻炎症反应。
CA50 是一种唾液酸酯及唾液酸糖蛋白,一般不存在于健康组织内,当机体有细胞恶变时糖基化酶被激活,形成细胞表面糖基结构变异,从而大量分泌CA50 标志物[22];CA125 水平在甲状腺癌患者中明显高于在甲状腺良性疾病患者中[23];CEA是一种广谱肿瘤标志物,对肺癌、肝癌、妇科恶性肿瘤等疾病的诊断及预后具有重要价值,研究表明甲状腺癌患者其血清水平明显升高[24];TG 是由甲状腺上皮细胞合成的大分子糖蛋白,不仅可作为甲状腺良恶性肿瘤鉴别指标,而且还能了解肿瘤是否有周围淋巴结转移[25-26]。本研究发现,观察组血清CA50、CA125、CEA、TG 水平较对照组明显降低,提示沙参麦冬汤可降低甲状腺癌术后患者血清肿瘤标志物水平。
综上所述,沙参麦冬汤联合碘[131I] 化钠口服溶液治疗甲状腺癌术后患者疗效确切,可明显改善患者生活质量,增强免疫功能,抑制炎症因子释放,有助于减轻炎症反应,并能降低血清肿瘤标志物水平,对指导临床用药具有一定意义。
