杠板归乙醇提取物对化学性肝损伤小鼠的保护作用
2019-07-23何国鑫邓青芳陈华国赵丹妮
何国鑫, 邓青芳, 陈华国, 赵丹妮, 周 欣∗
(1.贵州师范大学贵州省山地环境信息系统与生态环境保护重点实验室,贵州 贵阳550001;2.贵州师范大学贵州省药物质量控制及评价技术工程实验室,贵州贵阳550001;3.贵州师范大学天然药物质量控制中心,贵州 贵阳550001)
肝脏是体内新陈代谢的中心站,具有十分重要和复杂的生理功能[1],易受病原体、有毒物质、免疫病理等影响,流行性医学研究表明,肝病的发病率不断攀升,严重危害人类身体健康和生活质量。肝损伤是各种肝脏疾病共有的一种病理状态,其持续恶化会导致肝硬化、肝纤维化、肝癌等[2]。
杠板归为多年生蔓生草本蓼科植物杠板归Polygonum perfoliatum L.的干燥地上部分,具有清热解毒、利水消肿、保肝、止咳等功效[3],在治疗肝损伤方面有一定功效[4-8],但肝损伤同时是否会对其上下游器官——心脏和肾脏造成影响尚不清楚。因此,本实验考察杠板归乙醇提取物对化学性肝损伤小鼠的保护作用,对于阐明该药材肝损伤作用机制具有重要意义,也为其深入研究与相关产品开发提供参考。
1 材料
1.1 药材 杠板归购自贵州省安顺市静宁县,经贵州师范大学陈华国教授鉴定为杠板归Polygonum perfoliatum L.的干燥全草。
1.2 动物 SPF 级雄性KM 小鼠,体质量18 ~22 g,购自长沙市天勤生物技术有限公司[许可证号SCXK(湘)2014-0011]。
1.3 试剂 联苯双酯滴丸(浙江万邦药业股份有限公司,批号A02J151230);谷草转氨酶(AST)、谷丙转氨酶(ALT)、超氧化物歧化酶(SOD)、丙二醛(MDA) 试剂盒(南京建成生物工程研究所)。
1.4 仪器 万分之一天平[梅特勒-托利多仪器(上海) 有限公司,型号AL204];酶标仪(美国Moleaular Devices 公司,型号Max Plus 384);倒置荧光显微镜(广州市明美光电技术有限公司,型号MF53)。
2 方法
2.1 供试药制备 取1 kg 药材粉碎,过60 目筛,85%乙醇回流提取3 次,料液比1 ∶8,每次2 h,合并提取液,过滤,减压蒸馏,浓缩,即得。然后,计算得率并配制成不同质量浓度药液,贮藏备用。
2.2 分组及给药 72 只小鼠随机分为空白组、模型组、联苯双酯滴丸组(150 mg/kg) 及杠板归乙醇 提 取 物 高、 中、 低 剂 量 组 (1.28、 0.64、0.32 g/kg)。除空白组外,其余各组小鼠均腹腔注射含1%CCl4橄榄油溶液(10 mL/kg) 造模,每3 d1 次。1 周后,各给药组按照10 mL/kg 剂量灌胃给予相应剂量药物,空白组、模型组灌胃给予等体积生理盐水,连续3 周,同时除空白组外,其余各组继续腹腔注射含1%CCl4橄榄油溶液。
2.3 血清AST、ALT 活性测定 末次给药后,小鼠禁食不禁水16 h,眼球取血,3 500 r/min 离心10 min,取上层血清,-20 ℃下保存,按照试剂盒标准,采用生化法检测AST、ALT 活性。
2.4 各组织中SOD 活性、MDA 水平测定 小鼠脱臼处死后,迅速解剖取肝脏、心脏、肾脏,冰生理盐水冲洗,滤纸吸干表面水分后称定质量,计算相关脏器指数,公式为脏器指数=脏器质量/体质量。在脏器固定位置取各组织约100 mg,洗净后按1 ∶9 比例加入冰生理盐水,冰水浴上制成10%组织匀浆,4 ℃、3 500 r/min 离心10 min,取上清,-20 ℃下保存备用。然后,考马斯亮蓝法进行蛋白定量,酶联免疫吸附(ELISA) 法检测SOD活性、MDA 水平。
2.5 组织病理学变化观察 将剩余小鼠肝脏、心脏、肾脏于10%福尔马林溶液中固定48 h,经过脱 水、 石 蜡 包 埋、 切 片、 脱 蜡、 苏 木 素-伊 红(HE) 染色等标准步骤后,制作常规HE 染色切片,光学显微镜下观察组织病理学变化。
2.6 统计学分析 通过SPSS 21.0 软件进行处理,数据以(±s) 表示,组间比较采用t 检验。P <0.05 表示差异有统计学意义。
3 结果
3.1 杠板归乙醇提取物对脏器指数的影响 表1显示,与空白组比较,模型组脏器指数显著升高(P<0.01);与模型组比较,除杠板归乙醇提取物高剂量组心脏指数外,各给药组脏器指数均有所降低,但无显著差异(P>0.05)。
表1 杠板归乙醇提取物对脏器指数的影响(±s,n=12)Tab.1 Effects of ethanol extract of P.perfoliatum on viscera indices(±s,n=12)
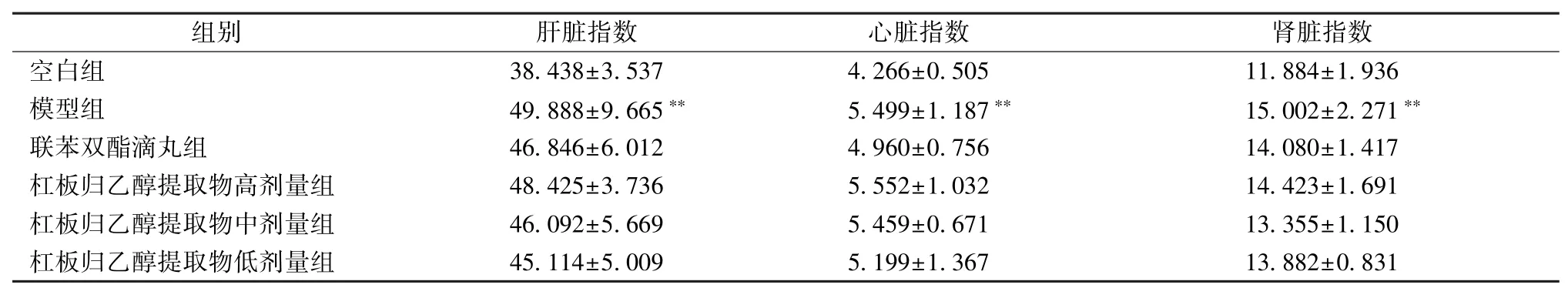
表1 杠板归乙醇提取物对脏器指数的影响(±s,n=12)Tab.1 Effects of ethanol extract of P.perfoliatum on viscera indices(±s,n=12)
注:与空白组比较,∗∗P<0.01
组别 肝脏指数 心脏指数 肾脏指数空模白型组组 34 89..48 38 88± ±39..56 36 75 ∗∗ 45..24 69 69± ±01..51 08 57 ∗∗ 11 15..80 80 42± ±12..92 37 6 1∗∗联苯双酯滴丸组 46.846±6.012 4.960±0.756 14.080±1.417杠板归乙醇提取物高剂量组 48.425±3.736 5.552±1.032 14.423±1.691杠板归乙醇提取物中剂量组 46.092±5.669 5.459±0.671 13.355±1.150杠板归乙醇提取物低剂量组 45.114±5.009 5.199±1.367 13.882±0.831
3.2 杠板归乙醇提取物对AST、ALT 活性的影响 表2 显示,与空白组比较,模型组AST、ALT活性显著升高(P<0.01);与模型组比较,杠板归乙醇提取物组两者活性(除低剂量组AST 外) 显著降低(P<0.05,P<0.01)。
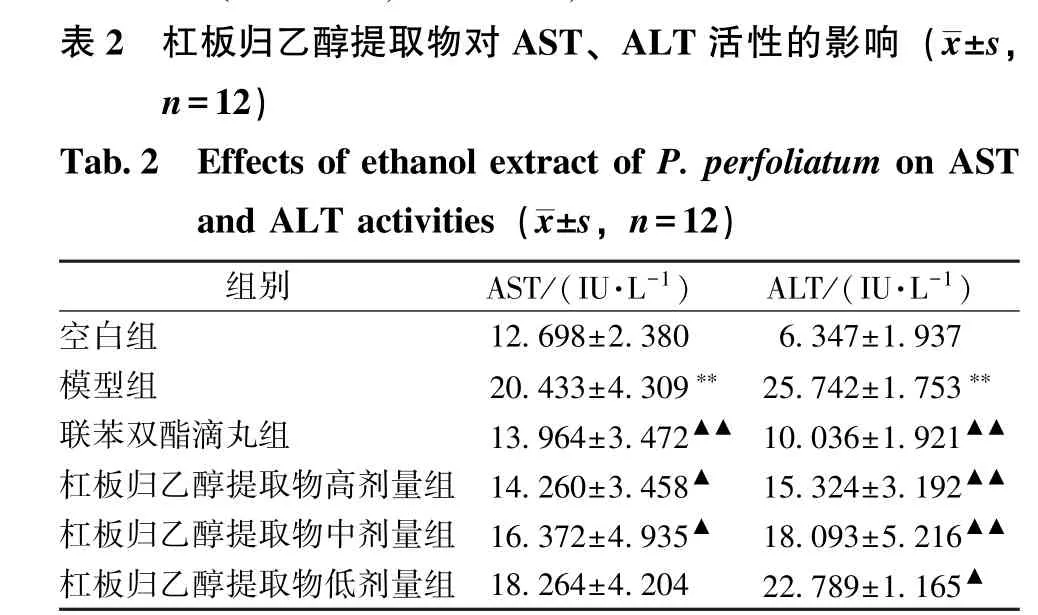
注:与空白组比较,∗∗P <0.01;与模型组比较,▲P <0.05,▲▲P<0.01
3.3 杠板归乙醇提取物对各组织中SOD 活性、MDA 水平的影响 表3 ~4 显示,与空白组比较,模型组各组织中SOD 活性显著降低(P<0.05,P<0.01),MDA 水平显著升高(P<0.05,P<0.01);与模型组比较,杠板归乙醇提取物高、中剂量组各组织中(除中剂量组心脏中外) 前者活性显著升高(P<0.05),高剂量组各组织中、中剂量组肝脏中后者水平显著降低(P<0.05)。
3.4 杠板归乙醇提取物对小鼠组织病变的影响
3.4.1 肝脏HE 染色 图1 显示,空白组小鼠肝小叶结构完整清晰,肝细胞索排列整齐,肝细胞形态正常,无细胞坏死等病变;模型组小鼠肝小叶结构模糊,肝细胞索紊乱,伴有炎性细胞浸润,细胞出现片状坏死;联苯双酯滴丸组、杠板归乙醇提取物组小鼠病变程度较轻,肝小叶结构基本完整,炎症细胞浸润改善,无片状细胞坏死。
表3 杠板归乙醇提取物对各组织中SOD 活性的影响(,n=12)Tab.3 Effects of ethanol extract of P.perfoliatum on SOD activity in various tissues(,n=12)

表3 杠板归乙醇提取物对各组织中SOD 活性的影响(,n=12)Tab.3 Effects of ethanol extract of P.perfoliatum on SOD activity in various tissues(,n=12)
注:与空白组比较,∗P<0.05,∗∗P<0.01;与模型组比较,▲P<0.05
组别 肝脏/(U·mg prot-1) 心脏/(U·mg prot-1) 肾脏/(U·mg prot-1)空模联杠杠白型苯板板组组双归归 酯乙乙 滴醇醇丸提提组取取 物物 高中剂剂量量组组 21211 75087 56180.....39633 68546 40765±±±±±22712 55.84..6..30355 71126 5144▲ ∗▲▲ ∗ 21211 15087 47507.....84463 83022 84195±±±±±23223 44512.....61374 53342 78159 ∗▲▲∗ 21111 04788 33570.....64106 22615 25262±±±±±32213 18640.....56346 65805 24754∗▲▲▲杠板归乙醇提取物低剂量组 168.365±28.247 176.783±30.920 183.772±30.572
表4 杠板归乙醇提取物对各组织中MDA 水平的影响(,n=12)Tab.4 Effects of ethanol extract of P.perfoliatum on MDA level in various tissues(,n=12)

表4 杠板归乙醇提取物对各组织中MDA 水平的影响(,n=12)Tab.4 Effects of ethanol extract of P.perfoliatum on MDA level in various tissues(,n=12)
注:与空白组比较,∗P<0.05,∗∗P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01
组别 肝脏/(nmol·mg prot-1) 心脏/(nmol·mg prot-1) 肾脏/(nmol·mg prot-1)空模联杠杠白型苯板板组组双归归 酯乙乙 滴醇醇丸提提组取取 物物 高中剂剂量量组组 11 84891.....47946 74752 48125±±±±±72415.....88663 56791 84662 ∗▲▲▲ ▲ 14233 12801.....54161 07450 40323±±±±±41191.32.3 5..0.06481 52978 680▲∗▲∗▲ 11111 16334.....80293 70779 25024±±±±±34233.....85709 05602 13026∗▲▲杠板归乙醇提取物低剂量组 11.704±6.354 31.352±9.715 14.662±3.048
3.4.2 心脏HE 染色 图2 显示,空白组小鼠心肌细胞排列紧密,细胞核呈椭圆形,胞质呈均一状;模型组小鼠部分心肌细胞呈轻度肥大状,胞质局部淡染,间质内部分毛细血管充血和炎细胞浸润;联苯双酯滴丸组、杠板归乙醇提取物组小鼠心肌细胞肥大现象明显减轻。
3.4.3 肾脏HE 染色 图3 显示,空白组小鼠肾小球内皮细胞、足细胞、系膜细胞未见异常;模型组小鼠肾小球内毛细血管腔高度扩张,内皮细胞核呈固缩状,胞质空化,基底膜变薄,足细胞高度肿胀,胞质空化,足突细小或局部融合;联苯双酯滴丸组、杠板归乙醇提取物组小鼠肾小球结构均有不同程度的改善。
4 讨论
中医认为,心主血,肝藏血,肝为心之母,母病及子,故肝病可累及心,临床上肝病可及心,心病可及肝;肝藏血,肾藏精,精血同生,故肝阴和肾阴相互滋养,并且肝肾相生,均内藏相火,同时相火源于命门, 故肝和肾虚实密切相关, 相互制约。
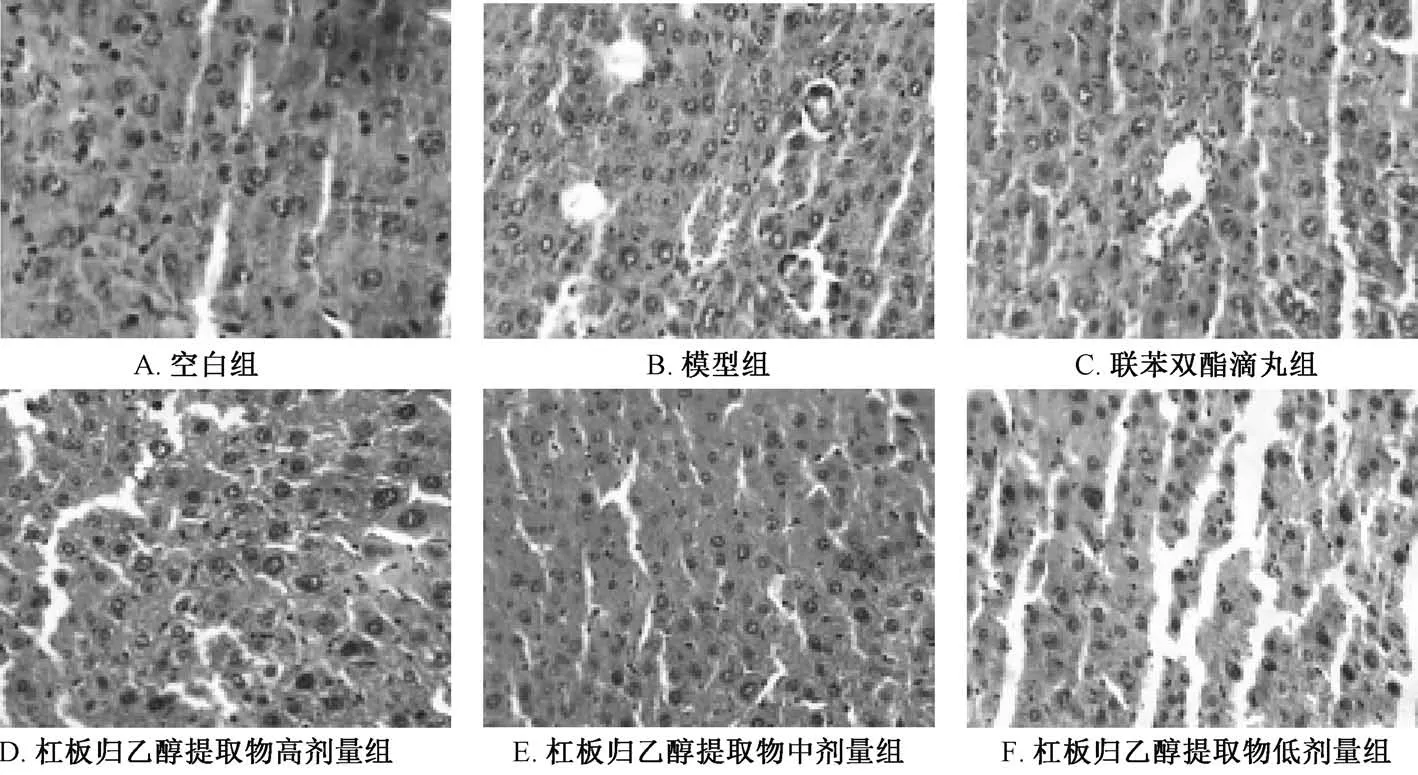
图1 杠板归乙醇提取物对小鼠肝脏组织病理形态学的影响(×400)Fig.1 Effect of ethanol extract of P.perfoliatum on the pathomorphology of mouse liver tissues(×400)
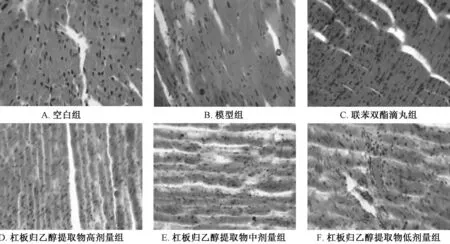
图2 杠板归乙醇提取物对小鼠心脏组织病理形态学的影响(×400)Fig.2 Effect of ethanol extract of P.perfoliatum on the pathomorphology of mouse heart tissues(×400)
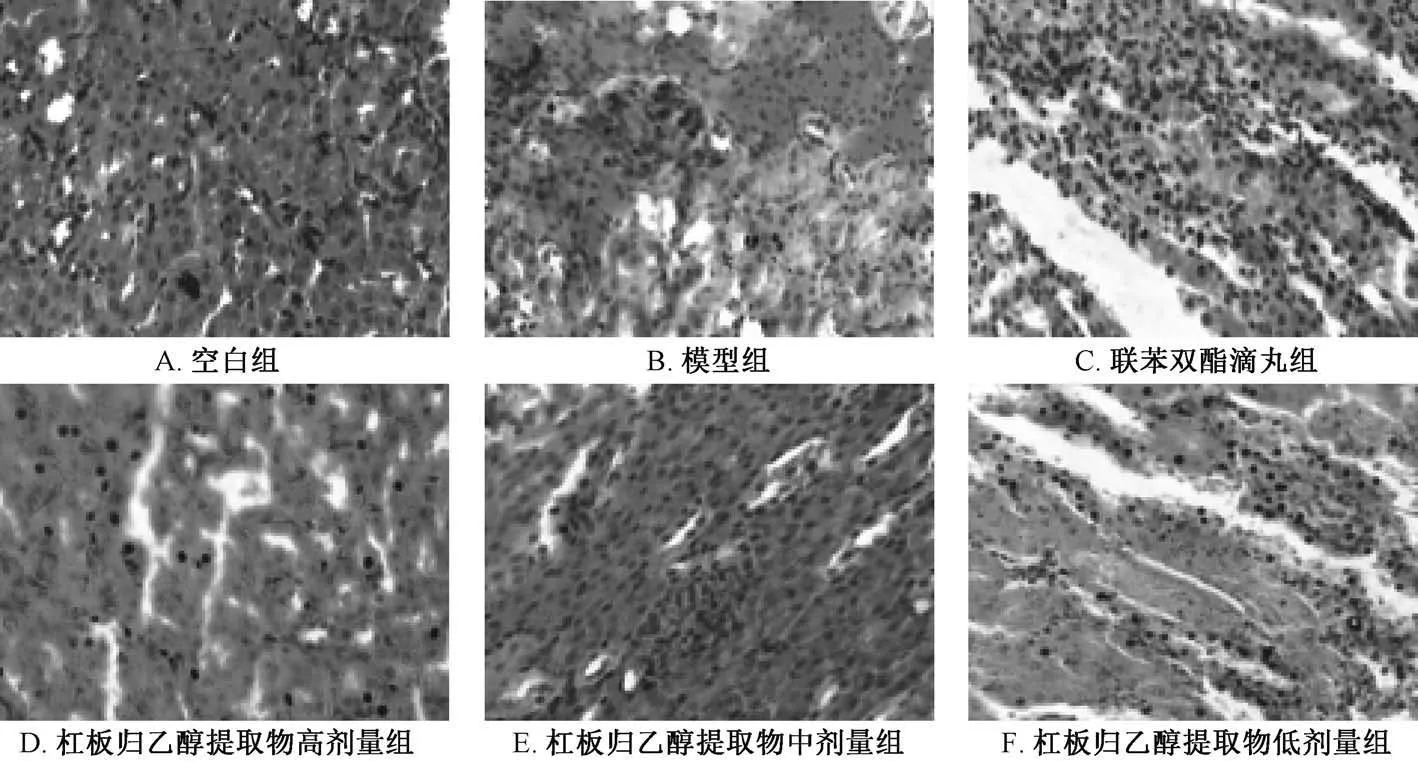
图3 杠板归乙醇提取物对小鼠肾脏组织病理形态学的影响(×400)Fig.3 Effect of ethanol extract of P.perfoliatum on the pathomorphology of mouse kidney tissues(×400)
化学性肝损伤是由化学肝毒物质所造成的肝损伤,而CCl4是公认的复制肝损伤动物模型的化学物质[5],故本实验以其诱导小鼠亚急性肝损伤。结果,模型组与空白组之间各指标存在明显差异,可认为造模成功。
AST、ALT 均为非特异性细胞内功能酶,是临床上常用肝功能评价指标,正常情况下两者活性在血清中很低,而当肝细胞损伤时会发生变化,故其在一定范围内可反映生物体内肝细胞损伤程度[9]。本实验发现,杠板归乙醇提取物可明显降低AST、ALT 活性,表明它可改善肝细胞膜通透性和流动性,减少肝功能损伤。
SOD 能清除自由基以维持细胞不受自由基损害,其主要作用是降解清除体内的活性氧自由基,故检测其活性可反映清除自由基的能力及抗氧化能力[10];MDA 作为脂质过氧化终产物,是反映组织损伤时出现过强氧化作用的指标之一,其活性越高,表明氧化活性越强,组织受损程度越大[11]。本实验发现,杠板归乙醇提取物能明显升高SOD、MDA 活性,表明它可有效维持组织抗氧化体系平衡状态,减轻CCl4引发组织氧化损伤。
另外,组织病理学发现杠板归乙醇提取物可明显减轻小鼠肝脏、心脏、肾脏细胞病理损伤,表明它在保护肝脏受损的同时对两者也有改善作用,但其关联机制还需进一步深入研究。
