LHR在不同繁殖期牦牛睾丸组织的表达比较
2019-07-22李亚超马云云陶金忠袁莉刚李琪梁晶晶
李亚超,马云云,陶金忠,袁莉刚,李琪,梁晶晶
(1.甘肃农业大学动物医学院,甘肃 兰州 730070;2.宁夏大学农学院,宁夏 银川 750021)
哺乳动物睾丸局部激素调控是精子发生过程中的关键步骤,其中促黄体生成激素(luteinizing hormone,LH)是主要调节激素之一.LH又称leydig细胞刺激素,是leydig细胞合成和分泌雄激素至关重要的调节因子,亦可反馈抑制下丘脑GnRH和腺垂体FSH及LH的分泌.LH主要通过与睾丸leydig细胞上的促黄体生成素受体(luteinizing hormone receptor,LHR)结合,在内分泌细胞的信号传导过程发挥作用,并参与精子生成、受精卵着床、性腺发育等一系列生理活动[1].免疫组化研究表明,相较于其他各生殖器官,仓鼠睾丸中LHR表达量最高[2].研究发现水牛卵泡期卵巢中LHR的表达量高于黄体期,在黄体期子宫中LHR的表达量高于卵泡期,表明其参与卵巢黄体生成及诱发排卵等功能的调节[3].研究表明,同一发情周期中不同发育阶段的山羊子宫内LHR mRNA表达差异明显,提示其参与发情周期的调节[4].研究报道繁殖季节野生公鹿和母鹿垂体中LH阳性表达比非繁殖季节强烈[6].研究资料表明,狍、白尾鹿和红鹿等FSH和LH季节性分泌的起伏与繁殖期变化相一致[7-9].因此,LH及其受体在生殖器官的表达差异与动物的季节性繁殖及其调控关系密切.
牦牛为高原环境中的季节性繁殖动物,表现为暖季发情,其生殖发育相关调节因子在不同繁殖期有一定的表达差异.研究报道VEGF及其受体在性成熟牦牛不同繁殖期睾丸组织中表达差异明显,二者参与精子发生及局部微环境的调节[10].早期研究表明,LHR在不同年龄牦牛睾丸leydig细胞及支持细胞中有表达,在性成熟及老龄牦牛睾丸呈中等阳性表达,性成熟青年期牦牛阳性表达弱有降低,表明其主要起到调节leydig细胞及支持细胞生理功能的作用[11].在此基础上,本研究通过组织化学染色及免疫组织化学技术结合形态计量比较LHR在不同繁殖期牦牛睾丸组织的表达,分析LHR分布变化与牦牛季节性发情的关系,旨在为高原哺乳动物季节性调控研究提供形态学参考.
1 材料与方法
1.1 试验材料
在青海西宁市大通养殖户采集5岁繁殖期(7~9月)和繁殖间期(1~2月)成年牦牛睾丸样品,于4%的多聚甲醛溶液固定.
免疫组化染色试剂盒(SP-9001,由美国ZYED 生产,购自北京中杉金桥生物技术有限公司);DAB显色试剂盒(ZLI-9108,北京中杉金桥生物技术有限公司);苏木精-伊红染料(台山市化工有限公司);过碘酸Schiff染色试剂和阿尔辛蓝过碘酸Schiff染色试剂;LHR抗体(北京中杉金桥生物技术有限公司).
EPON812包埋机,LKB8800型超薄切片机,NIKON ECLIPSE 80i显微摄像系统.
1.2 试验方法
1.2.1 样品制备 将组织样品切成1 cm×1 cm×0.6 cm大小,4%多聚甲醛磷酸盐缓冲液中固定,不同梯度酒精脱水,二甲苯透明,组织浸蜡,包埋,连续切片(5 μm),制成石蜡切片.
1.2.2 苏木精-伊红(H.E)常规染色 切片梯度酒精脱蜡后,放入苏木精染液2 min,流水冲洗2次,5 min/次,随后用1%的盐酸分化2次,每次2 s;之后用流水冲洗10 min,待切片返蓝后,伊红染液染色1 min,梯度酒精脱水,二甲苯溶液透明20 min,最后用中性树脂封片.
1.2.3 PAS和AB糖原染色 切片脱水、脱蜡后,滴加1% AB醋酸水溶液10~20 min,蒸馏水洗2次,用1%过碘酸水溶液氧化5~10 min,滴加Schiff氏试剂染色10~20 min,每张切片滴加50 μL偏重亚硫酸钠连续3次,每次2 min,间隔1 min,流水冲洗5~10 min,用苏木精染液过染2~3 min,盐酸分化液分化1次,流水冲洗10 min,常规脱水透明、封片.PAS染色,苏木精复染.染色后中性粘蛋白呈红色.AB染色(pH=2.5)酸性粘蛋白呈蓝色,核淡红色[12].
1.2.4 免疫组织化学法 免疫组化(streptavidin-perosidase,SP)法染色,切片梯度酒精脱水、脱蜡后,酒精梯度分化;使用30 g/L H2O2溶液在37 ℃条件下孵育15 min阻断过氧化物酶活性,随后用蒸馏水洗1次,5 min/次,PBS洗3次,5 min/次,将5%~10%正常山羊血清(PBS稀释)封闭,37 ℃孵育15 min后倾去血清(即正常山羊血清白蛋白);在切片上滴加50 μL兔多克隆抗鼠,稀释度为1∶400的促黄体生成素受体-IgG,在37 ℃条件下孵育4 h, PBS洗涤3次,5 min/次,之后将50 μL生物素标记的山羊抗兔IgG工作溶液加入到每个切片中,37 ℃孵育15 min,PBS洗涤3次,5 min/次,随后加50 μL适当比例PBS稀释的辣根酶标记链霉卵白素工作液,37 ℃条件孵育15 min后用PBS冲洗5 min,洗3次;随后滴加新鲜配的DAB显色溶液显色,常规脱水透明、封片.阴性对照用PBS替代兔源一抗进行染色.
1.3 数据处理
NIKON ECLIPSE 80i显微摄像系统进行照相.采用半定量的形式对染色结果的分布密度进行描述,-:无阳性表达;+/-:偶有阳性表达;+:阳性表达;++:中等强度阳性表达;+++:强阳性表达;++++:高密度强阳性[13].
随机选取5张切片,每张切片随机选取6个不重复视野(×400),用Image Pro Plus 6.0软件统计染色结果中每个视野下阳性信号强度均值与阳性面积计算表达平均吸光度;1组共计30个统计数据,结果计为均值±标准差,SPSS 15.0软件统计分析,采用单因素方差分析同一蛋白组间表达量的差异.
2 结果与分析
2.1 不同繁殖季节牦牛睾丸的组织化学特点
光镜下,繁殖期性成熟牦牛睾丸组织生精上皮由4~8层生精细胞及sertoli细胞构成,大量成熟精子明显分布于腔面,管周肌样细胞围绕于生精小管固有膜外周,间质结缔组织分布明显,leydig细胞散布其中(图1-A,1-B).特殊染色表明,睾丸生精上皮及间质PAS紫红色阳性条带明显,生精上皮近腔面处亦可见阳性反应(图1-C);AB蓝色阳性条带清晰分布于间质毛细血管壁,leydig细胞周围无明显表达(图1-D).繁殖间期睾丸组织的生精上皮为4~6层细胞,与繁殖期相比,睾丸组织结构变化不明显(图1-G,1-H),PAS紫红色阳性在睾丸小管基膜及间质表达明显减弱(图1-I),但间质毛细血管壁及生精小管固有膜AB蓝色阳性条带清晰明显(图1-J).
2.2 LHR在成年牦牛睾丸组织中的表达
免疫组织化学染色结果显示,LHR在繁殖期牦牛睾丸组织leydig细胞、sertoli细胞为弱阳性表达,各级生精细胞几乎无表达(图1-E,表1),阴性对照无表达(图1-F).繁殖间期,LHR在leydig细胞呈高密度强阳性表达,生精上皮未见明显表达(图1-K),阴性对照无表达(图1-L).
2.3 LHR在不同周期牦牛睾丸免疫组织化学检测结果对比分析
免疫组织化学图像统计结果显示,牦牛睾丸组织中LHR在繁殖间期的平均吸光度高于繁殖期,统计学差异显著(图2).
3 讨论
PAS及AB-PAS阳性反应的糖原、糖蛋白以及蛋白多糖很典型的存在于睾丸结缔组织、粘液以及基膜中,受体蛋白、肿瘤细胞表面抗原等亦均属糖蛋白,粘蛋白及糖类物质与睾丸生精功能及激素合成密切相关.早期研究表明,单峰驼睾丸PAS阳性反应条带主要在血管壁及生精小管外周,PAS随生精小管上皮发育周期阶段性变化而差异明显,生殖周期早期PAS反应最丰富,后期则明显缺乏[14].单峰驼精子发生需要多种糖缀合物,其含量随不同繁殖季节差异明显,繁殖期尤为丰富[15].与此相一致,本研究中,PAS在繁殖间期较繁殖期表达减弱,表明PAS与繁殖上皮发育营养需要密切相关.研究报道,AB阳性反应在老龄小鼠睾丸 leydig 细胞及基质中会较青年小鼠增强[16];与此相似,繁殖间期的老龄牦牛睾丸间质血管及生精小管固有膜中AB阳性反应较青年牦牛增强[17].本研究中,繁殖间期反映酸性粘多糖表达增强的AB阳性反应较繁殖期明显,繁殖期PAS阳性反应的中性粘蛋白表达则较强,且不同繁殖季节睾丸局部粘多糖的表达差异明显,糖蛋白参与免疫、分泌、物质转运、信息传递、分化的调节及再生等,酸性粘多糖可在局部组织中生物还原为相应的中性粘多糖,繁殖间期以酸性粘多糖为主,提示可能与局部组织生化反应的改变有关,繁殖活动增强主要与中性粘蛋白关系密切.
LH是动物机体内重要的生殖激素,与细胞的特异性糖蛋白受体(LHR)结合激活腺苷酸-蛋白激酶(cAMP/PKA)信号通路而刺激类固醇激素的合成,在生殖过程发挥作用[1];LH与LHR结合后,细胞内cAMP活化并增多,与Leydig细胞的发育、青春期睾酮的分泌以及精子成熟密切相关[2].卢全生等[18]发现,SD大鼠睾丸组织LHR水平表现为冬高夏低,表明LHR的表达受季节因素的影响.本研究中,LHR在繁殖期牦牛睾丸sertoli细胞为弱阳性,不同繁殖期的生殖上皮均未见明显表达,提示LHR或者并不直接参与性成熟后牦牛不同季节生精过程的调节;大鼠睾丸免疫组化定位显示,LHR主要表达于Leydig细胞膜,也有少量表达于Leydig细胞质[19],与此相一致,本研究中LH在leydig细胞分布为主,繁殖间期的阳性表达强于繁殖期,提示高原地区繁殖季节对LHR在leydig细胞的表达有调节作用.

A~F:繁殖期牦牛睾丸组织;G~L:繁殖间期牦牛睾丸组织;A、B、G、H:HE染色;C、I:PAS染色;D、J:AB染色;E、K:LHR免疫组化染色;F、L:免疫组化染色阴性对照;BC:毛细血管;IT:间质;Ley:间质细胞;ST:生精小管.A~F:The structure of yak testicle in breeding season;G~L:The structure of yak testicle in non-breeding season;A、B、G、H:The hematoxylin-eosin staining;C、I:The periodic acid Schiff staining;D、J:The Alcian-Blue staining;E、K:The LHR immunohistochemical staining;F、L:The immunohistochemical staining negative control;BC:Blood capillary;IT:Interstitial;Ley:Leydig cells;ST:Seminiferous tubue.图1 不同繁殖周期成年牦牛睾丸组织化学特点及LHR表达比较Figure 1 The comparison of histochemical characteristics and LHR expression in the testicle of adult yak between breeding and non-breeding seasons

表1 LHR在牦牛睾丸繁殖期和繁殖间期不同部位的分布密度Table 1 The density of LHR in different parts of yak testis in the breeding season and the non-breeding season
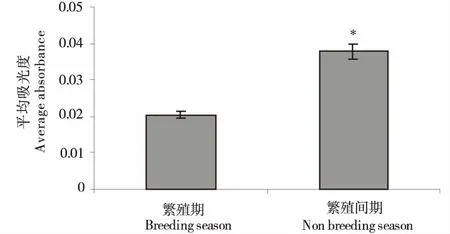
*同一蛋白组间差异显著(P<0.05).* means significant difference between groups(P<0.05).图2 不同繁殖期成年牦牛睾丸LHR表达统计Figure 2 The comparison of LHR expression in the testicle of adult yak between breeding and non-breeding seasons
季节性繁殖雄性动物,睾丸酮在非繁殖季节减少,局部粘附分子的表达降低,同时诱导生殖细胞生成减少[20].研究表明,人LHR胞外区占50%以上,有6个潜在的糖基化位点,与其所处微环境中糖蛋白生化条件密切相关[21 ].研究表明,小鼠在试验性长距离运输后,睾丸中睾酮水平下降,精子数量减少,但是LHR表达增加,可能影响了精子的生成[22].本研究中繁殖间期牦牛睾丸间质组织以酸性粘多糖阳性表达为主,LHR表达量明显增加,二者是否存在一定关系需进一步研究.资料表明,LHR mRNA主要表达在日本黑熊的Leydig细胞,且随不同繁殖季节在睾丸活跃期、退化期和复苏期表达量逐渐增加[23].本研究中LHR在繁殖间期牦牛睾丸leydig细胞强表达,显著强于繁殖期,也可能与日本黑熊的表达相一致,LHR通过对睾丸局部leydig细胞的抑制,减少睾酮分泌,由此睾丸精子生成功能亦相对降低,其机理有待于进一步研究.
4 结论
PAS和AB在成年牦牛睾丸组织分布繁殖期略强于繁殖间期,提示其与繁殖期生精活动增强有关;LHR表达在睾丸以leydig细胞阳性分布为主,提示高原地区繁殖季节对LHR在leydig细胞的表达有调节作用.
