亚临床甲状腺功能减退症与2型糖尿病肾功能损伤的相关性研究
2019-07-22王珊珊俞冰鸿傅雯雯杨艳辉孔岩王靖宇常宝成郑妙艳杨菊红王颖许杰单春艳
王珊珊 俞冰鸿 傅雯雯 杨艳辉 孔岩 王靖宇 常宝成 郑妙艳 杨菊红 王颖 许杰 单春艳
天津医科大学朱宪彝纪念医院肾内科,国家卫生健康委员会激素与发育重点实验室(天津医科大学),天津市代谢性疾病重点实验室,天津医科大学朱宪彝纪念医院&天津市内分泌研究所 300134
糖尿病和甲状腺疾病是内分泌系统常见的疾病,二者为复杂且相互作用的关系。甲状腺激素(TH)直接影响体内三大营养物质的代谢,参与血糖及胰岛功能的调节。糖尿病肾脏疾病(DKD)是糖尿病一个主要的微血管并发症,现已成为慢性肾脏疾病的主要病因,未来有可能成为终末期肾病(ESRD)的首要病因[1-2]。研究发现,TH可直接影响肾脏生长和发育、肾小球滤过率(GFR)、肾脏转运系统、钠水的体内平衡。TH的微小变化即可诱导血清促甲状腺激素(TSH)水平呈指数变化,而TSH是甲状腺功能最敏感、最特异的生化指标。亚临床甲状腺功能减退症(SCH)通常缺乏明显的临床症状和体征,在生化上被定义为TSH水平升高而血清FT4、TT4水平正常[3]。早期,临床医生关注SCH主要因其增加心血管疾病的风险及全因死亡率[4]。近10年来,SCH与DKD的相关研究越来越多,但目前对TSH的参考范围上限不统一,DKD的诊断缺乏特异性的标准和指标,研究结果异质性较大。故本研究回顾性分析了2型糖尿病(T2DM)患者中不同TSH水平与肾功能损伤的相关性。
1 对象与方法
1.1 对象 收集2017年9月至2018年8月在天津医科大学代谢病医院住院的T2DM(WHO 1999年标准)患者656例,其中男415例,女241例,年龄(56.09±11.64)岁,病程(10.67±7.55)年,体重指数(26.80±3.99) kg/m2。排除标准:(1)除T2DM外的其他类型糖尿病。(2)合并糖尿病酮症酸中毒、高渗高血糖昏迷等糖尿病急性并发症。(3)急性泌尿系统感染及其他疾病所致的急、慢性肾脏疾病。(4)严重心、肺、肝功能疾病及其他系统的严重疾病。(5)恶性肿瘤。(6)自身免疫性疾病。(7)影响代谢功能的慢性疾病,包括下丘脑、垂体、肾上腺疾病。(8)既往及新发的甲状腺功能亢进症、甲状腺功能减退症、亚临床甲状腺功能亢进症及曾行甲状腺手术、131I治疗、口服甲状腺素或抗甲状腺药物的患者。(9)长期服用胺碘酮、锂盐、抗癫痫药物、利福平药物患者。(10)妊娠或哺乳期妇女。(11)资料不全的患者。诊断标准:(1)T2DM诊断标准:空腹静脉血浆血糖≥7.0 mmol/L或口服葡萄糖耐量试验2 h静脉血浆血糖≥11.1 mmol/L。(2)DKD诊断标准:以持续性白蛋白尿[尿白蛋白排泄率(UAER)≥30 mg/24 h;尿白蛋白与肌酐比值(UACR)≥3 mg/mmol或30 mg/g]或GFR进行性下降≤60 ml·min-1·(1.73 m2)-1超过3个月,同时排除高血糖以外其他原因引起的慢性肾脏病。(3)SCH诊断标准:TSH水平升高而TT4、FT4水平正常,其中TSH>4.2 mIU/L为诊断切点[3]。本研究经医院伦理委员会批准,且所有患者均签署知情同意书。
1.2 方法 (1)检测指标及方法:研究对象在空腹状态下测量身高、体重、腰围、臀围。计算体重指数。患者平静休息至少15 min后采用台式血压计测定血压。所有研究对象生化数据来自天津医科大学代谢病医院检验学中心。研究对象晚餐后禁食至少8 h,次日空腹取静脉血。采用全自动生化分析仪测定肝肾功能、血脂等生化指标,高效液相法测定糖化血红蛋白。甲状腺功能指标测定:采用化学发光法测定,正常参考值:TSH:0.27~4.20 mIU/L,FT4:12.0~22.0 pmol/L,FT3:3.15~6.80 pmol/L,甲状腺过氧化物酶抗体(TPOAb):0~34 IU/ml。晨尿测定:研究对象血糖控制平稳后晨起空腹留取中段尿,采用免疫透射比法、生化法、ELISA法测定。24 h尿定量测定:研究对象血糖平稳后留取当日7:00至次日7:00的24 h尿液,留尿前避免剧烈运动,适量饮水,采用免疫散射比浊法检测尿液白蛋白,采用酶法检测尿肌酐,正常参考值:UAER:0~20 mg/24 h、尿肌酐:8.84~13.30 mmol/24 h。尿白蛋白排泄异常:UAER≥30 mg/24 h,大量白蛋白尿:UAER>300 mg/24 h。估算的GFR(eGFR)计算:采用慢性肾脏病流行病学合作组(CKD-EPI)公式计算。(2)分组标准:按照是否合并DKD分为两组:非DKD组(425例,男262例,女163例);DKD组(231例,男153例,女78例)。按照TSH水平分为3组:TSH正常低值组(383例,男261例,女122例):TSH<2.5 mIU/L;TSH正常高值组(199例,男119例,女80例):2.5 mIU/L≤TSH≤4.2 mIU/L;SCH组(74例,男35例,女39例):TSH>4.2 mIU/L。

2 结果
2.1 患者一般资料比较 非DKD组与DKD组间女性患者比例、谷丙转氨酶、谷草转氨酶、HbA1c、空腹静脉血糖、低密度脂蛋白-胆固醇、TPOAb阳性率差异均无统计学意义。与非DKD组相比,DKD组血尿酸、年龄、病程、体重指数、收缩压、舒张压、高血压患病率、甘油三酯、总胆固醇、糖尿病视网膜病变及大量白蛋白尿患病率、24 h尿蛋白定量、TSH水平、SCH患病率均升高,血清白蛋白、eGFR降低、FT3及FT4水平均降低(P均<0.05),见表1。不同TSH水平患者间谷丙转氨酶、谷草转氨酶、血尿酸、舒张压、高血压患病率、HbA1c、空腹静脉血糖、甘油三酯、总胆固醇、低密度脂蛋白-胆固醇差异均无统计学意义。与TSH正常低值组、TSH正常高值组相比,SCH组女性患者比例、体重指数、24 h尿蛋白定量、TSH、TPOAb阳性率、大量白蛋白尿及DKD患病率均升高,eGFR、FT4水平均降低(P均<0.05)。与TSH正常低值组相比,SCH组年龄、病程、收缩压、血清白蛋白、糖尿病视网膜病变患病率均升高(P均<0.05)。与TSH正常低值组相比,正常高值组各指标差异均无统计学意义,见表2。

表2 3组不同TSH水平患者临床特征比较中位数(四分位数)]

注:ALB:血清白蛋白;ALT:谷丙转氨酶;AST:谷草转氨酶;eGFR:估算的肾小球滤过率;UA:血尿酸;BMI:体重指数;SBP:收缩压;DBP:舒缩压;HBP:高血压;FPG:空腹血糖;TG:甘油三酯;TC:总胆固醇;LDL-C:低密度脂蛋白-胆固醇;DKD:糖尿病肾脏疾病;DR:糖尿病视网膜病变;TSH:促甲状腺激素;TPOAb:甲状腺过氧化物酶抗体;U-Pro:尿蛋白;与TSH正常低值组相比,aP<0.05;与TSH正常高值组相比,bP<0.05;1 mmHg=0.133 kPa
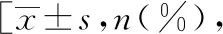
表1 非DKD组与DKD组患者的一般资料中位数(四分位数)]
2.2 不同TSH水平与DKD的logistic回归分析 以不同TSH水平为自变量,DKD为因变量进行logistic回归分析,结果显示:校正年龄、性别、病程、体重指数、HbA1c、甘油三酯、总胆固醇、高血压后(Mode2),SCH与DKD呈正相关。以SCH为自变量,DKD为因变量进行logistic回归分析,结果显示,无论是否校正危险因素,SCH与DKD均相关,见表3、4。

表3 不同TSH水平与DKD的logistic回归分析

表4 SCH与DKD的logistic回归分析
3 讨论
近来一项荟萃分析显示,T2DM合并SCH的患病率为10.2%,T2DM患者SCH的危险性增加1.93倍(95%CI: 1.66~2.24)[5]。Díez等[6]研究显示,T2DM患者SCH的患病率8.5%,其中女性10.4%,男性5.8%。本研究中,T2DM患者SCH的患病率为11.3%(74/656)。女性患者SCH的患病率(16.1%,39/241)明显高于男性(8.4%,35/415),性别相关的差异可能与性激素导致下丘脑-垂体-甲状腺轴异常,使T4向T3转换异常,TT3、FT3水平下降及rT3水平升高等有关[7]。
甲状腺功能异常和糖尿病微血管病变的相关性越来越受到关注,但相关的研究结果不一。TSH的参考范围上限不统一是造成研究结果不一致的原因之一。我国以TSH>4.2 mIU/L为SCH的诊断切点,而美国国家临床生物化学研究院发布的实验室指南显示,95%以上的正常人TSH水平低于2.5 mIU/L,而TSH超过2.5 mIU/L的这类人群,大多数可能是桥本甲状腺炎或其他具有临床意义的原因所致[8]。因此,有学者提出应该将TSH参考范围的上限定义为<2.5 mIU/L[9]。Qi等[10]研究发现,TSH 2.5~4.2 mIU/L可增加DKD的患病风险。但韩国学者Kim等[11]研究表明,SCH与重度糖尿病视网膜病变(DR)独立相关,而与DKD无关。TSH正常上限值是否应该下调?本研究将TSH正常值组以2.5 mIU/L为切点,进一步分组比较,研究结果显示,与TSH正常低值组相比,TSH正常高值组各指标差异均无统计学意义。随着TSH水平的升高,DKD的患病率逐渐升高,SCH增加DKD的发病风险,调整年龄、性别、病程、体重指数、HbA1c、甘油三酯、总胆固醇、高血压后,其风险仍然增加(OR=2.187,95%CI:1.244~3.847),但TSH在正常高值时(2.5~4.2 mIU/L)与DKD患病风险增加无关。研究结果与Zou等[12]的一致。
Yasuda等[13]研究发现,与甲状腺功能正常者相比,SCH患者UACR水平升高,TSH是T2DM患者白蛋白尿的独立危险因素。SCH与DKD相关的机制可能为:SCH引起心排血量减少及肾内血管收缩,导致肾血流量减少、GFR下降[14]。SCH引起血脂代谢紊乱、凝血及纤溶系统异常,加速动脉粥样硬化,累及肾血管,最终导致肾缺血、DKD进展[15]。SCH时可导致内皮型一氧化氮合酶活性下降,引起血浆一氧化氮含量下降而出现内皮功能障碍[16]。系统性内皮功能紊乱是DKD的致病机制之一。SCH患者体内氧化-抗氧化系统失衡,氧化应激产物堆积,通过激活蛋白激酶C、多元醇代谢通路及晚期糖基化终末产物的形成,促进DKD的发生与进展[17]。另外,SCH患者伴有慢性低度炎性反应,血清肿瘤坏死因子-α、白细胞介素-6、C反应蛋白水平升高。慢性低度炎性反应使内皮通透性增加,血管舒缩功能异常,同时可以促进系膜细胞增生及细胞外基质产生异常、诱导细胞凋亡和坏死,在DKD发病和发展发挥作用[18-19]。SCH常伴有胰岛素抵抗,而胰岛素抵抗可以增加肾毛细血管的静水压和通透性,从而在早期DKD的发病机制中起作用[20-21]。研究显示,甲状腺自身抗体特别是TPOAb的滴度与SCH的发生及进展相关[22-23]。本研究中SCH组TPOAb的阳性率明显高于TSH正常值组(23.0%比5.7%)。肾脏和甲状腺自身免疫来源相关,甲状腺自身抗体、甲状腺球蛋白及其相关的免疫复合物可沉积在肾小球基底膜,从而引起肾脏的损伤[24]。肾小球基底膜最初的改变,可能对邻近的足细胞、内皮细胞、系膜细胞产生了功能上的重要影响,从而影响肾小球滤过[25]。
当然,本研究也存在一些缺陷。首先,本研究是一个单中心、横断面研究,存在一定的选择偏移,且无法证明SCH与DKD之间的因果关系。其次,仅用1次甲状腺功能测定的结果定义SCH,无法排除SCH的短暂升高,说明SCH与DKD关系的复杂性。总之,T2DM患者SCH与DKD、肾功能损伤密切相关。
