V型咔唑衍生物的合成和光电性能
2019-07-19丁文娟张晓波宋冬冬梁作芹
桑 翔,吕 顺,丁文娟,张晓波,宋冬冬,梁作芹
(苏州科技大学 化学生物与材料工程学院,江苏 苏州215009)
电致发光是一种直接将电能转换成光能的现象。有机电致发光材料按化合物的分子结构不同可以分为:有机小分子化合物和高分子聚合物。有机小分子发光材料由于其具有化学修饰性强、选择范围广、易于提纯、荧光量子产率高,以及可以产生红、绿、蓝等各种颜色的光等优良特性而倍受人们的关注[1-3]。有机电致发光器件典型的三层式结构分为:阴极、电子传输层、发光层、空穴传输层和作为阳极的氧化铟-氧化锡(ITO)及玻璃衬底。空穴传输材料都有强的给电子能力,在电子的不间断地给出过程中表现出空穴的迁移特性。Yokoyama[4]从多年的实际经验出发,提出关于空穴传输分子设计的几个观点:(1)在一个分子内,空穴的最小构造单位要尽可能的多,以增加相邻分子间的接触机会,即所谓多感应性;(2)空穴的最小构造单位在分子内形成共轭结构,使电子的移动距离较大,即所谓分子内移动性;(3)相邻分子间不要形成构造陷阱。
咔唑由于其特殊的刚性结构很容易在分子的3、6、9位进行功能修饰。它在紫外光范围有很强的吸收并且带隙在3.20 eV左右,发出蓝光等特性,其衍生物是很好的光电功能材料[5-8]。由于其电子流动性强,热稳定性高和良好的发光性质,咔唑衍生物既可以用作空穴传输层,又可以作为发光层。
目前,有机空穴传输材料的研究重点在于提高材料的空穴迁移率[9-11]及热稳定性[12-13]。本文在此思想指导下,同时考虑将器件中的空穴传输层与发光层集于一身从而简化器件结构的想法,以价格便宜的咔唑为原料,设计并合成了含有炔键的V型咔唑衍生物,利用1H NMR、13C NMR对其的结构进行了表征。为了了解目标化合物的性能,从光致发光,电化学性质和热稳定性方面对其进行了初步研究。
1 实验部分
1.1 仪器与试剂
合成实验和测试实验中所用到的药品均为市售分析纯,所有的溶剂使用前均按常规方法纯化。化合物的1H NMR和13C NMR用BrukerAvance300/400 MHz核磁共振仪测定。紫外-可见吸收光谱在TU-1800 PC光谱仪上测得;单光子荧光光谱在Hitachi F-4500型荧光光谱仪上测定;电化学循环伏安曲线在LK2005型电化学工作站(天津兰力科公司)上测定。电化学方法测试条件:以EG & G铂盘电极为工作电极,Ag/AgCl电极为参比电极,Pt丝电极为辅助电极,高氯酸四丁基铵为支持电解质(浓度为0.1 mol/L)。扫描电压范围:-1.0~+2.0 V,扫描速度是50 mV/s。测试用溶剂为精制DMF,测试溶液浓度为1 mmol/L。
1.2 化合物的合成路线
化合物CEF的合成路线如图1所示。

图1 化合物CEF合成路线图
1.3 实验步骤
化合物2-碘芴(1):在250 mL圆底烧瓶中,加入冰醋酸81.3 mL,水16.3 mL,浓硫酸2.4 mL(冰醋酸∶水∶浓硫酸=100∶20∶3,V/V/V),和芴(10.0 g,60.2 mmol),升温至沸腾,回流0.5 h。芴溶解后溶液呈红褐色,澄清透明。 冷却至60~65℃,溶液变浑浊,加入HIO3(1.76 g,10.0 mmol)和碘(5.10 g,20.0 mmol),溶液变成紫红色,逐渐变浅,有大量沉淀生成,继续反应4 h。反应停止后,冷却至室温,将固体抽滤出来,用2 M的Na2CO3水溶液和蒸馏水洗三遍,产物经真空干燥,正己烷重结晶,得灰白色固体3.99 g,产率60.0%。
1H NMR(300 MHz,CDCl3,ppm)δ:3.81(d,J=15.9 Hz,2H),7.31(m,2H),7.44(m,2H),7.66(d,J=7.2 Hz,1H),7.73(d,J=7.2 Hz,1H),7.85(s,1H).
13C NMR(75 MHz,CDCl3,ppm)δ :36.6,92.5,120.2,121.7,122.3,127.1,127.8,132.2,135.9,138.0,138.6,153.2,154.9.
化合物2-(2-甲基-3-丁炔-2-醇)-芴(2):在100 mL三颈瓶中,加入化合物2-碘芴(0.90 g,3.1 mmol),新蒸三乙胺15 mL,新蒸THF 2 mL,通氮气20 min后向反应瓶中加入催化剂量的CuI,Pd(PPh3)2Cl2,PPh3,用注射器注入2-甲基-3-丁炔-2-醇(0.42 g,5.00 mmol),室温下搅拌15 h后停止反应,减压蒸出大部分溶剂后加入乙醚滤去黑色不溶物,浓缩,柱层析(SiO2,展开剂:石油醚/乙酸乙酯5∶1(V/V))得红色油状物0.64 g,产率84.0%。
1H NMR(CDCl3,400 MHz,ppm)δ:1.64(s,6H),3.88(s,2H),7.30~7.34(m,1H),7.39(t,J=7.36 Hz,1H),7.45(d,J=7.96 Hz,1H),7.55(d,J=7.40 Hz,1H),7.61(s,1H),7.72(d,J=7.88 Hz,1H),7.77(d,J=7.52 Hz,1H).
13C NMR(CDCl3,100 MHz,ppm)δ:31.54,36.71,65.71,82.81,93.66,119.69,120.18,120.72,125.09,126.91,127.16,128.25,130.51,141.06,141.86,143.11,143.52.
化合物2-乙炔-芴(3):在100 mL圆底烧瓶中,加入化合物2-(2-甲基-3-丁炔-2-醇)-芴(0.44 g,1.78 mmol),NaOH(0.16 g,3.92 mmol)和二氧六环15 mL,升温至120℃,搅拌4 h后,停止反应。 蒸出二氧六环,加入CH2Cl2溶解,用水洗涤,分出有机相,用无水MgSO4干燥,过滤,浓缩,柱层析(SiO2,展开剂:石油醚)得无色晶体0.24 g,产率70.6%。
1H NMR(CDCl3,400 MHz,ppm)δ:3.11(s,1H),3.89(s,2H),7.31~7.34(m,1H),7.38(t,J=7.20 Hz,1H),7.53(q,J=10.88 Hz,2H),7.67(s,1H),7.72(d,J=7.88 Hz,1H),7.77(d,J=7.48 Hz,1H).
13C NMR(CDCl3,100 MHz,ppm)δ:29.71,36.71,84.38,119.73,120.06,120.27,125.11,126.94,127.29,128.71,131.02,140.95,142.38,143.11,143.58.
化合物3,6-二(2-乙炔-芴基)-9-丁基-咔唑(CEF):在100 mL三颈瓶中加入9-丁基-3,6-二碘-咔唑(0.11 g,0.24 mmol),新蒸三乙胺5 mL,新蒸THF 5 mL,通氮气20 min后向反应瓶中加入催化剂量的CuI,Pd(PPh3)2Cl2,PPh3,20 min后向反应体系中快速加入2-乙炔-芴(0.10 g,0.53 mmol),室温下搅拌12 h后停止反应,蒸出大部分溶剂后加入二氯甲烷滤去黑色不溶物,浓缩,柱层析(SiO2,展开剂:石油醚/二氯甲烷6∶1(V/V))得淡黄色固体58 mg,产率40.4%。
1H NMR(CDCl3,400 MHz,ppm)δ:0.98(t,J=7.27,3H),1.40~1.56(m,2H),1.86~1.90(m,2H),3.95(s,4H),4.33(t,J=6.97 Hz,2H),7.33(t,J=7.24 Hz,2H),7.40(d,J=10.0 Hz,4H),7.58(d,J=5.0 Hz,2H),7.62(d,J=10.0 Hz,2H),7.68(d,J=10.0 Hz,2H),7.78~7.81(m,6H),8.31(s,2H).
13C NMR(CDCl3,100 MHz,ppm)δ:13.86,20.54,29.71,31.11,36.79,43.16,109.02,114.10,119.81,120.13,121.90,122.57,124.11,125.10,126.91,127.04,128.04,129.71,130.39,140.42,141.25,141.50,143.23,143.57.
2 结果与讨论
2.1 光物理性质
化合物CEF在不同极性溶剂中的紫外-可见吸收和荧光谱图如图2所示,测试浓度为1×10-6mol/L。CEF在不同极性溶剂中的紫外-可见吸收谱图表现出三个吸收峰。在甲苯溶液中,CEF的三个吸收峰分别位于324、344和362 nm。随着溶剂极性的增加,吸收峰的峰位几乎不受影响。CEF不同极性溶剂中的吸收峰位如表1所列。CEF的荧光光谱如图2(b)和表1所列。在甲苯、二氯甲烷、四氢呋喃和甲醇中,CEF出现精细的双峰结构。在乙腈和DMF溶液中,双峰结构消失,宽化为一个荧光峰。随着溶剂极性的增加,荧光光谱的变化现象与分子内扭转电荷转移模型类似,但是CEF化合物中咔唑基和芴基之间通过炔键连接,取代基团不能任意旋转,因此,荧光光谱的变化现象不是分子内扭转电荷引起的[14]。以硫酸奎宁(Φ=0.577,激发波长:350 nm)作为参比,CEF在不同极性溶剂中的荧光量子产率如表1所列。其中,在DMF溶液中CEF表现出最高的荧光量子产率(80.5%)。随着溶剂极性的增加,分子内扭转电荷的速率增加,并且降低荧光量子产率[14]。荧光量子产率计算结果再次表明CEF的双峰结构不是分子内扭转电荷引起的。初步推测CEF双荧光峰是由于不同的分子内电荷传输方式引起的。
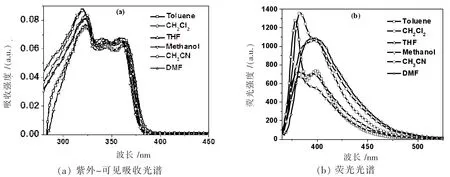
图2 化合物CEF在不同极性溶剂中的紫外-可见吸收和荧光光谱(测试浓度1×10-6 mol/L)

表1 CEF在不同极性溶剂中的光物理性质
2.2 电化学性质
为了考察CEF的最高占据分子轨道(HOMO)和最低未占据分子轨道(LUMO)的能级水平,我们采用室温下循环伏安法来测试了它的电化学行为。化合物CEF表现出一个氧化峰和一个还原峰分别位于0.975和-0.34 V。化合物的HOMO轨道能级数值由公式HOMO=-(Eoxonset+0.22 V)-4.50 eV(0.22 V为Ag/AgCl电极相对于标准氢电极的电势,-4.50 eV为标准氢电极相对于真空能级的电势,Eoxonset=0.798 V)计算得到,为-5.52 eV。根据HOMO—LUMO=-Eg(Eg=3.16 eV),计算得到CEF的LUMO能级为-2.36 eV。CEF的HOMO能级与电致发光器件常用的空穴传输材料4,4'-双[N-(1-萘基)-N-苯氨基]联苯(-5.70 eV)相当[15],因此,表明CEF有望作为有机电致发光器件的空穴传输材料。
2.3 热稳定性
有机化合物的热学性质对光电器件的寿命起着重要的作用。在此,CEF的热学性质通过热重分析实验测得。热重分析(见图4)结果显示化合物CEF的热分解温度为484℃,说明该化合物具有良好的热稳定性,适合用真空蒸镀的方法来制作有机电子器件。

图3 DMF溶液中化合物CEF的循环伏安曲线

图4 CEF热重分析曲线
3 结语
通过Sonogashira反应合成了含炔键的V型咔唑衍生物CEF,利用1HNMR和13C NMR对中间产物和目标分子进行了结构表征。研究了CEF在不同极性溶剂中的光物理性质、热稳定性和电化学性质。CEF在DMF溶液中荧光量子产率为80.5%,热分解温度为484℃,HOMO能级为-5.52 eV,具有良好的发光和空穴传输能力,在有机电致发光器件领域具有潜在的应用价值。
