苦豆子内生真菌诱导子促进宿主生物碱合成积累的生理防卫反应
2019-07-18孙牧笛胡丽杰李文学闫思远顾沛雯
孙牧笛,胡丽杰,李文学,闫思远,张 众,顾沛雯
(1.宁夏大学农学院,宁夏 银川 750021;2.宁夏大学葡萄酒学院,宁夏 银川 750021)
关键字:苦豆子;内生真菌诱导子;氧化苦参碱; 防御酶活性;组培苗
植物内生真菌是生长于植物体内,与宿主植物互利共生的一类微生物,内生真菌诱导子作为一种特殊的外源诱导子,可以通过信号传导途径,诱发植物自身的防御反应,调节次生代谢途径中某些关键酶活性,从而高效、快速、专一地调控某些次生代谢物的合成[1-3]。将真菌诱导子作用于植物培养物,通过激活植物防御而促进次生代谢物的合成是目前提高植物次生代谢物产率最有效的技术手段之一[4]。
植物次生代谢产物的合成与积累是植物应对外界胁迫所产生的防御反应的一个分支,因此植物的防御反应与植物次生代谢产物的合成关系密切[5]。防御酶活力的提高在一定程度上代表着植物细胞次级代谢的增强,酶活性的提高有利于植物中次生代谢产物的合成和积累[6]。李培琴等[7]利用盾叶薯蓣内生真菌Berkleasmiumsp. Dzf 12寡糖诱导子,明显促进了盾叶薯蓣培养物中苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)和多酚氧化酶(PPO)的活性升高。王梦亮等[8]通过向红景天组培苗中添加内生真菌的提取物,不仅诱发红景天苷合成途径中关键酶PAL、酪氨酸脱羧酶(TAL)和肉桂酸-4-羟化酶(CA4H)活性升高,还促进了红景天苷的合成积累。
苦豆子(SophoraalopecuroidesL.)系豆科(Leguminosae)槐属多年生草本植物,主要分布于我国的西北荒漠地区及中亚细亚一带,是我国干旱荒漠区具有保土固沙作用的重要自然植被,同时也是中医药领域中重要的沙生药用植物资源[9]。喹诺里西啶(Quinolizidine,QAs)类生物碱是其重要的生物活性成分,其中的氧化苦参碱(Oxymatrine,OMA)在保肝、抗炎抗敏、抗肿瘤及抗心律失常等方面有重要的药理活性,在杀虫抗菌等方面也有着重要的作用[10]。近年来,由于人们对苦豆子OMA等原料药的需求量逐渐增加,野生苦豆子资源乱采滥掘日益猖獗,苦豆子野生自然资源面临着逐渐枯竭的危险。本课题组在前期实验中从宁夏野生苦豆子中筛选获得了可产生QAs生物碱的内生真菌[11],并以苦豆子内生真菌产碱菌株、优势菌株和高活性抑菌菌株的灭活菌丝和菌液浓缩物为诱导子,发现菌液浓缩物能明显提高宿主培养物中QAs生物碱的合成积累[12],本研究在此基础上,以苦豆子组培苗为对象,以4株高活性苦豆子内生真菌的菌液浓缩物为诱导子,分析其对苦豆子组培苗中OMA合成和防御酶活性的影响,探究内生真菌促进生物碱合成积累的生理防卫反应机制。
1 材料与方法
1.1 材 料
植物材料:苦豆子豆荚采自宁夏白芨滩自然保护区,经宁夏大学农学院李小伟副教授鉴别证明为SophoraalopecuroidesL.。
苦豆子内生真菌菌株:本实验室筛选得到4株高活性苦豆子内生真菌(表1),分别为菌株XKZKDF11,菌株XKZKDF27,菌株XKYKDF40和菌株NDZKDF13。
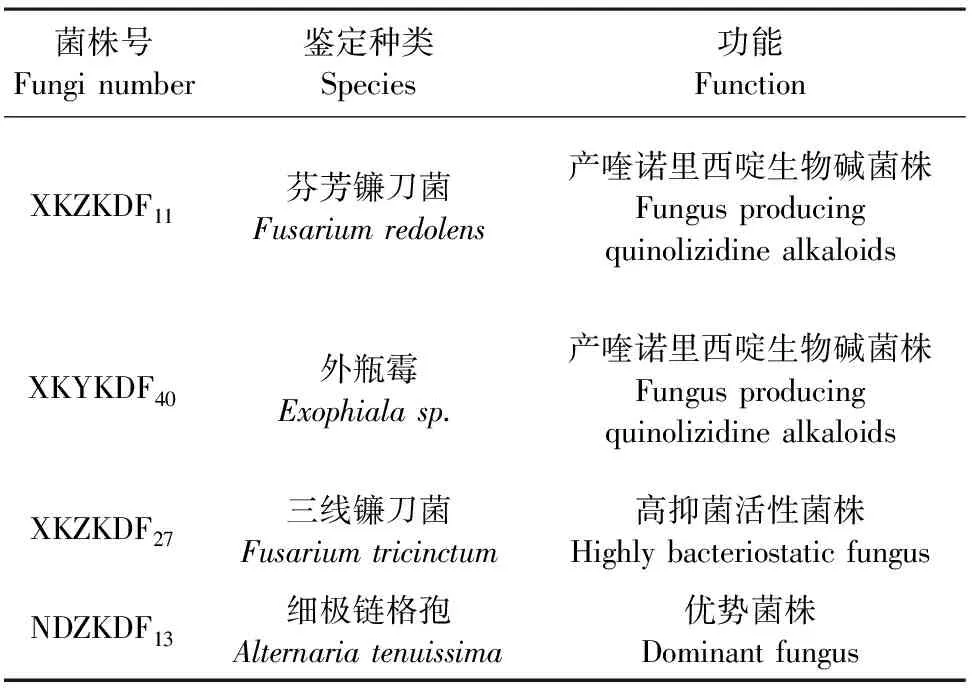
表1 供试苦豆子内生真菌菌株
主要试剂:氧化苦参碱OMA标准品(批号:B21470)购自上海源叶生物技术有限公司,苯丙氨酸解氨酶(PAL)试剂盒、抗坏血酸过氧化物酶(APX)试剂盒、过氧化氢酶(CAT)试剂盒、过氧化物酶(POD)试剂盒、BCA法微量蛋白检测试剂盒,以上试剂盒皆购自南京建成生物工程研究所。
1.2 方 法
1.2.1 苦豆子组培苗的培养 按高媛等[12]的方法培养苦豆子组培苗。饱满健康的种子经过80%浓硫酸(V/V)软化种皮和5%次氯酸钠(V/V)消毒处理后,暗培养24 h,每天连续光照12 h,培育5 d后用5%次氯酸钠(V/V)再次对幼苗消毒,接种于MS培养基上。培养条件为:25℃,每天连续光照12 h,光强为1 000 lx,组培苗每25 d继代1次。
1.2.2 内生真菌诱导子的制备与添加 真菌诱导子的制备参照Farmer[13]的方法,将内生真菌菌株接种于马铃薯葡萄糖液体培养基中,25℃,150 r·min-1恒温摇床中暗培养7 d,对获取的菌株发酵液进行抽滤,分离得到菌液后,经过减压浓缩,获得菌液浓缩物。真菌诱导子的浓度以多糖浓度为标准,向组培苗的MS培养基中添加一定量的菌液浓缩物,使培养基中多糖浓度为1.00 mg·L-1,高压灭菌后备用。以不加诱导子组培苗为对照,25℃培养,各处理组每天连续光照12 h,光强为1 000 lx,包括添加诱导子当天在内每3 d取1次样本,共取样6次,液氮速冻后,-80℃保存。
1.2.3 苦豆子组培苗中OMA含量测定
(1)苦豆子组培苗中OMA的提取。称取0.5 g苦豆子组培苗子叶,加入2 mL无水乙醇充分研磨,常温水浴超声处理30 min,置于4℃冰箱过夜浸提,于25℃ 8 000 g离心10 min,取上清液于新离心管中,氮吹后,用流动相定容至1.5 mL,0.45 μm滤膜过滤后,即为样品制备液,于4℃冰箱中保存,待测。
(2)色谱柱条件。色谱柱:Kromasil C18反相色谱柱(250 mm×4.6 mm,5 μm);流动相:0.037 mol·L-1磷酸缓冲液(H3PO4=3.65 g·L-1)-甲醇(90∶10,V/V);紫外检测波长:216 nm;柱温:30℃;流速:1.0 mL·min-1(见图1)。
(3)OMA标准曲线的建立。精确称量OMA标准品2.0 mg,用流动相溶解定容至1 mL,配制浓度为2 mg·mL-1的标准贮备液。精密吸取标准贮备液,梯度稀释成质量浓度为2 000、1 000、500、200、100 mg·mL-1和50 mg·mL-1的标准品溶液。按上述的色谱条件,吸取标准品溶液进样,每次进样10 μL,以质量浓度为横坐标(x),以峰面积为纵坐标(y)进行线性回归,绘制标准曲线,其回归方程为:y=794.9x+11713.2,R2=0.9990,表明氧化苦参碱浓度在0.002~2.000 mg·mL-1范围内,峰面积线性关系良好。
(4)OMA含量测定。精密量取待测样品制备液10 μL进样,在相同色谱条件下检测,根据标准曲线计算待测样品OMA含量,其单位为mg·g-1。
1.2.4 苦豆子组培苗中防御酶的活性测定 以不加诱导子的组培苗为对照组,4种内生真菌诱导子处理的苦豆子组培苗为处理组,分别测定不同处理组不同诱导天数的组培苗中PAL、POD、APX、CAT活性,每个处理重复3次。
(1)PAL活性测定。按照PAL测定试剂盒说明书进行操作。参照宛伟国等[14]的方法,按样本鲜重计算,以每克组织在每mL反应体系中每分钟使290 nm吸光度变化0.1为一个酶活力单位。
(2)POD活性测定。按POD检测试剂盒说明书进行操作。参照魏池泉[15]的方法,按照样本蛋白浓度计算:以每毫克组织蛋白每分钟催化1 μg底物的酶量为一个酶活力单位。样本可溶性蛋白含量按照BCA法微量蛋白检测试剂盒说明书进行测定。
(3)抗坏血酸过氧化物酶(APX)活性的测定。按APX检测试剂盒说明书进行操作。参照孙云[16]的方法,按照样本蛋白浓度计算:以每毫克组织蛋白每分钟氧化1 μmol抗坏血酸(AsA)的酶量作为一个酶活性单位。样本可溶性蛋白含量按照BCA法微量蛋白检测试剂盒说明书进行测定。
(4)过氧化氢酶(CAT)活性测定。按CAT检测试剂盒说明书进行操作。参照朱小文[17]的提取方法,以每毫克组织蛋白每秒钟分解1 μmol H2O2的量为一个活力单位。样本可溶性蛋白含量按照BCA法微量蛋白检测试剂盒说明书进行测定。
2 结果与分析
2.1 不同内生真菌诱导子对苦豆子组培苗OMA含量的影响
由图2可知,4种内生真菌诱导子在不同程度上均能提高苦豆子组培苗中OMA的含量,其中产碱菌株XKYKDF40的诱导效果最好,苦豆子组培苗中OMA含量增加较为明显,在诱导第15 d达到最高,为3.616 mg·g-1,是对照组第15 d的2.09倍。内生真菌诱导子XKZKDF11与诱导子XKYKDF40的诱导趋势相似,在0~15 d诱导期间OMA含量持续增长,且始终高于对照,并在第15 d达到最高,是对照组第15 d的1.58倍。诱导子XKZKDF27、NDZKDF13在诱导第3~9 d,组培苗中OMA含量保持增长,在第9 d时OMA含量达到最高,分别为对照组第9 d的1.27和1.95倍,此后随着培养时间的延长,OMA含量逐渐下降,至诱导结束NDZKDF13仍高于对照组。
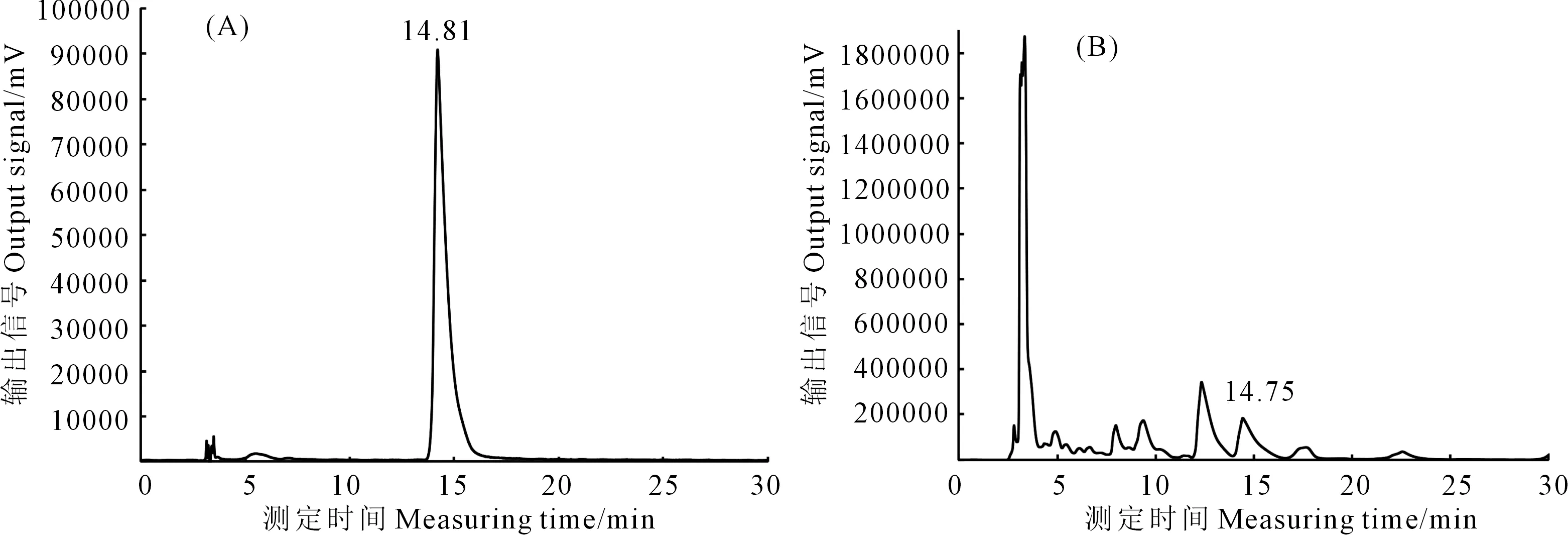
图1 氧化苦参碱标准品(A)和苦豆子组培苗中氧化苦参碱(B)的HPLC检测色谱图Fig.1 HPLC chromatograms of OMA standard (A) and OMA of S. alopecuroides L. tissue culture (B)
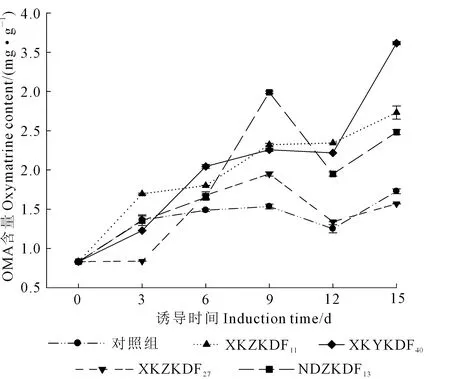
图2 苦豆子内生真菌诱导子在不同诱导时间下对宿主OMA含量的影响Fig.2 Effects of endophytic fungal elicitors from S. alopecuroides L.on host OMA at different induction time
2.2 内生真菌诱导子对宿主防御酶活性的影响
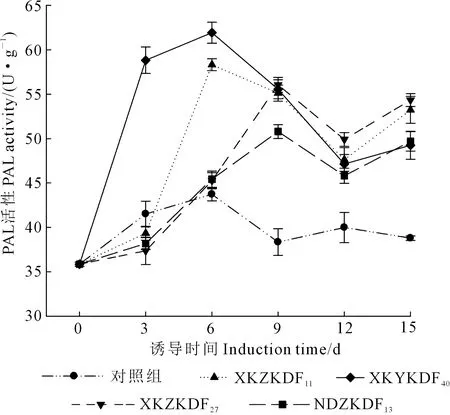
图3 内生真菌诱导子对苦豆子组培苗PAL活性的影响Fig.3 Effects of endotrophic fungal elicitors on activityof PAL in aseptic seedlings of S. alopecuroides L.
2.2.1 内生真菌诱导子对宿主PAL活性的影响 以不同内生真菌诱导子处理的苦豆子组培苗为材料,测定不同诱导时间下PAL的活性。如图3,在4种内生真菌诱导子处理初期,苦豆子组培苗中PAL的活性均持续升高,随着诱导时间的延长,PAL活性逐渐呈现下降趋势,但均高于对照组。其中,诱导子XKYKDF40和XKZKDF11激发PAL活性的作用最好,在诱导处理0~6 d内迅速诱发宿主PAL活性,诱导第6 d达最大值,分别为61.92 U·g-1和58.32 U·g-1,是对照组第6 d的1.42和1.33倍。其次,内生真菌诱导子XKZKDF27和NDZKDF13则是在诱导的3~9 d内诱发宿主PAL活性,诱导第9 d达到峰值,分别为56.05 U·g-1和50.80 U·g-1,是对照组第9 d的1.46倍和1.32倍。
2.2.2 内生真菌诱导子对宿主POD活性的影响 如图4所示,4种内生真菌诱导子加入后,宿主中POD活性均高于对照组,其中内生真菌诱导子XKZKDF27诱导效果最显著,POD活性始终保持增长,在第12 d达到最大值,为62.30 U·mg-1,是对照组第12 d的2.70倍。诱导子XKZKDF11诱导宿主中POD活性的变化规律与诱导子XKZKDF27相似,在诱导处理前期POD活性保持增长,第12 d达到最大值,为49.13 U·mg-1,是对照组第12 d的2.13倍。诱导子NDZKDF13和XKYKDF40对宿主POD活性的影响存在小的波动,在第3 d出现第一个小高峰,在诱导第9 d时,诱导子NDZKDF13诱发宿主中POD的活性达到峰值,为49.79 U·mg-1,是对照组第9 d的2.46倍。而诱导子XKYKDF40处理组在第12 d时POD活性达到最高,为42.46 U·mg-1,是对照组第12 d的1.84倍。
2.2.3 内生真菌诱导子对宿主APX活性的影响 如图5所示,4种内生真菌诱导子在诱导处理前期苦豆子组培苗中APX的活性虽高于对照组,但增长缓慢,而在诱导处理中后期宿主APX活性均大幅升高。其中诱导子XKZKDF11的诱导效果最为明显,在诱导9~12 d时APX活性激增,在第12 d达到峰值,为0.5538 U·mg-1,是各自同时期对照组的4.97倍;其次,诱导子XKYKDF40和XKZKDF27在诱导处理第9 d后,APX活性开始迅速升高,分别于第12 d和15 d达到最高,为0.3948和0.4991 U·mg-1,是同时期对照组的3.54和3.31倍;诱导子NDZKDF13则在诱导6~9 d内APX活性激增,在诱导第9 d达到最高,为0.2728 U·mg-1,是同时期对照组的1.34倍。
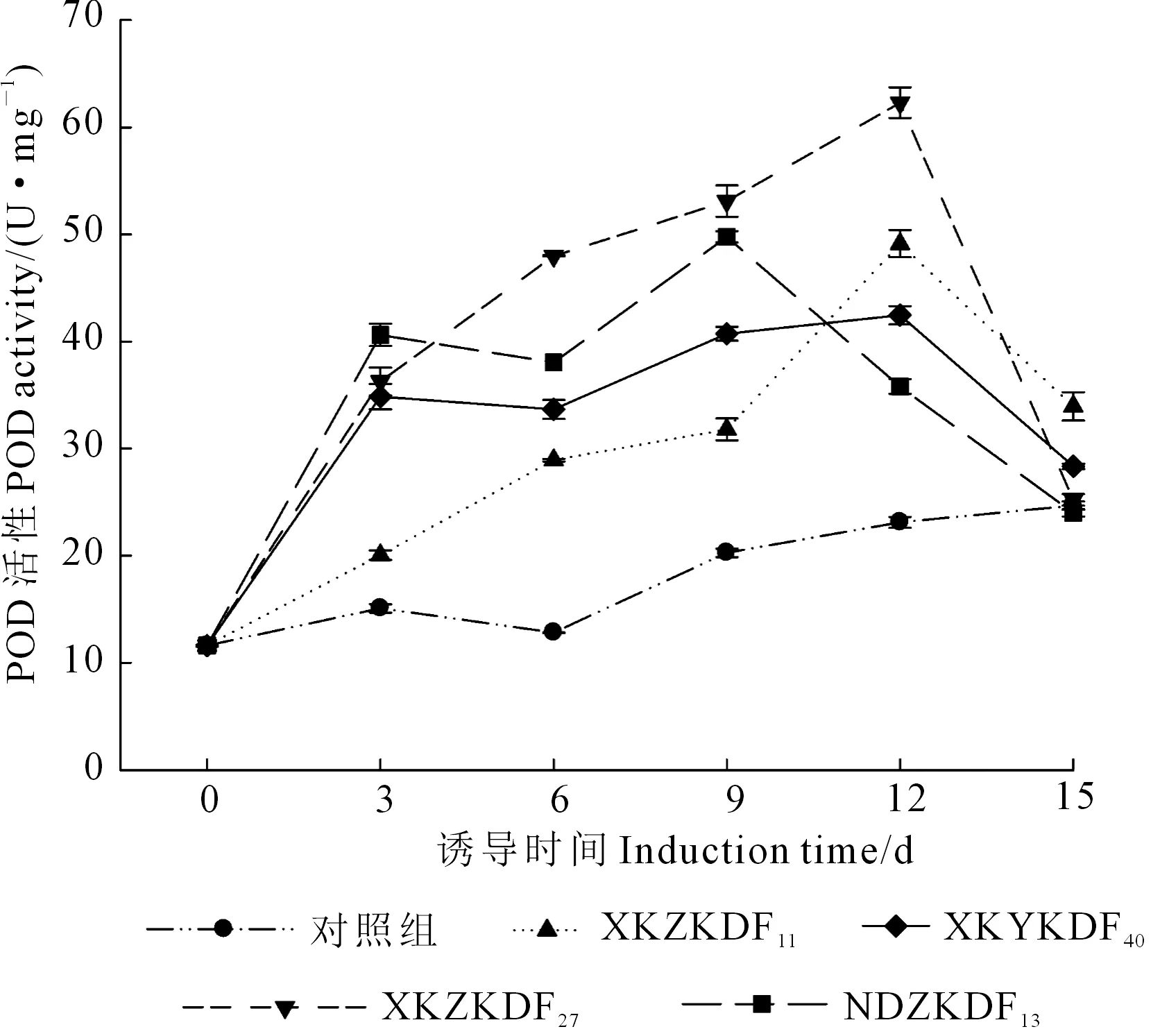
图4 内生真菌诱导子对苦豆子组培苗POD活性的影响Fig.4 Effects of endotrophic fungal elicitors on activity ofPOD in aseptic seedlings of S. alopecuroides L.
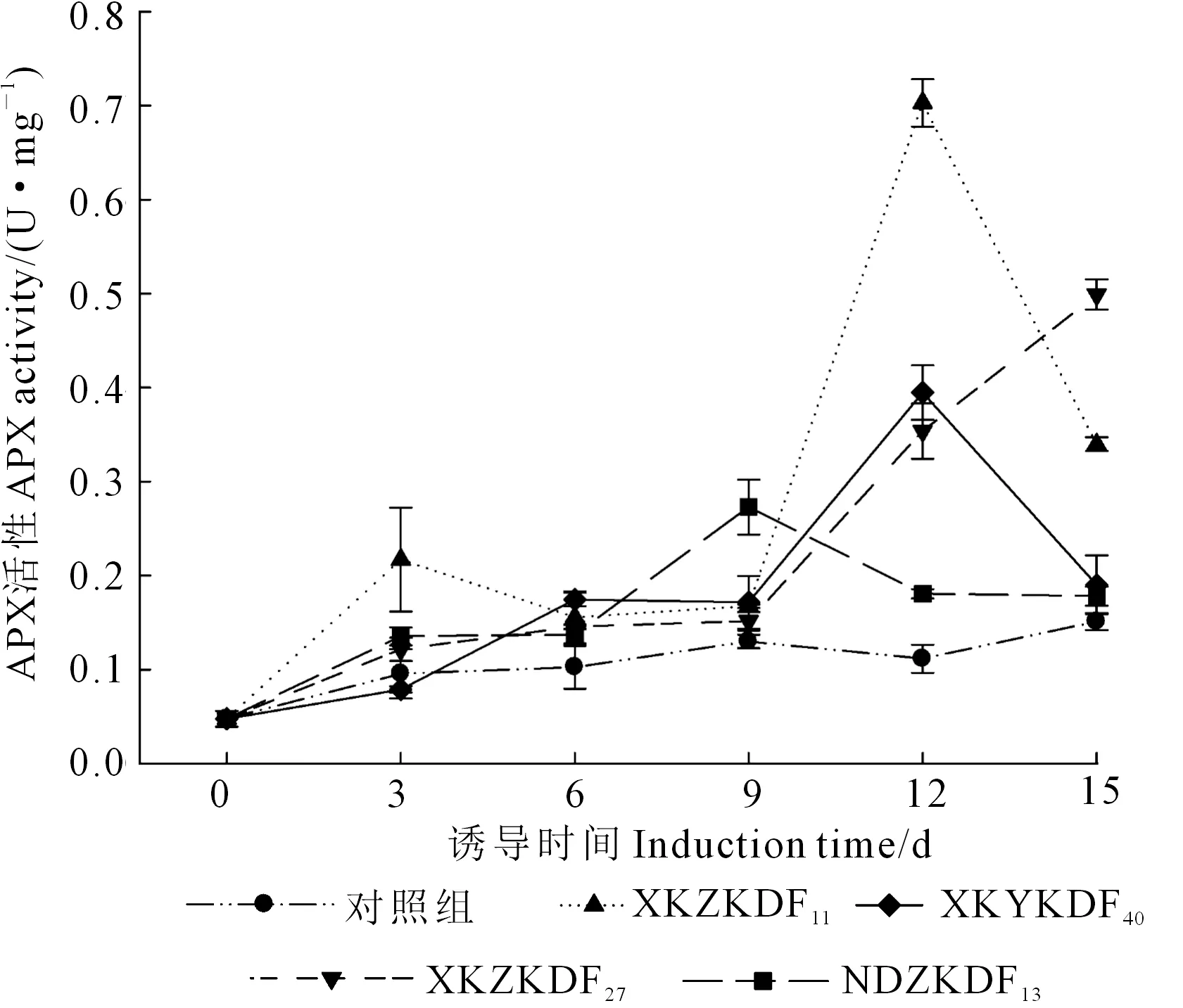
图5 内生真菌诱导子对苦豆子组培苗APX活性的影响Fig.5 Effects of endotrophic fungal elicitors on activity ofAPX in aseptic seedlings of S. alopecuroides L.
2.2.4 内生真菌诱导子对宿主CAT活性的影响 由图6可知,除诱导子NDZKDF13外,其他3种诱导子在诱导处理前期CAT活性皆呈现相对缓慢的增长趋势,在诱导中后期CAT活性快速升高,之后随着诱导时间的延长,CAT活性逐步减弱。诱导子XKZKDF11和XKYKDF40在处理0~9 d内CAT活性增长缓慢,在9~12 d内CAT活性迅速增加,第12 d达到最高,CAT活性分别为19.82、16.87 U·mg-1,是同时期对照组的3.00倍和2.56倍;诱导子XKZKDF27在6~15 d内CAT活性快速增长,于第15 d达到最高为10.30 U·mg-1,是同时期对照组的1.47倍;NDZKDF13诱导子在诱导3~9 d内CAT活性持续增长,于第9 d达到最高,CAT活性为14.97 U·mg-1,是同时期对照组的2.47倍。
3 讨 论
内生真菌诱导子现已广泛用于提高植物次生代谢产物的合成积累,人们选择性地利用真菌诱导子促进某种植物中次生代谢物质的合成和累积[18]。陶如等[19]通过向白花丹参毛状根中添加内生真菌诱导子,使丹酚酸B和丹参素的产量分别增加1.55倍和2.68倍。本试验以内生真菌菌液浓缩物为诱导子,研究其对宿主OMA含量的影响,发现4种内生真菌诱导子在不同程度上均能提高苦豆子组培苗氧化苦参碱OMA含量,其中产碱菌株XKYKDF40的诱导效果最好,但其余3种诱导子对宿主中OMA含量的诱导效果并不持续增加,而是在OMA的合成积累量达到某一临界值后开始下降,其原因可能是:一方面,内生真菌诱导子对苦豆子合成OMA的作用受内生真菌种类、诱导子时间和浓度等许多因素的影响。不同类型的内生真菌诱导子所具备的被宿主细胞受体识别的信息类型及时间先后不同,诱导反应的途径、速度和强度也不相同,故不同内生真菌诱导子表现出的诱导活性有明显的差异[20]。以同浓度的炭角菌(Xylariasp.)、黑孢霉菌(Nigrosporasp.)和链抱菌(Alternariasp.)诱导子分别处理毛葡萄愈伤组织,虽3种真菌诱导子对毛葡萄愈伤组织黄酮含量的积累都有一定程度的促进作用,但炭角菌(Xylariasp.)的诱导效果最好,经其处理的愈伤组织中黄酮含量比对照提高了76%[21]。另一方面,植物次生代谢物的合成积累不是无限制的,过多的次生代谢物积累会使植物细胞受到毒害[22]。植物细胞自身通过调控代谢途径中关键酶的活性来限制次生代谢物的产量,以维持内生真菌与宿主植物之间的拮抗平衡[23]。
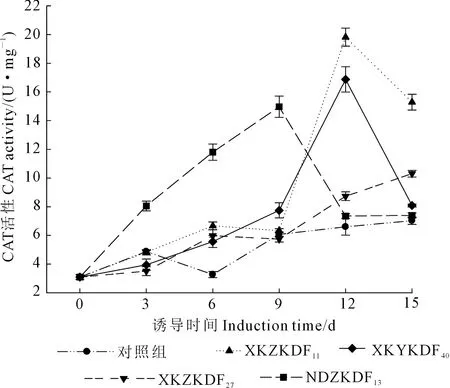
图6 内生真菌诱导子对苦豆子组培苗CAT活性的影响Fig.6 Effects of endotrophic fungal elicitors on activity ofCAT in aseptic seedlings of S. alopecuroides L.
PAL是苯丙烷类代谢途径中的第一个关键酶,也是植物防御反应中重要的标志性酶,参与调控黄酮类、生物碱类及萜类等次生代谢物的合成,同时,PAL还参与了木质素、植保素和植物信号分子水杨酸的合成及多种与植物防御反应相关代谢物的合成[24]。本试验中4种内生真菌诱导子均能有效激活宿主PAL,在诱导早期使宿主PAL活性明显提高,表明诱导子触发了细胞快速应答。诱导处理后期,PAL活性呈现下降趋势,可能是由于参与OMA合成的前体物质已经合成,路径中的后续物质合成需要其他酶来催化。
活性氧中的H2O2是一种常见植物信号分子,是植物对细胞内信号及外界刺激响应的重要调节物,参与介导多种代谢反应,但它也可伤害植物细胞,胞内高浓度的H2O2可引起细胞膜的氧化及过敏反应,从而引起细胞死亡[25-26]。逆境下植物中H2O2浓度会升高,POD、APX及CAT都是清除活性氧的关键酶,POD还可提高植物抗逆性并促进次生代谢产物的合成[27],CAT和APX通过将H2O2还原为O2和H2O,以减轻H2O2对植物的伤害,对维持细胞中活性氧的代谢平衡也起着十分关键的作用[28, 29]。陶金华等[30]用内生真菌Fusarium SP1处理茅苍术悬浮细胞,不仅诱发了PPO、POD、CAT的活性,还提高了β-桉叶醇的含量。本试验中4种内生真菌诱导子诱导宿主组培苗中POD、CAT和APX活性大幅上升,最后促进宿主OMA的合成,由此说明苦豆子内生真菌诱导子可能引起宿主中活性氧的迸发,宿主细胞对诱导子的刺激迅速做出响应,利用抗氧化酶清除过多的H2O2,减轻活性氧对植物的毒害,从而有利于宿主生物碱的合成积累。
总之,苦豆子内生真菌诱导子的加入激发了苦豆子组培苗的防御性应答反应,继而提高了宿主中OMA含量。内生真菌诱导子诱导植物次生代谢物合成是一个复杂的生物学过程,往往受众多内源信号分子调控[31]。苦豆子内生真菌诱导子是否通过激活宿主细胞内某些特殊的信号转导途径,诱发宿主的防御反应并促进生物碱合成,还有待于进一步研究。
