PEG胁迫下不同品系藜麦抗旱性评价
2019-07-18魏小红刘文瑜辛夏青
岳 凯,魏小红,刘文瑜,韩 厅,辛夏青,赵 颖
(1.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃省农业科学院,甘肃 兰州 730070)
藜麦(Chenopodiumquinoa)是一年生藜科草本作物,原产于南美洲安第斯山脉,已有5000多年的栽植历史[1]。中国于1987年由西藏农科院开始引种试验并试种成功[2]。目前,藜麦在甘肃、青海、山西、陕西、浙江都有种植,其面积约4.0~4.5万hm2。因其富含蛋白质、各种氨基酸以及较高维生素、矿物质和植物活性物质[3-5],被誉为“谷物之母”。藜麦具有丰富的营养保健价值及预防多种疾病发生的潜在功效,得到了国内外农业及食品学家的广泛关注。因此,研究藜麦对提高膳食营养水平和调整农业种植结构具有重要的意义。
在我国,干旱、半干旱地区的面积约占国土面积的52.5%[6],干旱胁迫严重影响作物的生长和产量。加快耐旱作物的选育及栽培以提高干旱、半干旱区域土地的利用效率,是我国应对水分缺乏的重要策略之一。藜麦对土壤贫瘠[7]、盐渍[8]、干旱[9]和霜冻[10]等逆境均有较好耐受性,但不同品种之间抗性差异较大。近几年,国内外对藜麦抗性的研究大多集中在耐盐方面,Koyro等[11]发现盐胁迫下藜麦种子的活力、萌发及种子内的元素组成会发生变化,杨发荣等[12]用隶属函数评价了3种藜麦的抗盐性,Schmöckel等[13]利用RNAsep和SNP分析了盐胁迫下藜麦跨膜蛋白的变化,Burrieza等[14]探讨了高浓度盐胁迫下藜麦脱水素的积累等。就干旱方面研究发现:干旱胁迫可诱导藜麦中70s热休克蛋白基因的表达[15],体内脱落酸通过对气孔的调控增强其耐旱性[16],也可增强其抗氧化能力以提高植物的耐旱性[17]。总之,国内外对藜麦抗旱方面的研究甚少,尤其是全面研究藜麦抗性生理及抗旱品种筛选方面还未见报道。为此,本文用不同浓度PEG溶液模拟干旱胁迫,从形态、生理生化指标和光合参数的变化等方面评价藜麦耐旱性,旨在为藜麦的引种及耐旱品种选育提供科学依据。
1 材料与方法
1.1 材料与处理
供试材料为5个藜麦品系:NK1、NK2、NK3、NK4、NK5,引进于甘肃省农业科学院种子公司。试验于2017年5月3日-7月9日进行。选择饱满、大小一致的种子,均匀撒播于已装入压平营养土的柱形花盆(内径20 cm,高15 cm)内,再覆盖上0.5 cm厚的蛭石,轻轻压实,每个处理设3次重复。待藜麦长出4~6片叶子时(35 d左右),用不同浓度的PEG溶液(5%、10%、15%)模拟干旱胁迫,每7 d处理一次,连续处理3次(每次用处理液的1/3)。达到干旱胁迫梯度后,第7天测定生理生化指标,第25天测定形态和光合指标。
1.2 测定项目与方法
1.2.1 形态指标和生物量的测定 达到干旱胁迫梯度后的第1天和第25天分别测定各品系藜麦的株高,二者差值即为株高增量。采用方格纸法[18]测定植株自上向下第6个完全展开叶的叶面积。采用烘干法分别测定植株根、茎、叶的干物质量并计算总生物量、地上生物量、根冠比(根干物质量(g)/地上部干物质量(g))。
1.2.2 生理生化指标的测定 取植株自上而下第5~7片成熟叶片,测定叶片相对含水量(参照李合生方法[19])、质膜透性(参照电导率仪法[19])、丙二醛(MDA)含量(硫代巴比妥酸比色法[19])、脯氨酸(Pro)含量(茚三酮显色法[19])、超氧化物歧化酶(SOD)活性(氮蓝四唑(NBT)还原法[19])、过氧化物酶(POD)活性(愈创木酚氧化法[19])、过氧化氢酶(CAT)活性(紫外分光光度法[19])、抗坏血酸过氧化物酶(APX)活性(参考Nakano[20]方法)等生理指标。
1.2.3 光合指标的测定 取植株自上而下第5~7片成熟叶片,测定叶绿素(Chl)含量(丙酮研磨法)。用CI-310便携式光合仪(美国CID公司)于晴天9∶00-11∶00 测定净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)等参数。
1.3 数据统计分析
采用SPSS 19.0统计软件对数据进行方差分析,差异显著性运用Duncan’s检验法进行多重比较。
采用隶属函数法,对不同品系藜麦的抗旱能力进行综合评价。隶属函数值的计算公式如下:
抗旱系数:
X=Id/Iw
式中,Id为某一指标在干旱胁迫下的测定值,Iw为此指标在正常培养下的测定值[21]。
隶属值:
Xu=(X-Xmin)/(Xmax-Xmin)
(1)
或
Xu=1-(X-Xmin)/(Xmax-Xmin)
i=1,2,3,…
(2)
式中,X为各品种某一指标的抗旱系数,Xmin和Xmax分别为所有品种此指标的最小和最大抗旱系数; 若所用指标与抗旱性呈正相关,用式(1),反之用式(2)。累加各品种各指标的隶属值,并求其平均值,用平均值大小评价品种抗旱性[22]。
2 结果与分析
2.1 干旱胁迫对藜麦生长的影响
由图1(A)可知,15%PEG胁迫各处理株高增量显著(P<0.05,下同)低于相应对照,NK2、NK5、NK3、NK4和NK1分别下降了65.03%、55.97%、53.98%、53.64%、44.38%。
随着干旱胁迫的增强,各品系藜麦的叶面积显著降低(图1(B))。15%PEG胁迫与对照相比,NK3、NK4、NK5、NK1和NK2叶面积分别下降了35.71%、33.71%、27.44%、25.92%、25.39%。
不同干旱胁迫强度下各品系藜麦生物量积累发生明显改变(表1)。随着干旱胁迫的增强,5种品系藜麦总生物量、根生物量和地上生物量均不同程度降低。15%PEG干旱胁迫显著降低了5种藜麦的总生物量,下降幅度依次为NK3>NK4>NK2>NK1>NK5,分别比对照下降了68.28%、63.97%、62.35%、54.21%和48.23%;根生物量下降幅度小于地上生物量,15%PEG胁迫与对照相比,NK3、NK4、NK2、NK1、NK5的根生物量和地上生物量分别下降了53.94%、41.84%、38.79%、30.23%和14.50%,69.95%、66.16%、65.38%、57.53%和52.65%。由表1可知,随着干旱胁迫的增强,5种品系藜麦根冠比均呈上升趋势,15%PEG胁迫与对照相比上升幅度由大到小依次为NK5、NK2、NK4、NK1和NK3,分别上升了80.60%、79.90%、70.32%、68.02%、53.80%。
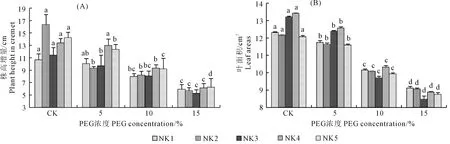
注:不同小写字母表示处理间差异显著,下同。Note: Different lowercase letters indicate significant differencs between treatments, the same below. 图1 PEG处理对5个藜麦品系形态生长的影响Fig.1 Effect of PEG stress on the growth morphology of five quinoa species
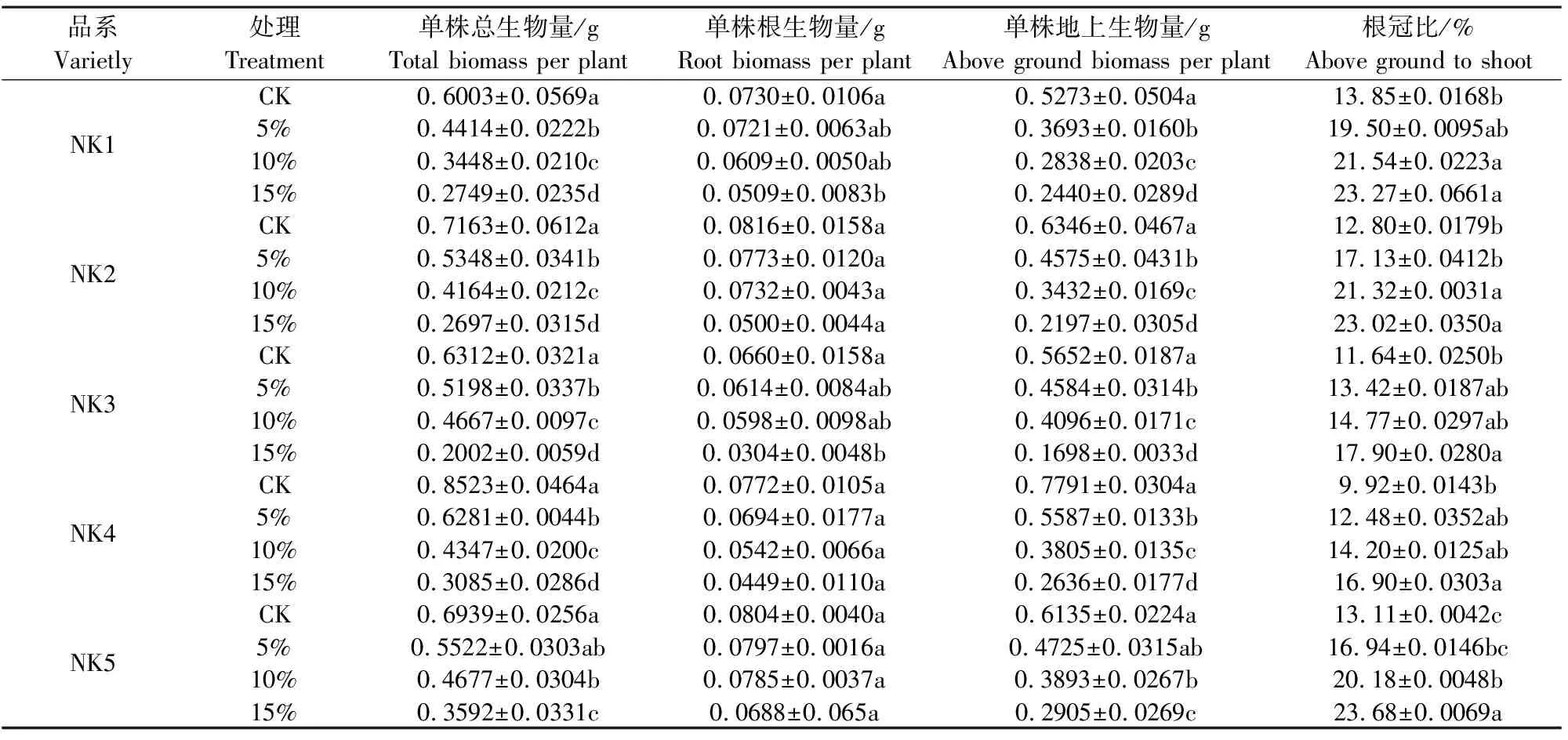
表1 不同强度干旱胁迫对5个藜麦品系叶片生物量的影响
注:不同小写字母表示差异显著(P<0.05),下同。
Note: Different lowercase letters indicate significant differences (P<0.05), the same as below.
2.2 干旱胁迫对藜麦抗逆生理特性的影响
2.2.1 干旱胁迫对藜麦叶片相对含水量的影响 干旱胁迫显著降低了藜麦叶片的相对含水量(图2(A)),且随着干旱强度的增强呈降低趋势。不同品系藜麦叶片相对含水量的降幅由大到小分别为NK3、NK4、NK2、NK1和NK5,15%PEG浓度处理与对照相比分别下降了29.13%、28.88%、27.58%、26.01%、25.76%。NK1、NK2、NK4叶片相对含水量始终介于NK5和NK3之间。
2.2.2 干旱胁迫对藜麦叶片质膜透性的影响 随着干旱胁迫加剧,各品系藜麦质膜透性都呈上升趋势,各品系在15%PEG浓度处理时质膜透性均显著高于对照(图2(B))。15%PEG浓度处理时NK5、NK3、NK4、NK1、NK2分别是对照的1.886倍、1.955倍、2.078倍、2.085倍和2.237倍,不同浓度PEG处理下NK5叶片质膜透性均低于其它品系,而NK3均高于其它品系。
2.2.3 干旱胁迫对不同品系藜麦叶片丙二醛(MDA)含量的影响 随着干旱胁迫的增强,不同品系藜麦叶片的MDA含量呈增加趋势(图2(C)),在轻度(5%PEG)和中度(10%PEG)干旱胁迫下,增加速度相对缓慢,在重度(15%PEG)干旱胁迫下,MDA含量迅速积累,并达到最大值。在15%PEG处理时细胞膜系统的受损程度为:NK3>NK4>NK1>NK2>NK5,MDA含量分别比对照增大了116.63%、115.66%、82.28%、62.53%和60.53%。
2.2.4 干旱胁迫对藜麦叶片脯氨酸含量的影响 随着干旱胁迫加剧,5种品系藜麦叶内的脯氨酸都明显增加(图2(D)),在15%PEG处理时达到最大。NK2、NK5、NK1、NK4、NK3脯氨酸含量分别比对照提高了168.99%、162.18%、162.07%、110.22%和92.89%。
2.2.5 干旱胁迫对藜麦叶片抗氧化酶活性的影响 由图3(A)~图3(D)可知,干旱胁迫下不同品系藜麦CAT、POD、SOD、APX活性均呈现先升后降的规律。低胁迫水平使4种酶活性增加,高胁迫水平则使4种酶活性不断降低。各品系在15%PEG浓度处理时SOD、CAT活性均显著低于对照,POD活性与对照无显著差异,而APX则显著高于对照。在5%PEG浓度处理时各品系CAT、SOD、APX活性均增至最大,之后随干旱胁迫水平增加,叶片3种酶活性不断下降。不同浓度干旱胁迫下POD活性与其它3种酶相比有所不同,各品系在10%PEG浓度处理时POD活性达到最大,随后急剧下降。
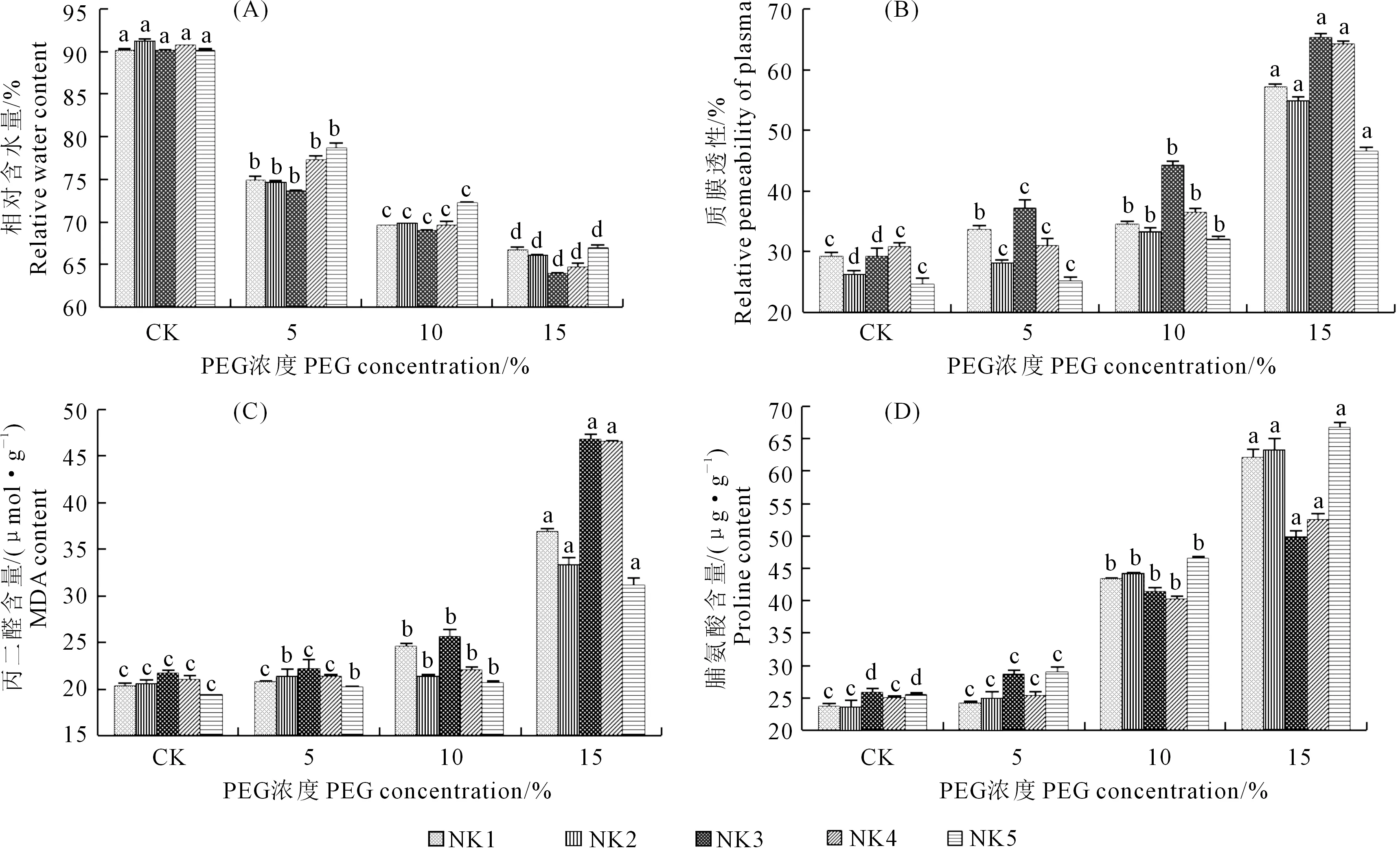
图2 PEG处理对5个藜麦品系叶片相对含水量、质膜透性、丙二醛含量、脯氨酸含量的影响Fig.2 Effect of PEG on the content of relative water, relative permeability of plasma, content ofmalondialdehyde and proline in leaves of five quinoa species
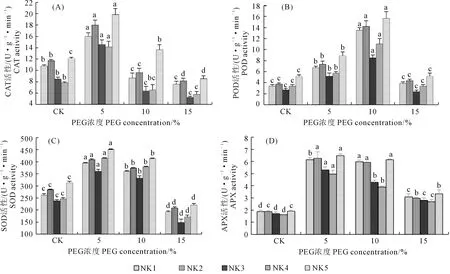
图3 PEG处理对5个藜麦品系叶片抗氧化酶活性的影响Fig.3 Effect of PEG on the activities of CAT,POD,SOD, and APX in leaves of five quinoa species
2.3 干旱胁迫对藜麦光合特性的影响
2.3.1 干旱胁迫对藜麦叶绿素(Chl)含量的影响 不同强度干旱胁迫下各品系藜麦Chl含量呈现先升再降趋势(图4)。在5%、10%PEG浓度处理下Chl含量显著增加且在10%浓度时达到最大,增长幅度由大到小依次为NK5、NK2、NK1、NK3和NK4,分别比对照增加了22.07%、21.17%、21.07%、20.28%和16.20%。在15%PEG浓度处理下,Chl含量迅速降低。
2.3.2 干旱胁迫对藜麦净光合速率(Pn)和蒸腾速率(Tr)的影响 由图5(A)可知,随着干旱胁迫的增强,各品系藜麦叶片Pn呈显著降低趋势;下降幅度由大到小依次为NK4、NK1、NK3、NK2和NK5,15%PEG浓度处理下分别比对照下降了57.19%、56.77%、53.45%、51.16%和50.15%。随着干旱胁迫的增强,各品系藜麦叶片Tr显著下降(图5(B))。不同品系均在15%PEG浓度处理时Tr降到最低,下降幅度由大到小依次为NK3、NK4、NK1、NK2和NK5,与对照相比分别下降了57.15%、56.50%、55.47%、49.67%和43.59%。
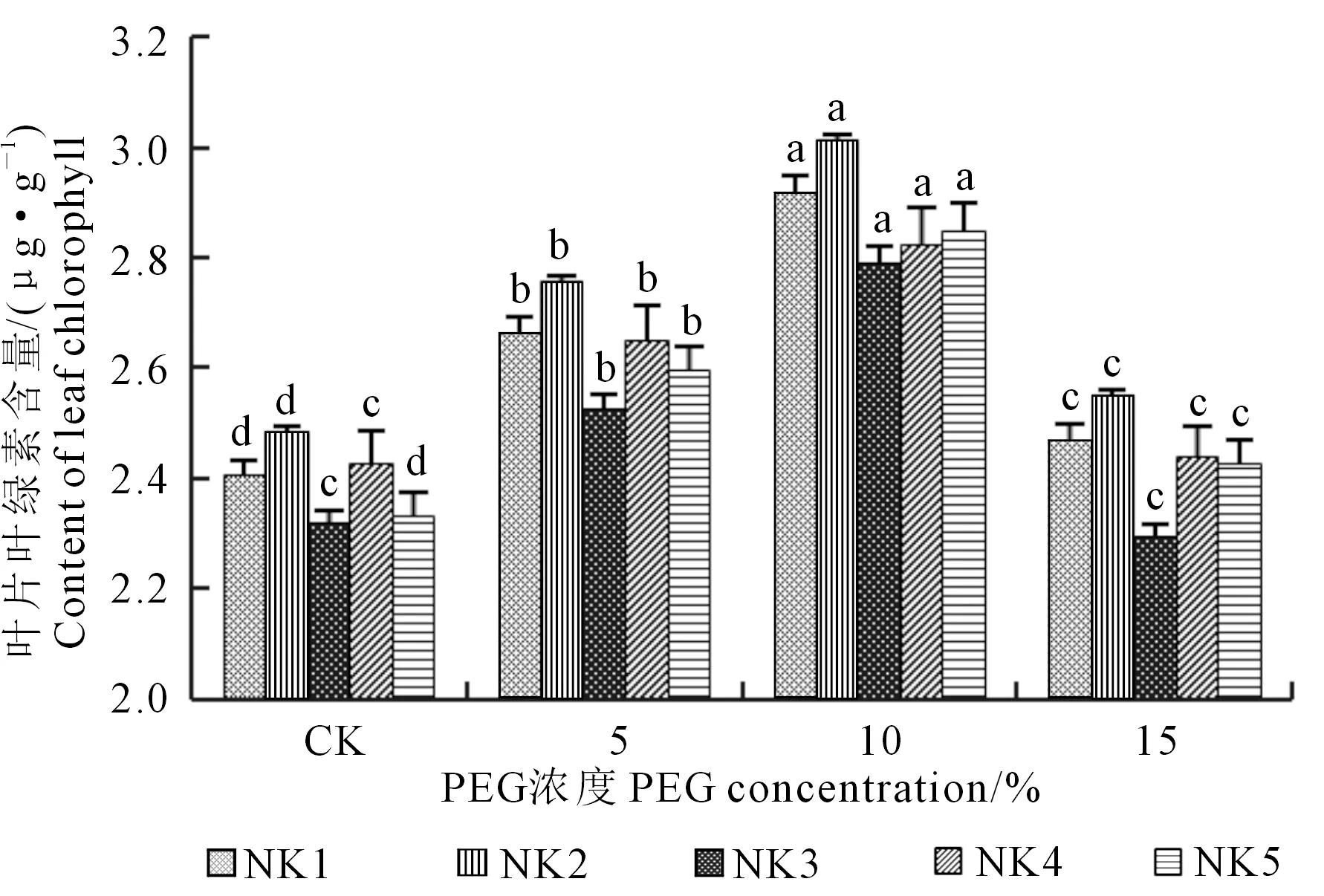
图4 PEG处理对5个藜麦品系叶片Chl的影响Fig.4 Effect of PEG on chlorophyll content in leavesof five quinoa species
2.3.3 干旱胁迫对藜麦叶片气孔导度(Gs)和胞间 CO2浓度(Ci)的影响 藜麦叶片的Gs随着干旱胁迫增强呈下降趋势(图5(C))。15%PEG浓度时下降幅度由大到小依次为NK2、NK3、NK1、NK4和NK5,与对照相比分别下降了68.88%、68.70%、68.34%、67.74%和67.44%。由图5(D)可以看出,随着干旱胁迫的增强,各品系藜麦叶片Ci呈先降后升趋势,在10%PEG处理时降到最低,此胁迫水平下,NK4、NK1、NK3、NK2和NK5与对照相比分别下降了43.13%、36.36%、31.86%、25.45%和21.98%。
2.4 5种藜麦品系耐旱性综合评价
对各藜麦在15%PEG浓度处理下生长指标、抗逆生理生化指标和光合指标进行隶属函数分析(见表2),结果表明,NK1、NK2、NK3、NK4、NK5各项指标隶属函数平均值分别为0.666、0.599、0.144、0.371、0.885,5种品系藜麦抗旱性由高到低依次为NK5、NK1、NK2、NK4和NK3。
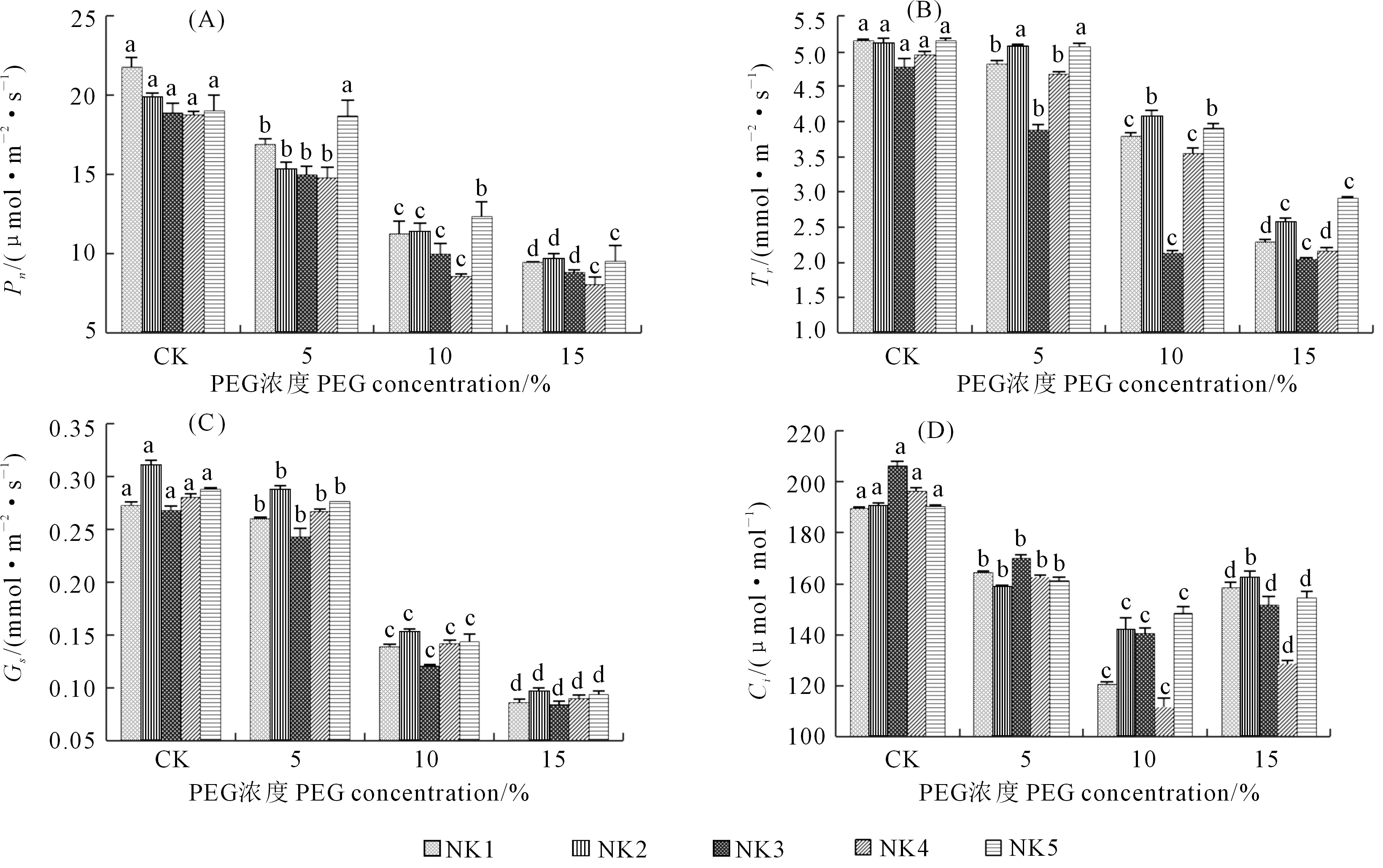
图5 PEG处理对5个藜麦品系光合特性的影响Fig.5 Effect of PEG on the photosynthetic response of five quinoa species
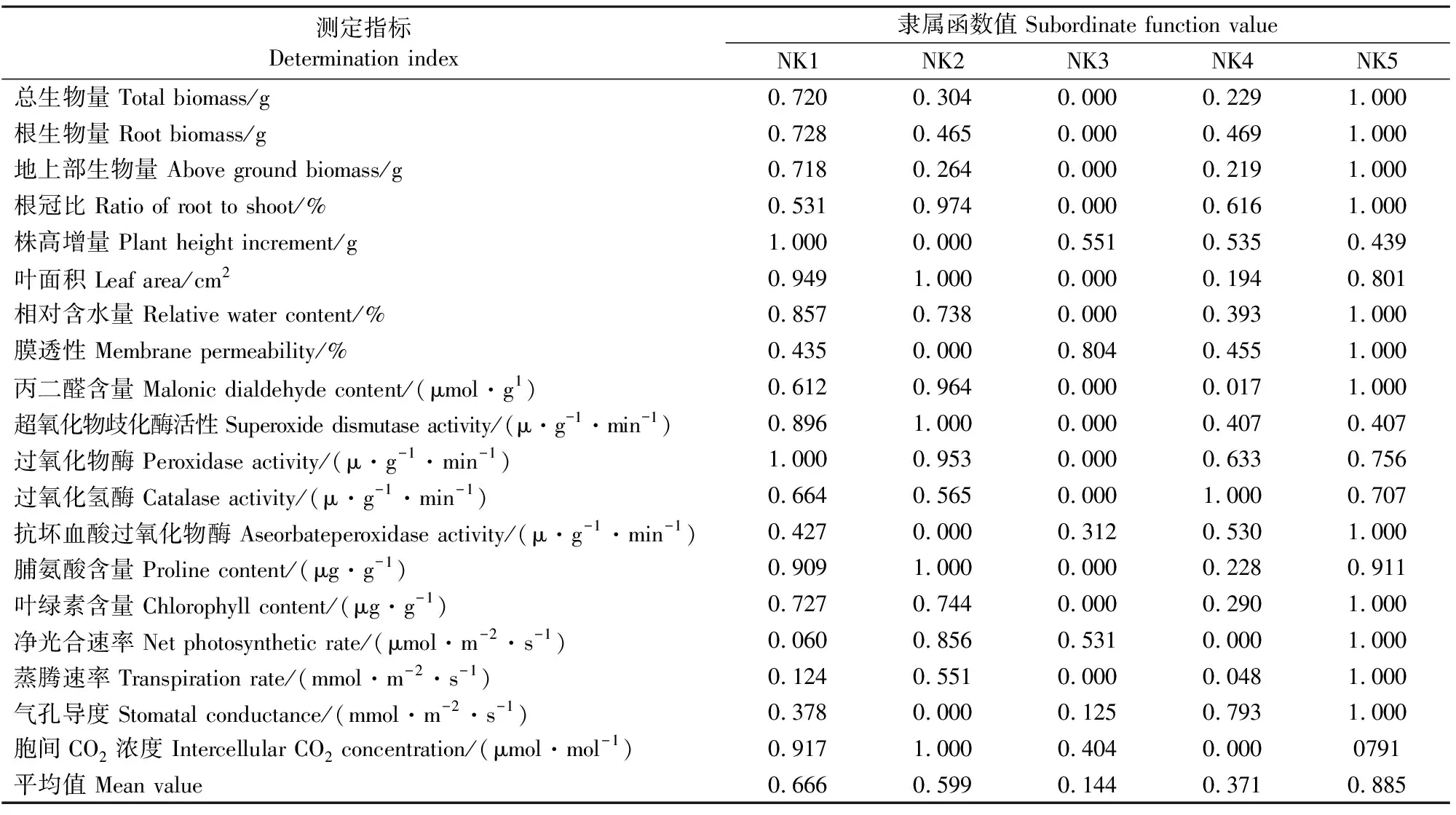
表2 15%PEG浓度下5个藜麦品系各测定指标的隶属函数值
3 结论与讨论
3.1 干旱胁迫对藜麦生长的影响
随着干旱胁迫的增加,各藜麦品系生物总量显著下降。干旱也促使藜麦干物质的分配发生了改变,随着干旱胁迫加重,生物量优先向根系分配,根冠比增大,表现了植物适应干旱逆境的能力[23];同时,随着干旱胁迫的增强,藜麦的叶面积显著降低,而叶片作为水分消耗的重要器官,在干旱胁迫条件下的变化是维持植物体内水分平衡的重要表现[24]。本试验结果表明,与其它品系相比,NK5总生物量下降幅度最低,同时也有较高的根冠比,表现出了较强的抗旱能力。
3.2 干旱胁迫对藜麦抗逆相关生理生化特性的影响
叶片相对含水量降幅越小,植物抗旱性就越强[25]。本试验中5个藜麦品系在干旱胁迫条件下叶片相对含水量均呈显著下降的趋势。NK5叶片相对含水量均高于其它品系且其降幅较小,对干旱的耐受性较强。干旱胁迫下植物膜蛋白受伤害导致细胞膜透性增大[26]。通常抗旱性强的植物具有较低的电解质外渗率,其上升速度也慢[27]。MDA是植物细胞膜脂过氧化物之一,能与细胞内各种成分发生反应,从而引起各种酶和膜的严重损伤[28]。5种品系藜麦叶内MDA含量有所增加,说明细胞膜系统受到了破坏,但在5%和10%PEG干旱胁迫下MDA增长较慢,说明各藜麦品系对干旱有一定的忍耐力。脯氨酸是调节植物干旱胁迫条件下细胞水势的物质之一。余玲等[29]发现紫花苜蓿在干旱胁迫下脯氨酸含量上升,李予霞[30]在葡萄中也发现同样结果,与前人结果一致。本试验5种品系藜麦叶内游离脯氨酸含量在PEG胁迫下均有不同程度的增加,在重度干旱胁迫下,各藜麦叶内脯氨酸含量迅速增高,说明在重度干旱胁迫下脯氨酸起着重要的作用。藜麦在5%、10%PEG浓度胁迫下能保持较高的抗氧化酶活性,以清除过多的活性氧,降低干旱引起的氧化损伤。15%浓度干旱胁迫下,4种抗氧化酶活性有所降低,可能因为严重干旱已经对藜麦造成损伤,抗氧化酶清除超氧阴离子和过氧化物能力降低。SOD、CAT、POD、APX活性都呈现先增高后降低的规律,但SOD、CAT和APX活性在5%浓度时达到最高,POD在10%浓度时活性达到最高,表明不同品系藜麦中4种抗氧化酶能力有所差异。
3.3 干旱胁迫对藜麦光合特性的影响
光合作用是构成植物生物量的基础[33],生物量又影响着植物的发育和结构的形成[34]。随着干旱胁迫的增强,Pn、Tr、Gs显著下降,各品系藜麦光合能力降低,生长受到抑制,地下、地上部分生长缓慢,总生物量显著下降。在5%、10% PEG浓度处理下,Ci呈降低趋势;但到15% PEG浓度处理时,Ci呈增长趋势。王萍等[35]认为沙芥幼苗叶片光合速率下降主要是由叶肉细胞同化能力降低等非气孔因素引起的。关于干旱胁迫下植物叶片中叶绿素含量的变化报道不一。任磊等[36]认为随着干旱胁迫的增强,各品种茶菊Chl含量呈显著增加趋势;邬佳宝等[37]认为随水分胁迫处理时间的延长,文冠果叶片Chl含量呈下降趋势。本研究中,随着干旱胁迫增加,各品系藜麦叶片Chl含量呈现先增加后降低的趋势,并在10%PEG浓度处理时达到最大,这种趋势与时丽冉等[38]研究结果相符。在本试验中抗旱性较强的NK5 Chl含量增加幅度较大,生物量和Pn下降幅度最小;抗旱性较弱的NK3 Chl含量增加幅度较小,生物量和Pn下降幅度较大。由此推测,在干旱胁迫下,藜麦Chl含量变化与Pn有正相关性。
综上所述,5种品系藜麦幼苗在生长、抗逆相关生理生化和光合特性等方面均对干旱胁迫表现出明显的响应,但不同品系对干旱胁迫的耐受能力及适应能力不同,且单项指标不能有效、准确地评价植物抗旱性。因此,结合隶属函数法对重度干旱胁迫下不同指标进行综合评价,5种藜麦品系耐旱性依次为NK5>NK1>NK2>NK4>NK3,这与其生长、生理等指标的变化相吻合。这一结论将为我国干旱、半干旱地区藜麦品系的引种和筛选提供一定的参考。
