外源ABA对苹果砧木叶片解剖结构及内源激素含量的影响
2019-07-18王顺才师守国马锋旺
王顺才,李 超,师守国,马锋旺
(1.天水师范学院 生物工程与技术学院,甘肃 天水 741000;2.西北农林科技大学园艺学院,陕西 杨凌 712100)
脱落酸(abscisic acid,ABA)是植物体内合成的一类植物激素,在种子萌发、幼苗生长、植物发育调控、气孔行为、叶片衰老、非生物胁迫及病虫害响应中起着重要的作用[1-3]。研究表明,植物在应答非生物胁迫时能够快速合成胁迫激素ABA,激发ABA诱导基因的表达,并导致气孔关闭,减少蒸腾失水,最终抑制细胞生长[4]。与其他环境胁迫因子一样,外施ABA也能诱导胁迫相关基因的表达,通过积累保护性物质和促使相关的代谢途径发生改变来提高植物的抗逆性[5-6]。在生产中,外施ABA可以提高果树的抗逆能力,在生理水平上减少膜的损伤,减少自由基对膜的破坏以及改变植物体内生理代谢[7]。据报道,叶面喷施ABA可通过调节活性氧(ROS)水平来提高菊花的抗蚜性[8]。近年来,转录组研究结果证实,在ABA处理下,被子植物有数千个相似基因发生上调和下调表达,其中许多ABA相关基因在植物水分平衡和水分利用效率(WUE)方面的功能比较保守,涉及到渗透调节物质的累积、光合蛋白的降解以及气孔密度与大小、叶面积及根系的变化等生理生化机制[9]。
苹果(MalusdomesticaBorkh.)是世界寒冷和温带地区栽培面积最广的果树之一[10]。在我国苹果生产中,楸子、平邑甜茶和新疆野苹果是常见的砧木材料[11]。楸子(M.prunifolia(Willd.) Borkh.)和新疆野苹果(M.sieversiiLedeb.)具有较强的抗旱及耐盐性,而平邑甜茶(M.hupehensisRehd.)表现出较高的抗病、耐涝及耐低氧胁迫能力[12-14]。在国内学者以往的研究中,外源ABA处理对苹果砧木影响的研究多集中在生长发育及生理生化方面[15-16],而对不同苹果砧木叶片解剖结构、角质层厚度、气孔特征、叶绿体超微结构及内源激素含量变化的研究依然缺乏。因此,进行此方面的相关研究,对深入了解苹果砧木的抗性调控机理及其应用具有重要的意义。
1 材料与方法
1.1 试验材料及处理
试验在西北农林科技大学园艺场日光温室内进行。楸子(陕西富平,34°75′N,109°15′E)、平邑甜茶(山东平邑,35°07′N,117°25′E)和新疆野苹果(新疆巩留,43°15′N,82°51′E)种子均从原产地采调,经4℃层积处理后播种在营养钵中育苗发芽,幼苗长至10 cm时,选生长整齐一致的幼苗进行盆栽,移栽于塑料盆(30 cm×26.5 cm×22 cm)中,每盆1株,培养基质由田园土、细砂和腐熟羊粪按5∶1∶1(体积比)配制,常规管理1年。
第二年7月下旬,每个树种选取长势一致、株高约1 m的盆栽苗20株,设置2组处理:一组喷施去离子水(对照),另一组喷施ABA,每个处理各10株。根据预试验的结果,叶面喷施ABA浓度为100 μmol·L-1[17]。早上9∶00进行叶面喷施处理,以叶片正反面全部湿润为准,24 h后采样。每组随机选取3株,分别取其新梢顶端完全展开的第4~5片幼叶,在叶片主叶脉两侧用刀片切取大小为2 mm × 2 mm的组织块,快速投入用0.1 mol·L-1磷酸缓冲液(PBS,pH6.8)配制的1%戊二醛中,抽气使组织块下沉后,带回实验室进行扫描电镜和透射电镜样品的制备。同时,随机选取长势一致的对照组和ABA处理组植株各3~4株,每组选取新梢顶端完全展开的第4~6片幼叶,重复3次,用铝箔纸封包后迅速投入液氮,采样带回实验室后置于-70℃保存备用。
1.2 测试指标
1.2.1 扫描电镜和透射电镜样品的制备与观察 扫描电镜和透射电镜样品的制备参照前期研究中干旱处理样品的制备方法[18]。扫描电镜样品表面喷金后用JSM-6360LV型扫描电镜(JEOL Ltd.,Tokyo,Japan)进行观测照相,每个处理观察20个视野,用ImageJ软件(http://rsbweb.nih.gov/ij/)对气孔密度、气孔大小(长度×宽度)及其开张度(用气孔开口横径表示)进行测量和计算。
透射电镜样品包埋块用LeicaultracutUCT超薄切片机(Leica Microsystems GmbH,Wetzlar,Germany)切出约70 nm厚的超薄切片,经醋酸双氧铀和柠檬酸铅双重染色后,用JEM-1230型透射电镜(JEOL Ltd.,Tokyo,Japan)观测叶片上下角质层及叶绿体超微结构。超薄切片每个处理观察20个视野并照相,并用ImageJ软件对角质层厚度进行测量。
1.2.2 光镜样品的制备与观察 制备光镜样品时,选透射电镜样品组织块,切出厚度约为1 100 nm的半薄横切片,用1%甲苯胺蓝染色20 s,蒸馏水冲洗后置于60℃烘干。半薄切片每处理选择3个典型叶片在光学显微镜CX31-12C02(Olympus Co.,Ltd.)下观察叶片厚度、栅栏组织厚度、海绵组织厚度及其上下表皮细胞厚度并拍照,用ImageJ软件进行测量,并按下式计算:叶片组织结构紧密度CTR(%)=栅栏组织厚度/叶片总厚度×100%;叶片组织结构疏松度SR(%)=海绵组织厚度/叶片总厚度×100%。
1.2.3 内源激素含量的测定 利用酶联免疫吸附法(ELISA)测定叶片内源激素脱落酸(ABA)、吲哚乙酸(IAA)、玉米素核苷(ZR)和赤霉素(GA)的含量[19]。试剂盒由中国农业大学农学与生物技术学院提供,激素测定在中国农业大学完成,激素单位均为ng·g-1。
1.3 数据处理与统计分析
试验数据采用IBM SPSS 23.0软件进行成对样品T-检测(Paired Test),图形绘制用Sigma Plot 10.0 软件进行。
2 结果与分析
2.1 ABA处理对苹果砧木叶片解剖结构及叶绿体超微结构的影响
由图1可见,光镜观察发现,3种苹果砧木的叶片均为异面叶,表皮由单层细胞构成,上下表皮厚度不等,栅栏组织都有2层柱状细胞,与上表皮细胞呈垂直排列分布,外层柱状细胞长度比较一致且排列整齐,而内层柱状细胞长短不一且排列较疏松。其中,楸子和平邑甜茶的内外层栅栏细胞长度相差较小,而新疆野苹果外层栅栏细胞长度明显大于内层栅栏细胞(图1(A)~图1(C))。在ABA处理下,3种苹果砧木叶片组织发生明显的失绿变化,叶肉细胞内液泡收缩,栅栏组织外层细胞中叶绿体数量明显减小,而海绵组织细胞内叶绿体数目的减少不十分明显(图1(D)~图1(F))。
由表1可知,ABA处理下,楸子、平邑甜茶和新疆野苹果的叶厚较对照(CK)分别减少了7.93%、0.25%和0.81%,栅栏组织厚度分别减少了31.43%、8.53%和4.99%(P<0.05),海绵组织厚度分别增加了10.34%、6.14%和5.63%(P<0.05)。与对照相比,外施ABA使楸子叶片上下表皮细胞厚度均增加,而下表皮细胞增厚达到显著水平(P<0.05);平邑甜茶的上表皮细胞厚度增加,下表皮厚度减小,但变化都不显著;新疆野苹果的上表皮细胞厚度显著减小而下表皮厚度显著增加(P<0.05)。此外,ABA处理使3种苹果砧木的栅栏组织/海绵组织(P/S)比值、CTR值都下降,使其SR值均增加。
由图2可见,正常条件下,3种苹果砧木叶肉细胞内每个叶绿体有1~2个淀粉粒(图2(A)~图2(C))。在ABA处理下,3种砧木叶肉细胞内叶绿体的体积趋于变小,类囊体垛叠凝聚,出现松散现象,叶绿体上淀粉颗粒大小趋于减少。其中,楸子叶绿体上的淀粉粒变化较明显(图2(D)),而平邑甜茶和新疆野苹果的变化较小(图2(E)、2(F))。

注:(A)~(C)分别为楸子、平邑甜茶与新疆野苹果的对照,(D)~(F)分别为上述3种材料的ABA处理。UE-上表皮细胞;LE-下表皮细胞;PC-栅栏组织细胞;SC-海绵组织细胞;ST-气孔。标尺:50.0 μm。Note: (A)~(C) represent the leaf cross sections of M. prunifolia, M. hupenensis and M. sieversii under control condition, and (D)~(F) represent those of three apple rootstocks under ABA treatment, respectively. UE, upper epidermis; LE, lower epidermis; PC, palisade tissue cells; SC, spongy tissue cells; ST, stomata. Bar, 50.0 μm.图1 ABA处理对3种苹果砧木幼苗叶片解剖结构的影响Fig.1 Effect of ABA treatment on leaf anatomical structure of three apple rootstock seedlings
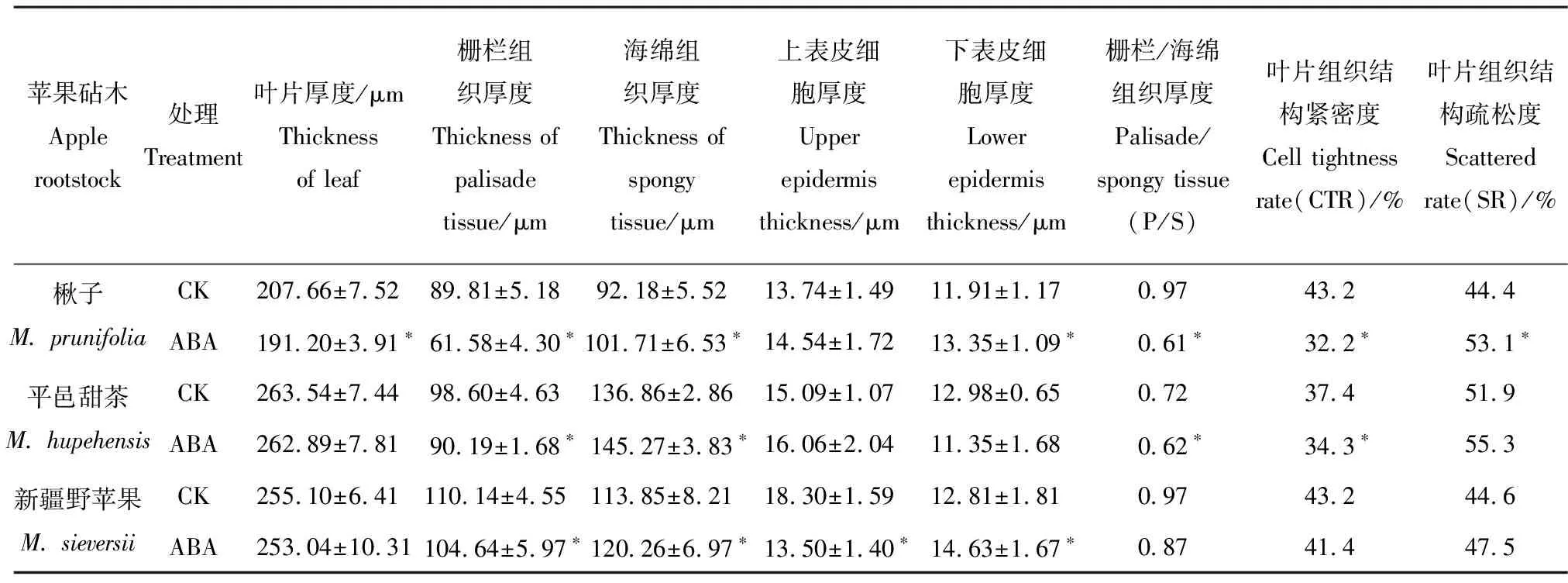
表1 ABA处理下3种苹果砧木幼苗叶片组织解剖结构的变化
注:表中数据为平均数±标准差,*表示P<0.05显著水平。下同。
Note: Data represents the means ± SD. * mean significantly different atP<0.05. The same below.
2.2 ABA处理对苹果砧木叶片角质层厚度的影响
透射电镜观察结果表明,在正常条件下,3种苹果砧木叶片的上表皮角质层较厚,而它们的下表皮角质层较薄(图3、图4)。其中,上表皮角质层厚度大小依次为平邑甜茶>新疆野苹果>楸子,而下表皮角质层厚度大小为楸子>新疆野苹果>平邑甜茶。
与对照相比,在ABA诱导下,楸子叶片的上下表皮角质层厚度无显著变化,而平邑甜茶和新疆野苹果的上下表皮角质层厚度显著增加(P<0.05),其上表皮角质层较对照分别增加了40.26%和23.09%(图4(A)),其下表皮角质层厚度分别增加了16.56%和5.24%(图4(B))。
2.3 ABA处理对苹果砧木叶片气孔特征的影响
扫描电镜观察发现,正常条件下,3种苹果砧木的叶片仅下表皮有气孔分布,两个肾形的保卫细胞构成的气孔器大小不一,且明显凸出表皮,处于最大开放状态(图5(A)~图5(C))。在ABA处理下,楸子和平邑甜茶叶片的部分气孔几乎完全关闭(图5(D)、5(E)),而新疆野苹果的大部分气孔仍处于半闭合状态(图5(F))。
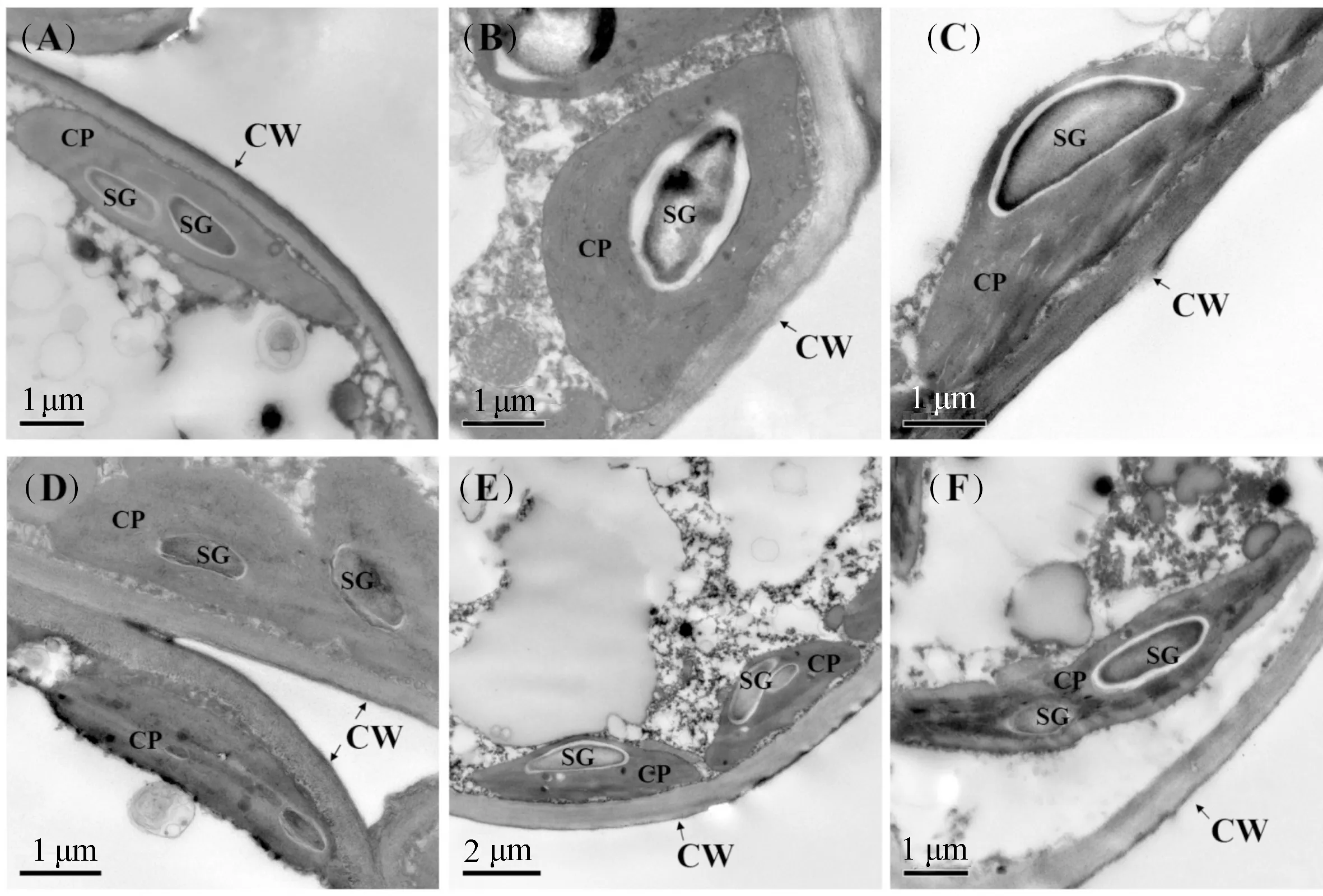
注:(A)~(C)分别为楸子、平邑甜茶与新疆野苹果的对照;(D)~(F)分别为上述3种材料的ABA处理。CP-叶绿体,SG-淀粉粒,CW-细胞壁。标尺(A)~(D)、(F):1μm,(E):2μm。Note: (A)~(C) represent the chloroplast ultrastructure of M. prunifolia, M. hupenensis and M. sieversii under control condition, and (D)~(F) represent those of three apple rootstocks under ABA treatment, respectively. CP, chloroplasts; SG, starch grain; CW, cell wall. Bar of (A)~(D) and (F), 1 μm; Bar of (E), 2 μm.图2 ABA处理对3种苹果砧木幼苗叶绿体超微结构的影响Fig.2 Effect of ABA treatment on chloroplast ultrastructure of three apple rootstock seedlings

注:(A)~(C)分别为楸子、平邑甜茶与新疆野苹果对照叶片上表皮角质层;(D)~(F)分别为上述3种材料ABA处理的上表皮角质层。Ct-角质层,CW-细胞壁,PM-质膜。标尺(A)~(E):2 μm;(F):5 μm。Note: (A)~(C) represent the upper cuticle in leaves of M. prunifolia, M. hupenensis and M. sieversii under control condition, and D~F represent those of three apple rootstocks under ABA treatment, respectively. Ct, cuticle; CW, cell wall; PM, plasma membrane. Bar of (A)~(E), 2 μm; Bar of (F), 5 μm.图3 ABA处理对3种苹果砧木幼苗叶片角质层厚度的影响Fig.3 Effect of ABA treatment on leaf cuticle thickness of three apple rootstock seedlings
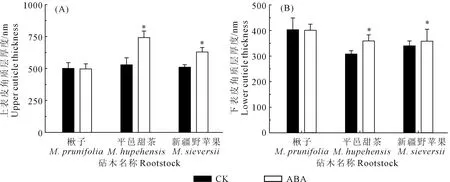
注:图中*表示差异显著(P<0.05),下同。Note: * means significantly different at P<0.05, the same below.图4 ABA处理下3种苹果砧木幼苗叶片上下表皮角质层厚度的变化Fig.4 Changes of the upper and lower cuticle thickness in leaves of three apple rootstockseedlings under ABA treatment
在ABA处理下,楸子、平邑甜茶和新疆野苹果的气孔密度较对照分别下降了3.62%、3.50%和8.54%(图6(A));楸子的气孔大小(长度×宽度)较对照下降了7.12%×19.59%(P<0.05),平邑甜茶的气孔大小下降了4.99%×20.65%,而新疆野苹果的气孔大小变化相对较小,其降幅为0.92%×12.06%(图6(B)、6(C))。
与对照相比,ABA处理使楸子、平邑甜茶和新疆野苹果的气孔开张度分别下降了67.60%、32.42%和20.37%(P<0.05,图7(A)),其开张比分别下降了86.66%、58.24%和16.35%(P<0.05,图7(B))。
2.4 ABA处理对苹果砧木叶片內源激素含量的影响
从表2可见,与对照相比,在ABA诱导下,3种苹果砧木叶片内源ABA和玉米素核苷(ZR)含量极显著地增加(P<0.01),其中楸子的ABA和ZR含量分别增加了30.83%和13.31%,平邑甜茶的分别增加了62.40%和45.28%,而新疆野苹果的增加了37.07%和17.06%。平邑甜茶叶片内源吲哚乙酸(IAA)和赤霉素(GA)含量极显著增加(P<0.01),比其对照分别增加62.62%和20.62%;而楸子和新疆野苹果叶片IAA和GA含量无显著变化。3种苹果砧木的IAA/ABA、ZR/ABA和(IAA+GA+ZR)/ABA比值都显著下降(P<0.05);而它们的ZR/GA、ZR/IAA和ABA/GA比值均升高,其中平邑甜茶和新疆野苹果的变化较明显,两者的ZR/GA值比其对照分别上升41.56%、18.92%(P<0.05),ZR/IAA值分别上升24.00%、19.23%(P<0.05),ABA/GA值分别上升59.92%、38.48%(P<0.01)。

图6 ABA处理下3种苹果砧木幼苗叶片气孔密度和气孔大小的变化Fig.6 Changes of stomatal density and stomatal size in leaves of three apple rootstock seedlings under ABA treatment

图7 ABA处理下3种苹果砧木幼苗气孔开张度及开张比的变化Fig.7 Changes of the opening degree and rate of stomata in leaves of three apple rootstock seedlings under ABA treatment

表2 ABA处理下苹果砧木幼苗叶片內源激素含量的变化
注:*、**和***分别表示P<0.05、P<0.01和P<0.001显著水平。
Note: *, **and***meansignificantlydifferentatP<0.05, P<0.01andP<0.001,respectively.
3 讨论
3.1 外源ABA对3种苹果砧木叶片解剖结构的影响
前人研究表明,苹果砧木叶片的解剖结构特征与其生长势密切相关,矮化砧木叶片的栅栏组织较发达,而乔化砧木叶片的海绵组织较发达,叶片栅栏组织/海绵组织(P/S)比值>1是评价砧木矮化性的有效指标之一[20]。本试验发现,正常条件下新疆野苹果和楸子的P/S比值均为0.97,而平邑甜茶的P/S比值仅为0.72(表1)。3种苹果砧木也符合乔化砧木叶片P/S比值<1这一观点[20]。研究表明,较大的叶片表皮细胞具有贮水作用,有利于增强植物水分的调节能力,这是植物对旱生环境的一种适应[21]。在ABA处理下,楸子叶片上下表皮细胞厚度和新疆野苹果叶片下表皮细胞厚度明显增加,而平邑甜茶仅上表皮细胞略有增厚。这表明,ABA诱导下楸子叶片表现出较强的适应旱生环境的能力。
在ABA处理下,3种苹果砧木的叶厚、栅栏组织厚度均不同程度地减小,而海绵组织厚度均不同程度地增加,表现为P/S比值、CTR值下降,SR值增加,呈现出一定的规律性。这与我们前期干旱试验的研究结果相一致[18]。这表明外源ABA处理使苹果砧木叶片形成了更具抗旱性的解剖结构特征,增强了其适应环境的能力。与对照相比,在ABA处理下抗旱砧木楸子栅栏组织柱状细胞明显地变短变粗,细胞间隙减小,排列程度更加紧密,柱状细胞层数增加至2~3层(图1(D)),而非抗旱砧木平邑甜茶和抗旱砧木新疆野苹果的栅栏组织细胞形态及其排列方式的变化不是十分明显(图1(E)、图1(F))。与平邑甜茶和新疆野苹果相比,楸子叶片解剖结构对ABA处理的反应较敏感。由此说明,不同苹果砧木响应ABA的抗性机制因基因型不同而存在差异,而与砧木的抗旱能力没有明显的一致性。
3.2 外源ABA对3种苹果砧木叶片叶绿体超微结构的影响
本试验发现,3种苹果砧木对照植株叶片细胞中叶绿体紧贴着细胞内壁分布,这种排列方式有利于扩大细胞内光合反应面积,CO2易于从大气向叶绿体中扩散并被利用,也利于植株发挥最大光合效率。在ABA处理下,3种砧木叶片细胞内中央液泡明显缩小,细胞质凝缩,叶绿体与细胞内壁发生分离,类囊体垛叠结构排列松散,叶片细胞中的淀粉粒有变小减少的趋势(图2)。这表明,在ABA处理下,不同苹果砧木叶片的光合结构受到一定程度的影响,光合同化产物淀粉的积累量下降,其中以楸子细胞中淀粉粒的变化最为明显。最新研究发现,外施ABA能诱导拟南芥叶片中编码淀粉酶基因的表达,导致淀粉酶活性升高,降解叶片中的淀粉,进而提高植物的渗透调节能力。植物叶肉细胞中ABA调节淀粉降解积累的糖可作为渗透物质影响保卫细胞的水势进而调节气孔的张开[22]。但董明辉等[23]研究表明,在水稻灌浆期喷施低浓度ABA,提高了籽粒中ABA含量或ABA/GA比值,可促进蔗糖转化为淀粉的生化效率,有利于同化物向穗部运输和籽粒充实。我们认为,外源ABA处理下,3种苹果砧木叶片细胞中淀粉的降解或转化可能与细胞小分子物质的渗透调节作用有关,其中楸子具有较强的渗透调节能力。
3.3 外源ABA对3种苹果砧木叶片角质层厚度的影响
植物叶片表皮角质层由角质和蜡质组成,对其适应外界环境起到了非常重要的作用。角质层具有阻止植物组织内部非气孔性失水和气体交换,提高抗旱性,防止机械损伤及紫外线伤害,抵御病虫害侵袭等功能[24]。最新研究发现,在番茄叶片发育过程中,ABA调控作用是角质层形成所必需的,外施ABA导致番茄角质合成单体2-羟基棕榈酸和香豆酸发生轻微而持续的增加[25]。本试验发现,在ABA诱导下,抗旱砧木楸子上下表皮角质厚度变化不显著,而抗旱砧木新疆野苹果和非抗旱砧木平邑甜茶上下表皮角质层厚度较对照显著增加(P<0.05),且两者上表皮角质层的增厚程度高于下角质层的增厚程度(图3和图4)。这表明,外源ABA诱导苹果砧木角质层厚度的增加量与砧木的抗旱性无关,可能与外施ABA的浓度与作用时间有关。
3.4 外源ABA对3种苹果砧木气孔特征的影响
大量研究表明,ABA为生长抑制型激素,能诱导气孔关闭[4, 26]。植物体内ABA水平的增加可诱导气孔关闭以减少水分损失,通过增加质膜的稳定性,进而增强植物对不良环境的抵抗力[27-28]。气孔对空气湿度的快速反应首先依赖于保卫细胞自主合成的ABA,当植物长期处于水分亏缺时,在维管组织中的ABA可能起着重要的作用[2]。本试验发现,在ABA处理下,3种砧木的气孔密度都有不同程度的降低,气孔开口快速缩小以降低叶片水分蒸腾。这可能是气孔响应ABA的适应性反应。张永福等[29]对荔枝叶解剖结构的研究表明,叶片的气孔密度与生长势呈显著正相关,而气孔开度与生长势的关系不大[29]。本试验结果显示,楸子和平邑甜茶叶片的气孔较小,对ABA处理的反应十分敏感,表现为两者的气孔开张数量及开张比都大幅度降低;而新疆野苹果的气孔较大,在ABA诱导下气孔反应不如楸子和平邑甜茶的明显。有研究报道,叶片表面的气孔越小,气孔反应的速度越快[30]。本试验结果也证实了这一点。
近年来研究表明,气孔反应与ABA诱导表达的基因有关,也与ABA受体密切相关;前者通常在几分钟到几小时内会引起气孔反应,而后者调节气孔反应的速度更快,仅需几秒钟到几分钟[31]。这些过程都需要很多复杂的内外因子参与,目前有关ABA信号分子参与调控植物气孔发生和气孔运动的分子机理并不完全清楚[32]。
3.5 外源ABA对3种苹果砧木叶片内源激素含量的影响
激素作为植物体内痕量信号分子,在植物的生长发育、新陈代谢和逆境应答中起着重要的调节作用[26,33]。本试验发现,外施ABA使3种苹果砧木叶片内源ABA和ZR的含量极显著增加(P<0.01),叶片ABA与ZR含量之间的变化呈正响应。研究证实,植物体内合成的ABA来自于玉米素(zeatin,ZT)[34],而ZT与玉米素核苷(zeatinriboside,ZR)的合成存在着关联。研究表明,不同植物器官和组织中ABA的分布是不均匀的,ABA水平是由ABA的合成、分解及其转运三者间相互协调控制的[2]。高水平的ABA是诱发植物体内ABA信号转导途径的关键[35]。不同器官ABA水平的提高导致植物特定器官或细胞的应答[27]。李源等[21]研究发现,干旱胁迫下3种胶质苜蓿的ZR/ABA比值均下降,ZR与ABA的拮抗作用是向着气孔关闭的方向进行。本试验结果显示,外源ABA处理下3种苹果砧木叶片ZR/ABA比值及其气孔变化与干旱胁迫下3种胶质苜蓿的变化相一致。
植物激素之间相互作用控制着植物的生长发育[36]。IAA和GA具有促进生长的作用,GA的生理功能以IAA为前提,而与ABA相拮抗[37]。植物在抵御逆境的过程中,IAA和GA对植物的抗旱和水分利用效率的提高有重要作用[38]。本试验发现,外施ABA使平邑甜茶内源IAA和GA含量极显著上升(P<0.01),而楸子和新疆野苹果的IAA和GA含量变化不显著。这可能是因为与平邑甜茶对照植株相比,楸子和新疆野苹果对照植株体内较高水平的ABA,对IAA和GA的合成可能有较强的拮抗作用(表2)。
曹敏格等[20]对苹果砧木的研究表明,叶片IAA/ABA和(IAA+GA+ZR)/ABA比值与树体生长势存在正相关性,两者的比值越小,对树体的矮化程度越大。张晨光等[39]对不同砧木类型‘富士’苹果幼树的研究表明,幼树生长势越强,叶片IAA/ABA和(IAA+GA+ZR)/ABA比值越大。本试验发现,在正常条件下,3种苹果砧木叶片IAA/ABA和(IAA+GA+ZR)/ABA比值均为平邑甜茶>新疆野苹果>楸子;在ABA处理下,它们的叶片IAA/ABA和(IAA+GA+ZR)/ABA比值都降低,比值大小为楸子>平邑甜茶>新疆野苹果。我们认为,外源ABA可通过改变苹果砧木内源激素含量以及激素之间的相互作用来抑制植株的生长,但不同砧木的矮化程度不同。这些内源激素的变化可能与ABA诱导的信号转导途径有关[3]。
4 结 论
在外施ABA条件下,3种苹果砧木叶片的组织解剖结构都不同程度地发生了旱生性变化,叶肉细胞中叶绿体内的淀粉粒趋于变小,气孔数量、大小及其开口度和开张比均发生不同程度的降低以减少叶片水分的散失,进而增强植株适应环境的能力。在ABA诱导下,不同苹果砧木叶片角质层厚度的变化具有种间差异性,其中,新疆野苹果和平邑甜茶叶片上下表皮角质层的增厚程度比楸子的明显。与对照相比,在ABA处理下3种苹果砧木叶片内源激素ABA和ZR含量极显著增加,平邑甜茶IAA和GA含量极显著增加,而新疆野苹果和楸子IAA和GA含量变化不显著;3种苹果砧木的ZR/GA、ZR/IAA和ABA/GA比值均增加,而ZR/ABA、IAA/ABA和(IAA+GA+ZR)/ABA的比值均下降,这些内源激素含量及其相互比值的变化具有调节气孔反应、抑制植株生长的生理效应。以上变化与ABA的抗性调控机制有着密切的关系,而它们之间相互作用的内在机制仍需进一步研究。
