基于KASP技术的稻瘟病抗性基因Pi9分子标记的开发与评价
2019-07-18李孝琼何新柳陈红操黄克宁卢东长城郭嗣斌
韦 宇,李孝琼,何新柳,陈红操,陈 颖,黄克宁,卢东长城,郭嗣斌*
(1. 广西壮族自治区农业科学院水稻研究所/广西水稻遗传育种重点实验室,广西 南宁 530007;2. 南宁维尓凯生物科技有限公司,广西 南宁 530033;3. 广西壮族自治区农业科学院,广西 南宁 530007)
【研究意义】水稻是世界上重要的粮食作物之一,全世界近50 %的人口以稻米为主食[1]。然而,由丝状子囊真菌稻瘟病菌(Magnaportheoryzae)引起的水稻稻瘟病是全球范围内严重影响稻米品质及产量的主要病害之一,给粮食生产带来重大损失,严重威胁世界粮食安全[2-3]。目前,稻瘟病的防治措施主要有喷施化学药剂和选用抗稻瘟病品种,但是使用化学药剂进行防治存在危害环境、增加农业成本等问题。水稻生产实践证明,防治稻瘟病最经济有效的手段就是培育和种植抗稻瘟病水稻品种,而其中的关键则在于广谱高抗的抗性基因资源的鉴定及发掘。【前人研究进展】随着水稻稻瘟病基因研究的不断深入,很多与稻瘟病抗性基因相关的分子标记相继被开发出来。截至2017年,水稻中被报道的主效稻瘟病抗性基因超过100个[4],其中已有27个稻瘟病抗性基因被成功克隆,如Pib[5]、Pb1[6]、Pita[7]、Pi9[8]、Pi2[9]、Pid2[10]、Pi36[11]、Pi37[12]、Pi56[13]及Pigm[14]等。学者们针对已克隆的抗稻瘟病基因开发出了特异性分子标记,利用这些分子标记不仅可以快速准确地对水稻资源进行鉴定,挖掘抗稻瘟病的种质资源,还可以进行分子标记辅助育种,培育抗稻瘟病的育种新材料[15]。Pi9基因来源于小粒野生稻(Oryzaminuta),具有广谱抗性,对来自全世界各稻区的43份稻瘟病菌株都表现出较高的抗性[16-17]。目前在Pi9基因的分子标记辅助育种上,普遍使用PB8标记进行,但该标记为显性标记,不能鉴别稻株的基因型是杂合型还是纯合型,只适合在育种早期进行选择[18]。另外,殷得所等[19]通过将含Pi9基因的“WHD75-1-127”株系与不含该基因的“扬稻6号”以及“Nipponbare”中的Pi9基因进行比较,根据序列差异设计了一个共显性InDel标记,为PB9-1标记,但实验过程中发现抗病材料和感病材料之间只相差3 bp,必须用聚丙烯酰胺凝胶电泳才能检测出来,对实验条件的要求较高,而且最后也难以区分纯合体和杂合体。KASP(Kompetitive allele specific PCR)是竞争性等位基因特异性PCR,是一种基于SNP的新型基因分型技术。KASP 技术具有稳定性好和准确性高、高通量,以及无需合成特异荧光探针,检测成本较低等优点,近年来得到快速的发展,目前已广泛应用于SNP高通量分型、InDels检测等领域[20-21],目前在水稻[22]、小麦[23-25]、卷心菜[26]以及大豆[27-29]等作物中得到广泛的应用。【本研究切入点】利用KASP技术开发Pi9基因荧光分子标记,经简单的PCR扩增和荧光扫描就能快速获得基因分型结果,不需要经过繁琐的凝胶电泳分析,从而显著提高检测效率。因此,该标记可以作为一种高通量的基因分型分子标记。【拟解决的关键问题】针对不同水稻材料中Pi9基因差异序列设计、开发可用于筛选具有广谱抗稻瘟病基因Pi9的KASP分子标记,通过分析比对水稻后代群体278份子代材料Pi9基因的Pi9-KASP基因型和SSR标记基因型,并结合子代材料的稻瘟病抗性鉴定结果,验证该KASP标记有效性。拟解决普通分子标记过程中费时费力的问题,加速分子标记辅助聚合优异抗病基因及培育抗病新品种的进程。
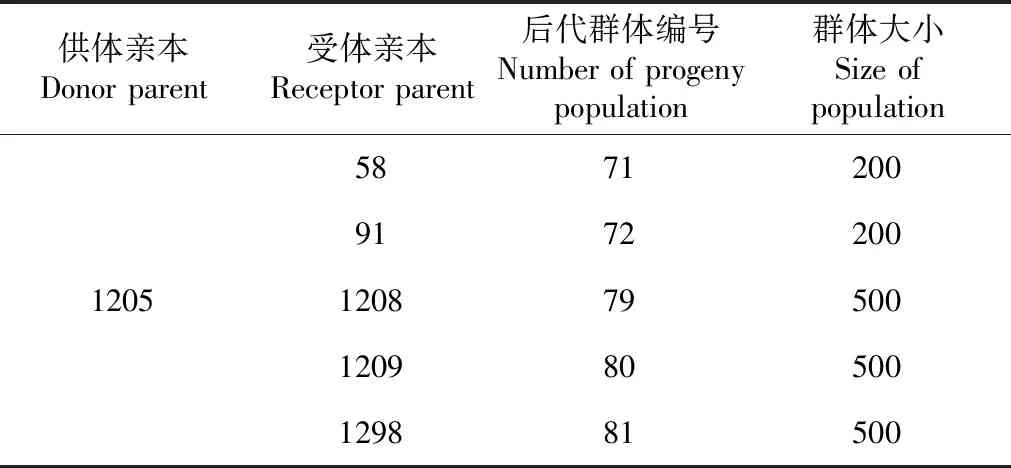
表1 供试材料Table 1 Tested material
1 材料与方法
1.1 供试材料
供试材料包括供体亲本“1205”,受体材料“58”、“91”、“1208”、“1209”、“1298”,以及供体亲本分别与受体亲本杂交、回交后衍生的5个后代群体71、72、79、80、81(表1)。供体材料“1205”是广西农业科学院水稻所选育的携带广谱稻瘟病抗性基因Pi9,且经过田间抗性调查明确具有抗稻瘟病的品系。受体亲本“58”、“91”、“1208”、“1209”、“1298”是由广西农业科学院水稻研究所选育的,且经田间抗性调查明确不抗稻瘟病的品系。
1.2 水稻叶片DNA提取
于2018年11月18日采集水稻幼苗期叶片,利用CTAB法快速提取基因组总DNA,使用1 %琼脂糖凝胶电泳检测DNA的完整性。采用Thermo Fisher的Nanodrop 2000 分光光度计进行DNA 浓度测定,将DNA 浓度调整到50 ng/μl。
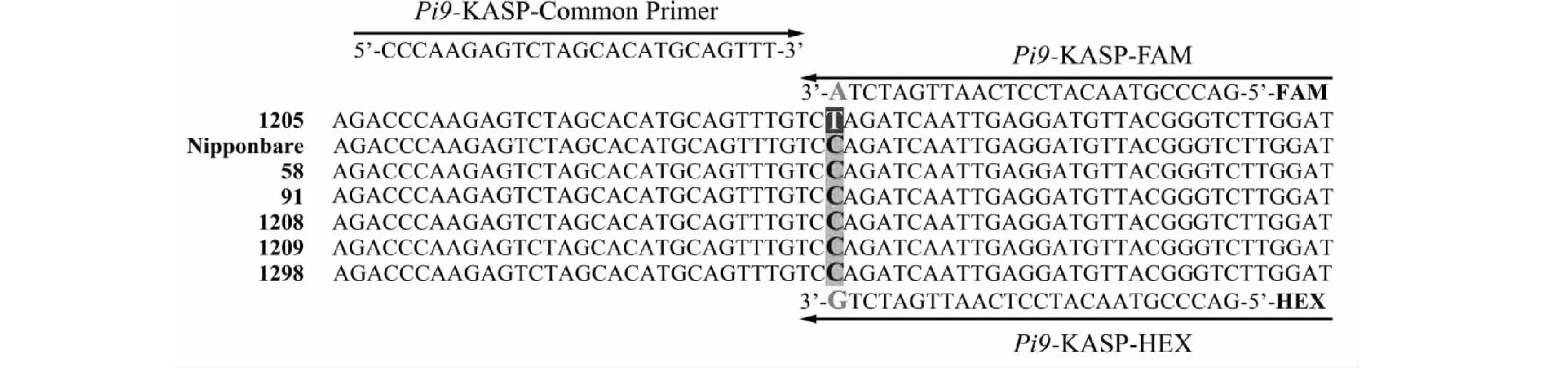
Pi9-KASP分子标记引物的设计,其中重点突出部分为Pi9在各个株系中的SNP位点Primer design of Pi9-KASP molecular marker, the highlight of which is the SNP site of Pi9 in each strain图1 Pi9基因中用于开发标记的SNP位点及其引物设计Fig.1 SNP locus for the development of markers in the Pi9 gene and its primer design

表2 标记引物序列Table 2 Sequence information of marker primers
1.3 KASP分子标记的开发与利用
通过PCR克隆并测序分析,比对供体亲本与受体亲本之间的Pi9基因序列,获得Pi9基因编码区特异性SNP突变位点(图1),根据互补链SNP位点前后各60 bp的碱基序列设计了KASP分子标记引物Pi9-KASP,包括1条正向通用引物和2条反向特异性引物(表2)。2条反向引物分别对应FAM 和HEX 2 种荧光信号,FAM标签序列为GAAGGTGACCAAGTTCATGCT,HEX标签序列为GAAGGTCGGAGTCAACGGATT。Pi9-KASP 引物的设计和合成由LGC公司完成。
将提取的DNA稀释5 ng/μl,分别加入96孔板中,配制反应体系进行PCR扩增反应。每个孔的PCR反应体系总体积为10.14 μl,包括2×KASP Master mix 5 μl,KASP Primer mix 0.14 μl,模板DNA 5 μl。在ABI 7500 real-time PCR system上的PCR反应程序为:94 ℃预变性15 min;94 ℃变性20 s;61~55 ℃退火延伸60 s,10个循环(每个循环降低0.6 ℃);94 ℃变性20 s;55 ℃退火延伸60 s,26个循环。反应结束后,根据检测的2种荧光信号来判断样本分型情况,根据不同的荧光信号获得不同的基因型(表3)。根据序列比较结果分析,预测PCR反应后,Pi9基因扩增一定可以检测到FAM荧光信号,其他无Pi9基因的子代材料的等位基因扩增可以检测到HEX荧光信号,从而将Pi9在抗性品种的基因型与感病品种的基因型区分开。
1.4 SSR分析
PCR 反应总体积为15 μl,其中DNA 模板2 μl,2×TaqPCR Master Mix 6 μl,10 nmol/L的正反向引物各0.5 μl,加ddH2O补足15 μl。稻瘟病抗性基因Pi9的特异性标记M-Pi9的引物序列为:5’-GCTGTGCTCCAAATGAGGAT-3’, 5’-GCGATCTCACATC CTTTGCT-3’。
M-Pi9的PCR反应程序为:94 ℃预变性5 min 后进行35个循环扩增,循环条件为94 ℃变性40 s,58 ℃退火40 s,72 ℃延伸45 s,循环结束后再72 ℃延伸5 min,反应结束后体系于4 ℃保存,M-Pi9的PCR扩增产物中加入核酸染料,用浓度为2 %的琼脂糖凝胶进行电泳分离,于凝胶成像系统中拍照并记录结果。阳性纯合结果记为“+”,阴性纯合结果记为“-”,杂合记为“3”。

表3 等位基因及其对应荧光标记Table 3 Corresponding relation of alleles and fluorescence marker
1.5 稻瘟病自然诱发抗性鉴定
自然诱发病圃设在稻瘟病多发区岑溪梨木镇高围村,面积约为0.7 hm2。病圃常年处于高温、高湿的气候环境中,具有利于发病的地理环境条件,历年稻瘟病发生严重。病圃全生育期不喷杀菌剂,杀虫剂的使用量根据病圃虫害发生的程度而定。于2018年7月20日将5个分离群体种植于病圃,以桂井1号为感病对照。在成熟期,以桂井1号充分发病为准,对供试材料进行穗颈瘟调查。每个群体至少调查100株。田间的栽培管理、调查方法、病级划分、记载标准和抗性评价按颜群等[30]的水稻品种试验抗性鉴定方法与标准执行。抗性类型:抗(抗性指数≤2.0),中抗(2.1~4),中感(4.1~6),感(6.1~7.5),高感(7.6~9)。
2 结果与分析
2.1 利用 Pi9-KASP分子标记对子代群体Pi9基因进行检测
利用设计的Pi9-KASP标记对杂交群体中278个单株进行基因分型,结果发现141个单株的基因型为T/T,137个单株的基因型为C/C(图2,表4)。
2.2 利用SSR标记对子代群体Pi9基因进行检测
以受体材料58的回交改良过程为例。在杂交后代选择含Pi9抗性基因、农艺性状优良的单株进行回交,利用Pi9基因内的SSR标记M-Pi9对杂交子代群体进行检测。在BC1F1群体中,共检测了20个单株,其中有9个单株含Pi9杂合基因,部分检测结果见图2,其中1、2、3、4、5为含目标基因的杂合体。分子标记辅助筛选含Pi9抗性基因单株,经过回交2次,自交2次,获得BC2F3。2018年晚季大区种植BC2F4,在BC2F4群体中检测子代群体的SSR标记基因型,与Pi9-KASP分子标记的检测结果比对,结果显示Pi9-KASP分子标记分型结果与SSR分子标记检测结果一致(表4)。
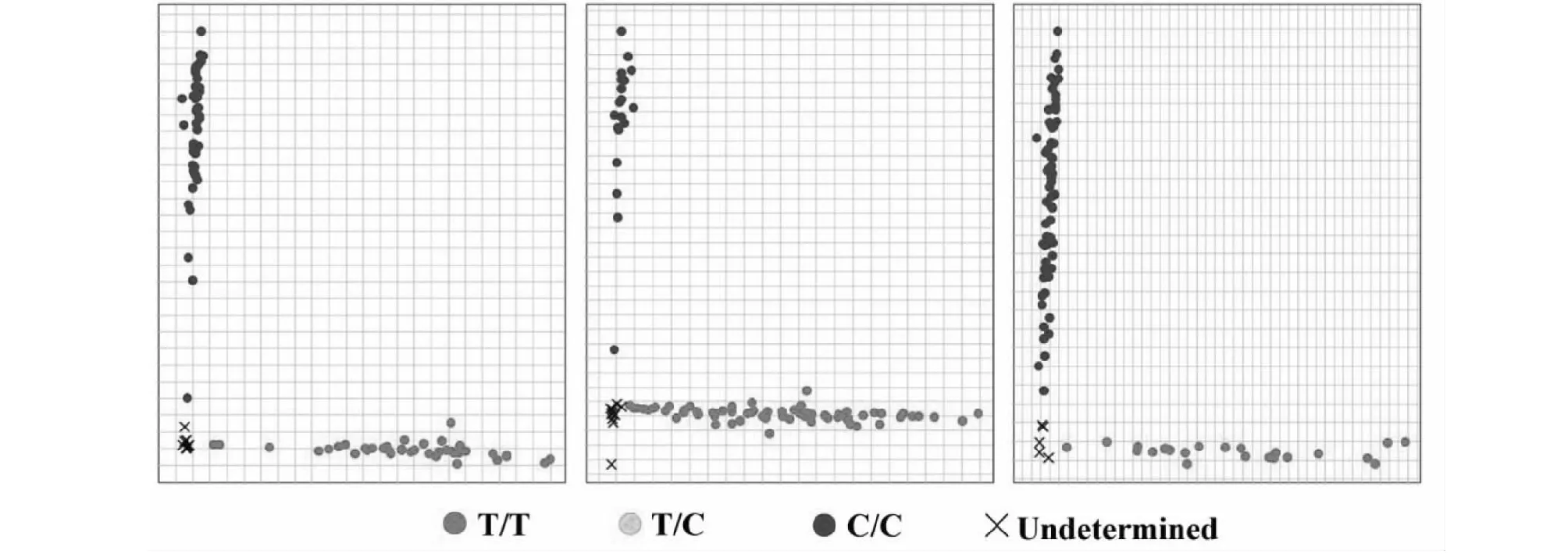
利用Pi9-KASP对供体亲本“1205”,受体亲本“58”、“91”、“1208”、“1209”、“1298”,以及其杂交衍生群体Pi9等位基因的分型;图中每个圆点对应一个样品;蓝点表示该样品基因型为C/C,具有HEX标签序列;红点表示该样品基因型为T/T,具有FAM标签序列;×为空白对照(NTC)以及未检出的样品。以供体亲本“1205”、受体亲本(“58”、“91”、“1208”、“1209”、“1298”),以及供体亲本和受体亲本的混合DNA作为阳性对照Genotyping of the donor parent ‘1205’, receptor parents ‘58’, ‘91’, ‘1208’, ‘1209’, ‘1298’ and their hybrid progeny population by Pi9-KASP; Each dot in the figure corresponds to a sample; The blue dot indicates that the sample genotype is C/C and has a HEX tag sequence; The red dot indicates that the sample genotype is T/T, and has a FAM tag sequence; ×represents NTC (Non-Template-control) and undetected samples. The DNA of the donor parent ‘1205’, the receptor parents (‘58’, ‘91’, ‘1208’, ‘1209’, ‘1298’), and the mixed DNA of the donor parent and the receptor parents were used as positive controls图2 利用Pi9-KASP分子标记对5个亲本及衍生群体278个单株的基因分型检测结果Fig.2 Genotyping result of 5 rice germplasm and 278 individual plants of the derived population by using Pi9-KASP
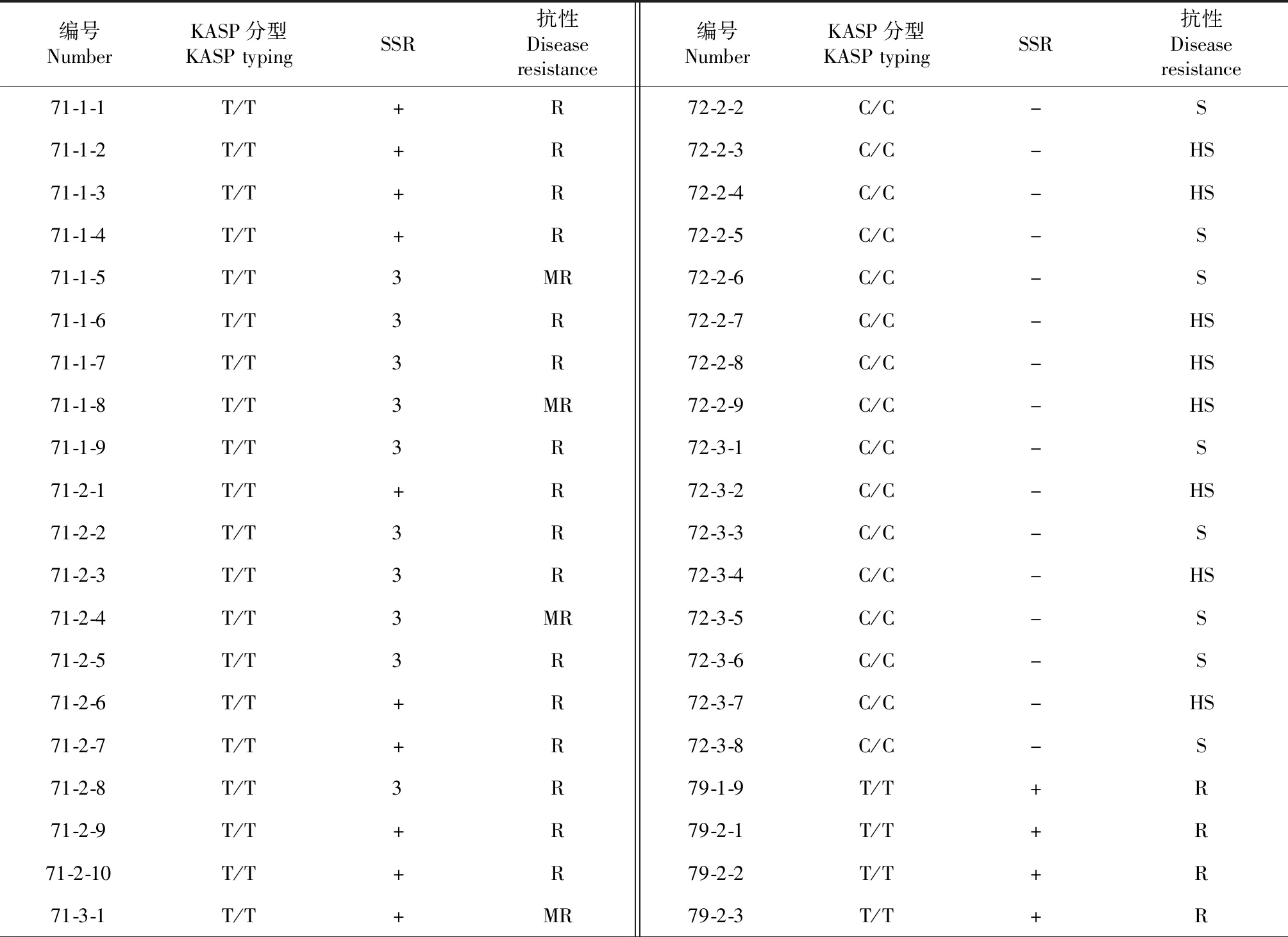
表4 部分材料稻瘟病抗性及KASP分型、SSR标记检测结果Table 4 Resistance of some materials against blast resistant and test results with KASP typing and SSR molecular markers
续表4 Continued table 4
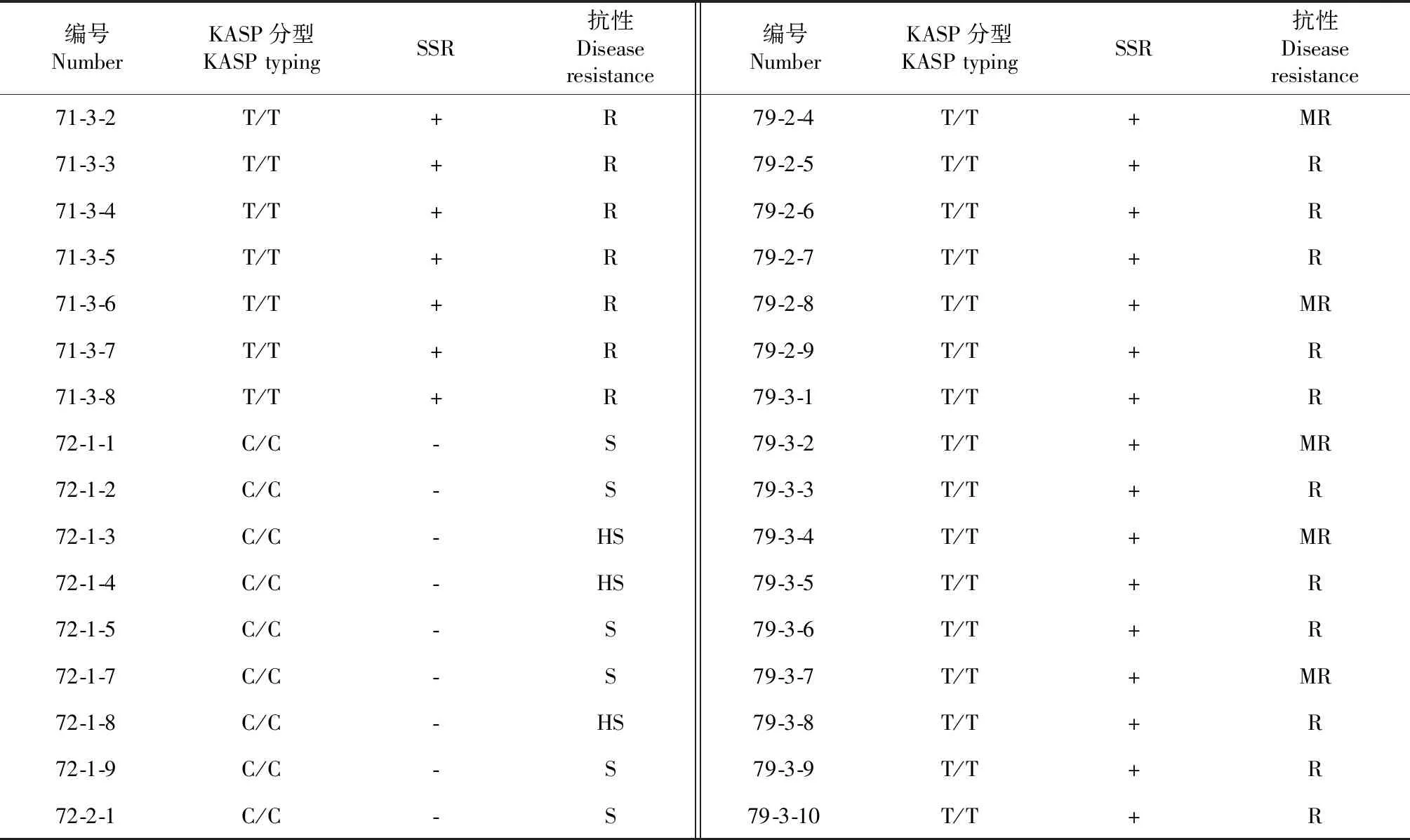
编号NumberKASP分型KASPtypingSSR抗性Diseaseresistance编号NumberKASP分型KASPtypingSSR抗性Diseaseresistance71-3-2T/T+R79-2-4T/T+MR71-3-3T/T+R79-2-5T/T+R71-3-4T/T+R79-2-6T/T+R71-3-5T/T+R79-2-7T/T+R71-3-6T/T+R79-2-8T/T+MR71-3-7T/T+R79-2-9T/T+R71-3-8T/T+R79-3-1T/T+R72-1-1C/C-S79-3-2T/T+MR72-1-2C/C-S79-3-3T/T+R72-1-3C/C-HS79-3-4T/T+MR72-1-4C/C-HS79-3-5T/T+R72-1-5C/C-S79-3-6T/T+R72-1-7C/C-S79-3-7T/T+MR72-1-8C/C-HS79-3-8T/T+R72-1-9C/C-S79-3-9T/T+R72-2-1C/C-S79-3-10T/T+R
2.3 子代群体对稻瘟病的抗性表现
在岑溪稻瘟病鉴定点,2018年晚季感病对照桂井1号的穗瘟发病率均达100 %,病级达到7~9级,说明病圃发病条件充足,鉴定结果较可靠。对5个分离群体穗颈瘟的调查结果表明,含有Pi9基因的株系抗性基本都表现为抗(R)~中抗(MR)以上,抗级1~4级,平均为2.9级;不含Pi9基因的株系抗性均表现为感(S)~高感(HS),抗级为6~9级,平均抗级为7.9,抗性鉴定结果与Pi9-KASP分子标记分型结果及SSR分子标记检测结果比较一致(表4)。
3 讨 论
长期以来育种家们主要利用杂交、回交等常规育种技术结合人工接种或者自然感病的方式筛选新的抗性品种。然而,传统方法的鉴定结果往往受到环境或人为因素的影响,而且稻瘟病菌的生理小种极易发生变异,导致了抗稻瘟病品种选育的难度大大增加,降低了抗病品种选育效率。利用分子标记辅助选择技术可以在群体的早世代时进行稻瘟病抗性基因的检测,提高育种效率及可靠性,加快育种进程。前人研究结果表明,当分子标记与目的基因的遗传距离小于5 cM时,选择到含有目的基因的准确率可达99.75 %[31]。Pi9基因已成功被部分育种研究者用于改良杂交水稻的稻瘟病抗性,如聂元元等[32]
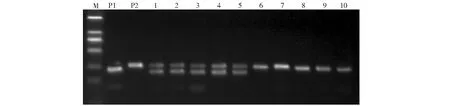
M:分子量标准;P1:供体亲本1205;P2:受体亲本58;1~10:BC1F1单株M: DNA Marker;P1:Donor parent 1205; P2: Receptor parent 58;1-10: BC1F1 population图3 引物M-Pi9对子代群体的单株筛选Fig.3 Screening of BC1F1 by primer M-Pi9
利用分子标记辅助选择方法,将抗稻瘟病基因Pi1、Pi2和Pi9成功导入到三系杂交稻恢复系“R225”中,其中含有1个或2个抗性基因的目标株系的稻瘟病抗性均达到中抗水平以上;孙永建等[32]利用含Pi9基因的“C2”供体亲本,通过常规育种及分子辅助选择手段,获得13个农艺性状优良且抗性较好的改良新抗稻瘟病材料。
普通的Pi9分子标记主要依赖于琼脂糖电泳或PAGE 胶电泳分析,试验费时费力,而本研究利用KASP方法建立的Pi9荧光分子标记不需要进行电泳分析,3个96 孔板即可完成对本研究278份样品的检测,省时省力。本研究结果表明,该KASP标记能快速准确地检测出水稻中Pi9基因对应的荧光标记,基因分型结果与SSR分子标记检测结果一致,基因型与抗性表型也比较一致,可放心用于分子标记辅助选择育种中。鉴于KASP标记检测技术具有稳定性好、准确性高、检测成本较低和高通量等优点,借助KASP标记,可以对大批量的样品进行精准的双等位基因分型,达到高通量进行目标基因验证和检测的效果。
本研究中,利用KASP标记和SSR标记两种方法对72群体的单株进行检测,发现所有单株均不含有Pi9基因,其抗性也表现为感或高感,这可能是由于该群体在之前选育过程中没有用分子标记跟踪抗性基因而导致其丢失。因此,在选育过程中,在材料群体的早世代特别是分离世代,利用分子标记跟踪目标基因,可以避免盲目性,提高育种效率及可靠性。
另外,在本研究中,含有Pi9基因的株系抗性基本都表现为抗(R)-中抗(MR)以上,不含Pi9基因的株系抗性均表现为感(S)或高感(HS),这表明利用Pi9基因改造水稻稻瘟病抗性效果比较好。但由于自然界稻瘟病菌生理小种极易发生变异,导致水稻在不同环境下抗性不稳定,因此,通过分子标记方法将多个抗稻瘟病基因聚合到同一水稻品种中,是培育广谱、持久抗稻瘟病品种的有效途径。
4 结 论
KASP 标记检测技术能够快速、可靠地对水稻中抗稻瘟病基因Pi9进行基因分型检测,分型效率高。本研究开发的Pi9-KASP 标记为利用Pi9基因进行高效、可靠的分子标记辅助选择育种打下了坚实的基础。
