诱导化疗对局部晚期鼻咽癌调强放疗靶区勾画及剂量分布的影响
2019-07-17张钦华利锦燕邹雨荷丁小凡
张钦华 ,利锦燕,邹雨荷,丁小凡
(江门市中心医院肿瘤科, 广东 江门 529000)
鼻咽癌是我国广东最常见的头颈部恶性肿瘤,70%患者确诊时已属局部晚期[1,2]。在IMRT时代,初治鼻咽癌局控率得到显著提高[2,3],但是远处转移率仍高达15%~25%,远处转移成为鼻咽癌治疗失败的主要模式[4],提示IMRT时代仍同样需要联合强度化学治疗。诱导化疗联合调强放疗是目前鼻咽癌综合治疗的研究热点[5-7]。诱导化疗的应用可明显减小放疗前肿瘤体积[8-11],诱导化疗后靶区如何勾画是目前亟待解决问题。尽管有共识[12]支持按诱导化疗后设计放疗计划,但靶区勾画建议仍按诱导化疗前勾画GTV,其缺乏循证医学依据。国内的相关研究也不尽相同[13-15]。为此我们开展了诱导化疗对局部晚期鼻咽癌调强放疗靶区勾画及剂量学分布影响的探讨。
1 材料与方法
1.1 一般资料
2017年3月至2017年12月期间选择12例于广东省江门市中心医院收治的病理确诊为 WHO Ⅱ或Ⅲ 型,临床分期为Ⅲ-Ⅳb期(2010 AJCC分期标准)初治鼻咽癌患者。患者一般资料详见表1。
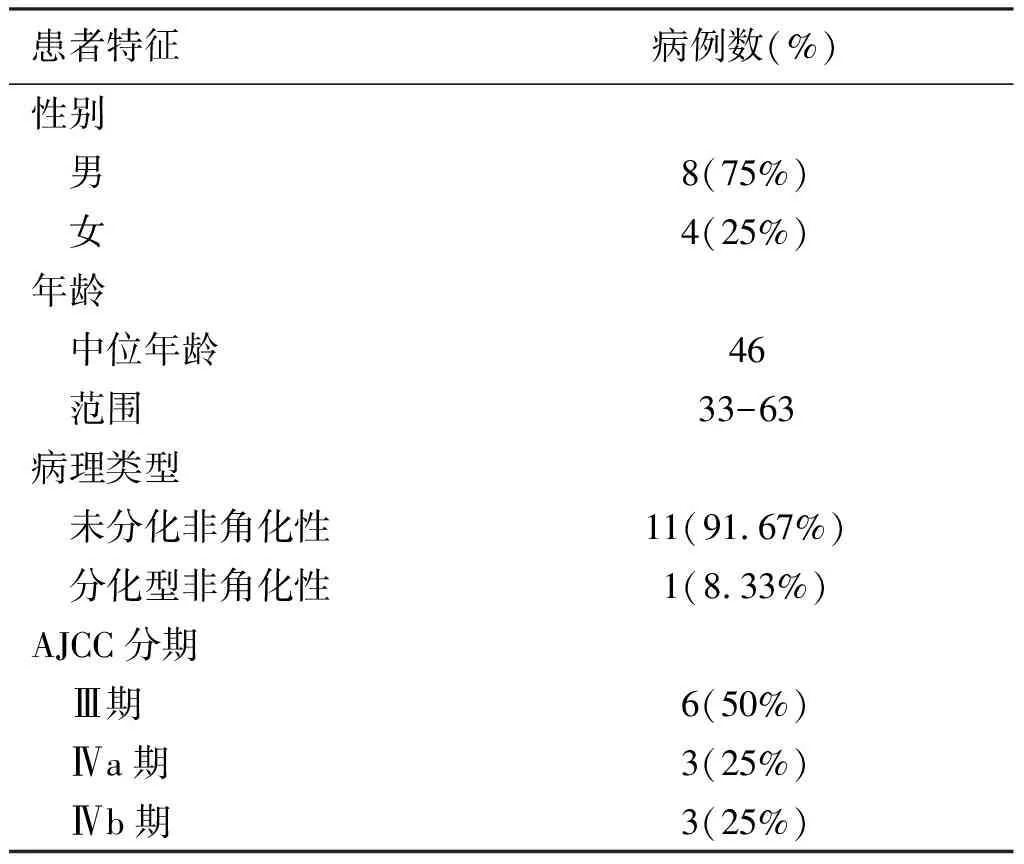
表1 病例特征
1.2 方法
1.2.1诱导化疗 采用DN方案(多西他赛75 mg/m2,第1天;奈达铂80 mg/m2,第1天),每3周为1周期,2程化疗后评估疗效为CR、PR、SD则继续行第3周期化疗,3周期诱导化疗后3周再予调强放射治疗。若为PD则直接行同步放化疗。3.IMRT放疗:
1.2.2体位固定及重复CT扫描 采用头颈肩面膜加真空袋和头颈肩架固定装置,扫描范围:从额窦上缘至锁骨下2 cm,层厚3 mm,层距3 mm,CT图像通过网络系统传至VARIAN Eclipse调强计划系统。在同一面膜及固定装置下分别于诱导化疗前、3周期诱导化疗后2周行两套CT定位扫描,分别为CT-1、CT-2,每次CT扫描同首次CT摆位条件,参考中心一致。
1.2.3靶区及危及器官勾画 根据ICRU第83号报告原则及国内专家共识[16]勾画靶区,参照MRI,在增强CT上分别鼻咽原发肿瘤区(GTVnx)、颈部转移淋巴结(GTVnd)、临床靶区1(CTV1)、临床靶区2(CTV2)和计划靶区(PTV),以及周围危及器官(OAR),诱导化疗后GTVnx按化疗后实际退缩情况的影像勾画,但颅底破坏范围按化疗前的病灶影像勾画;GTVnd包膜无受侵者,按化疗后实际退缩情况的影像勾画;包膜受侵者,按化疗后的影像勾画,同时还应包括化疗前影像显示的外侵区域。
1.2.4处方剂量及计划设计 所有患者采用同步推量照射技术,给予PGTVnx、PGTVnd、PTV1、PTV2的总处方剂量分别为68Gy、64-66 Gy、60Gy、54Gy,分割次数30次,5次/每周,处方剂量的定义为95%的PTV所接受的最低吸收剂量,且 PTV接受≥110%的处方剂量的体积应<20%,PTV接受≤93%的处方剂量的体积<1%,且PTV外不能出现>110%的处方剂量。危及器官的剂量限制参照RTOG 0615的标准或根据实际情况进行调整。采用7野或9野设计的共面逆向治疗计划,通过比较剂量体积直方图 (dose volume histograms,DVH)来评价治疗计划的优劣。
1.2.5图像及计划融合 按照CT-1、CT-2制定放疗计划 Plan-1,Plan-2,临床治疗实施按照 Plan-2执行。 将CT-1与CT-2于VARIAN Eclipse下以骨性标记进行CT-CT 交互信息配准。将诱导化疗前计划 Plan-1 映射到CT-2上获得新的融合计划Plan-2′,该融合计划 Plan-2′反映出按照诱导化疗前计划在诱导化疗后图像CT-2中靶区和危及器官的实际剂量分布,利用系统自动生成的容积初步比较融合计划Plan-2′和诱导化疗后重新制定计划Plan-2的体积及放疗剂量变化,进而探讨诱导化疗前后肿瘤靶区及周围重要组织解剖形态、受照剂量变化规律。
1.2.6临床疗效和不良反应 临床疗效评价采用实体瘤治疗疗效评价标准(RECISTl.1),不良反应标准根据常见不良反应第三版(CTCAE v3.0)评价分级。
1.3 统计学方法
使用SPSS 19.0软件进行统计,两组计划间评价指标的比较用配对t检验。双侧检验,检验水准α=0.05。
2 结 果
2.1 临床疗效
入组患者均按计划完成3周期的诱导化疗,2程诱导化疗后复查评估鼻咽病灶有效率(CR+PR)为66.67%(8/12),颈部淋巴结有效率(CR+PR)为83.33%(10/12),治疗结束3月评估鼻咽病灶有效率为100%(12/12),颈部淋巴结有效率为100%(12/12)。截至2018年4月,全组随访率100%,中位随访时间15个月(11-22月),均无瘤生存。
2.2 肿瘤体积变化
3疗程诱导化疗后GTVnx体积由78.48 cm3缩小到56.32 cm3(p=0.01) 缩小了近l/3;GTVnd体积由25.45 cm3缩小到10.30 cm3(p=0.005) 缩小了49% 。由于本研究颅底骨质勾画仍按照诱导化疗前颅底破坏范围勾画,不包括颅底GTVnx缩下了近1/2。详见表2。
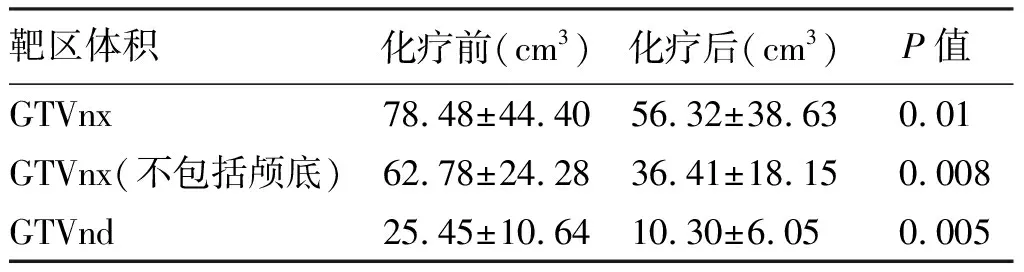
表2 诱导化疗后肿瘤体积变化
2.3 剂量学变化
2.3.1靶区剂量学变化 实际执行计划Plan-2,对比融合计划Plan-2′,PTVnx和PTV1的V95、V93升高;PTVnd和PTV2的D95、V100、V95、V93升高,PTVnd、PTV1、PTV2的V110下降,PTVnx、PTVnd和PTV2的适形性提高,PTV1和PTV2的均匀性提高,检验结果具有统计学差异(P<0.05),详见表 3。
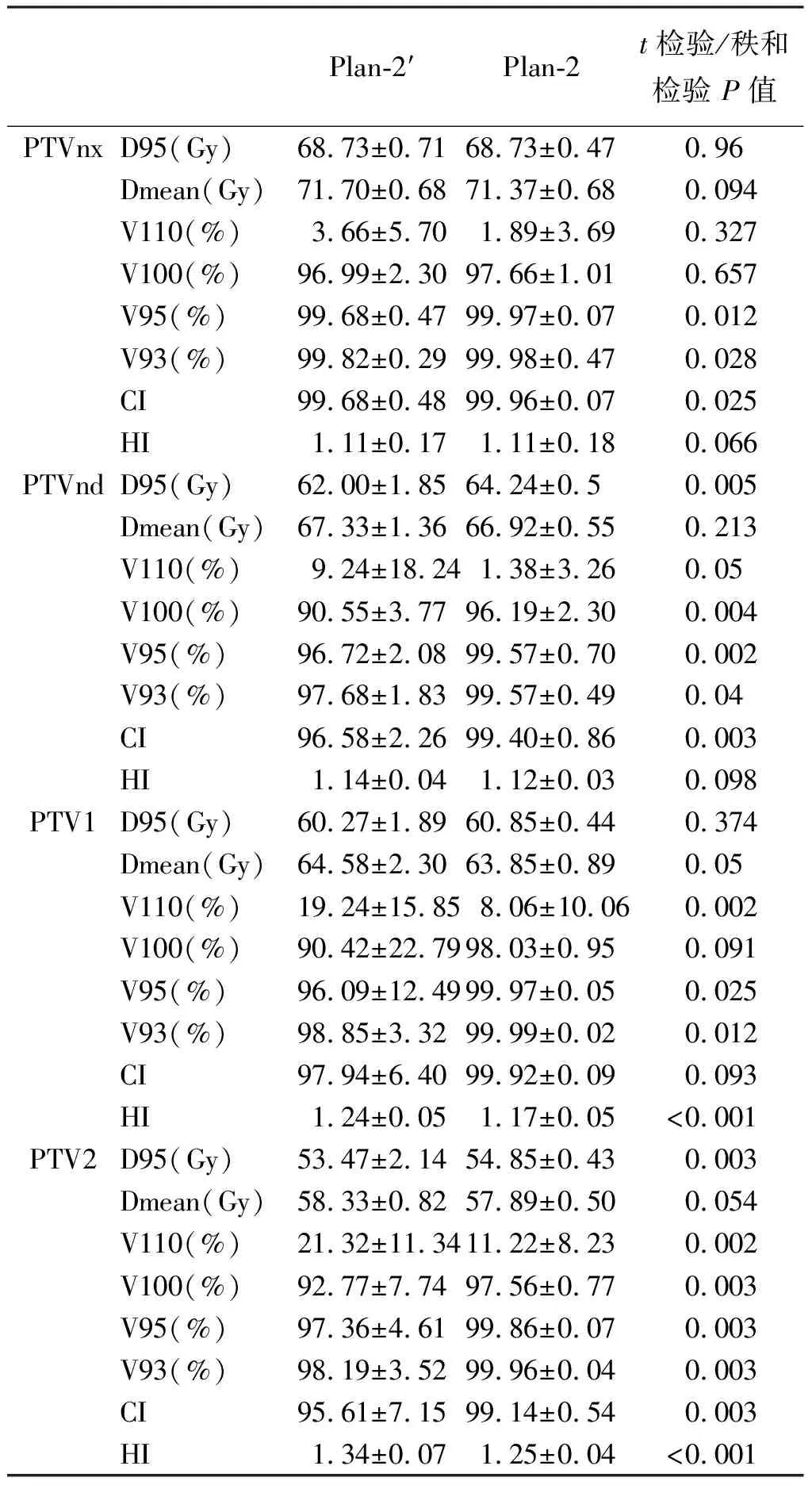
表3 诱导化疗前后Plan-2’与Plan-2靶区剂量学变化
注:公式(3-1)CI=V95/Vptv*100%(V95:处方剂量的95%等剂量面所包围的受照体积;Vptv:靶区体积),CI值为0-1,越接近于1表示适形性越好。公式(3-2)HI=D2-D98/D50,HI越接近1表示均匀性越好。
2.3.2正常组织器官的剂量学变化 对比融合计划Plan-2′,结果显示诱导化疗后Plan-2脊髓Dmax从43.13±3.95Gy下降至40.62±1.64Gy,右侧腮腺Dmean从30.23±1.94Gy下降到29.44±1.45Gy,右侧V30Gy从41.05%下降至36%,右侧眼球Dmax从34.59±6.23Gy下降至32.68±4.36Gy,右侧下颌骨Dmax从67.44±4.4Gy下降至66.08±4.15Gy,喉Dmean从45.35±1.39Gy下降至44.13±0.93Gy,本研究12个患者中有7个原发灶中心偏右(以体中线为基准),详见表4。
亚组分析与原发灶中心同侧和对侧剂量学变化,发现诱导化疗后同侧腮腺Dmean、V30Gy,同侧眼球Dmax、同侧下颌骨Dmax均较Plan-2’下降。检验结果具有统计学差异(P<0.05),详见表5。
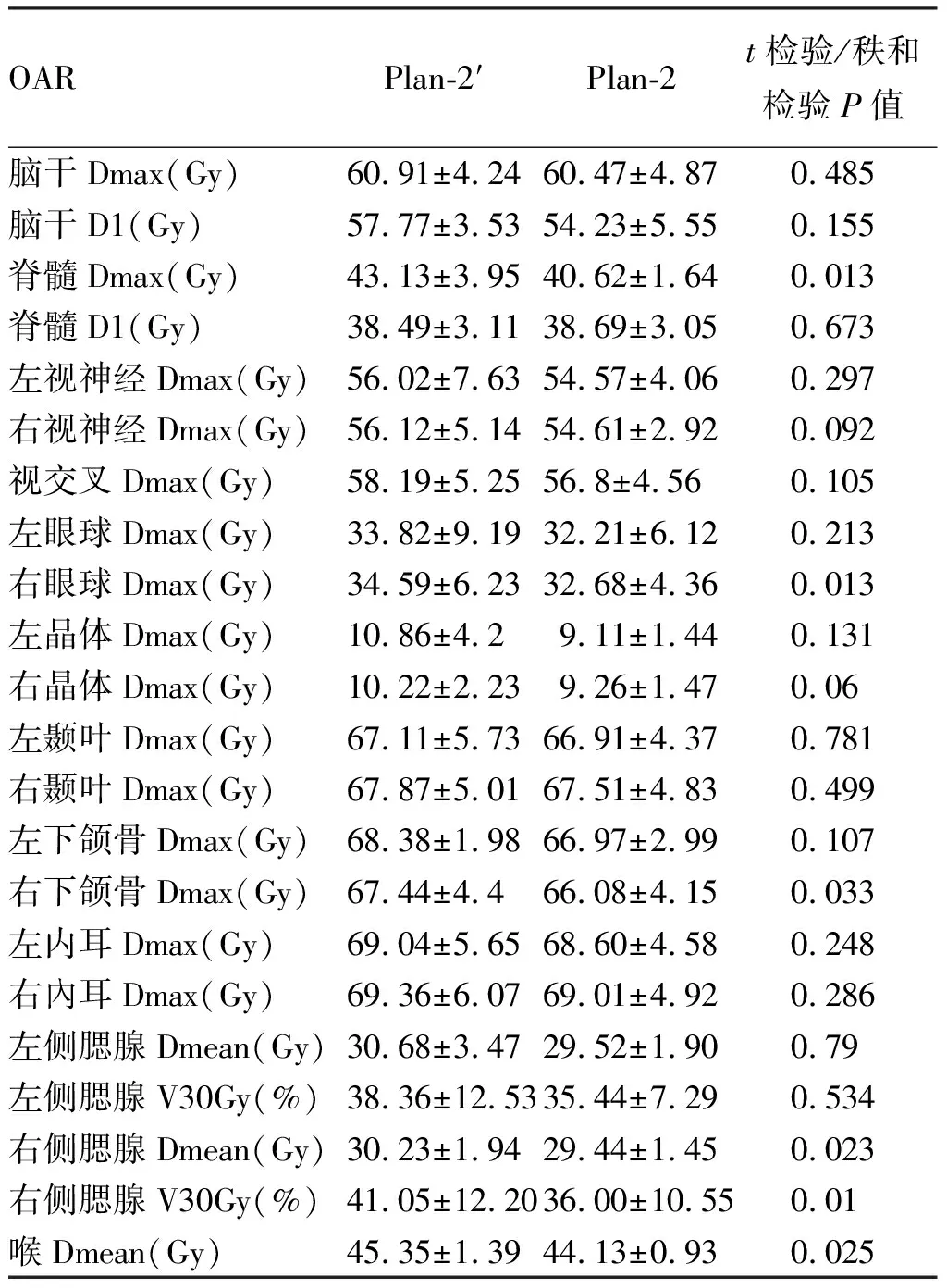
表4 诱导化疗前后Plan-2’与Plan-2 OAR剂量学变化

表5 诱导化疗前后同侧与对侧OAR剂量学变化
注3):同侧定义为与原发灶中心同侧,反之为对侧。
2.4 诱导化疗不良反应
所有患者均可评价急性不良反应,常见不良反应为骨髓抑制,严重3-4级骨髓抑制仅占8.33%(1/12),经粒细胞集落刺激因子治疗后恢复正常;在非血液学毒性方面主要为胃肠道反应,均为1-2级反应,详见表6。

表6 12例患者诱导化疗期间急性不良反应
3 讨 论
诱导化疗联合调强放疗是目前鼻咽癌综合治疗的研究热点[5-7]。诱导化疗后肿瘤靶区体积缩小明显,本研究诱导化疗后鼻咽原发灶GTVnx缩小了27.86%,颈部淋巴结GTVnd缩小了50.11%。考虑颅底骨血供差,血药浓度相对较低,且骨质破坏缩小呈筛状退缩[17],本研究诱导化疗后颅底骨质勾画按照诱导化疗前颅底破坏范围勾画,这影响GTVnx体积评估,如果不包括颅底评估鼻咽原发灶缩小了41.66%,与文献报道相似[11,14]。
在计划评估中发现,本研究诱导化疗后PTVnd和PTV2 D95升高, PTVnx、PTVnd和PTV2的适形性提高,PTV1和PTV2的均匀性改善,这表明诱导化疗后再计划可提高靶区剂量覆盖,靶区平均剂量得到提高,同时靶区内剂量分布梯度亦能得到一定程度降低,使剂量分布更均匀,与文献报道相似[11,14];危及器官脊髓Dmax、右侧腮腺Dmean、V30Gy,右侧下颌骨及右侧眼球Dmax均较化疗前下降,进一步亚组分析发现诱导化疗后与原发灶中心同侧的腮腺、下颌骨、眼球受照剂量下降,可能由于诱导化疗后肿瘤体积缩小,靶区与周围正常组织的相对位置发生变化,等剂量曲线向心性内移,靶区高剂量区相对减少。
本研究诱导化疗的不良反应与既往研究报道的结果相似,主要为血液学毒性,白细胞和中性粒细胞减少,但是经G-CSF处理后中性粒细胞很快恢复,其他非血液学毒性多为1-2级反应,未出现因诱导化疗不良反应而出现延迟和中断治疗情况。
本研究治疗结束3个月评估患者鼻咽病灶和颈部淋巴结完全缓解率达100%,经中位15个月的随访,全组患者局部区域控制率100%.提示按诱导化疗后按缩小的肿瘤勾画GTV具有一定可行性,临床观察显示不会造成局部区域控制率下降。
综上所述,DN方案诱导化疗后肿瘤体积明显缩小,与按化疗前大体肿瘤勾画GTV相比,按诱导化疗后缩小的肿瘤勾画GTV,能提高靶区剂量覆盖,降低正常组织尤其同侧危及器官受量,改善靶区的适形性及剂量均匀性分布。由于本研究治疗的病例数较少以及随访时间尚短。因此有待增大样本量及延长随访时间来进一步证实本研究的治疗模式及靶区勾画方式的合理性。诱导化疗的应用减小了放疗开始肿瘤体积,从而相对减少放疗过程中的解剖学改变,进而减少放疗中实际剂量分布与计划剂量分布的差异,但是否从而减少调强期间自适性放疗的再计划的制定,也尚需进一步研究证实。
