中华绒螯蟹金属硫蛋白基因在A549细胞中的表达及鉴定
2019-07-17邓小亮钟秋珍付欣洪玮谭茵马文康
邓小亮,钟秋珍,付欣,洪玮,谭茵,马文康
(广州医科大学生命科学学院,广东 广州 511436)
金属硫蛋白( metallothionein,MT) 是一类广泛存在于动物、植物和微生物体内的低分子量、富含半胱氨酸的蛋白质[1],由哈佛大学的Margoshes等[2]于1957年首次从马肾中分离得到并命名。MT具有多种重要的生理功能,其作用之一是能结合Cd、Cu、Zn等多种金属离子[3],通过结合/释放重金属离子,调节机体必需重金属的稳态及对有害重金属进行解毒,并起氧化应激防护作用。MT又受重金属离子的诱导表达,当环境中的某些重金属离子浓度升高时候,MT表达量随之一定范围内增加。蟹类生活在水体的基底层,当水体被重金属污染时首当其冲, MT可能是其抵抗重金属毒性的重要生理机制之一,但关于蟹类MT 的研究较为少见。因此,深入研究蟹类MT的功能对于物种保护、重金属污染防治及药物开发等方面具有重大意义。本实验将中华绒螯蟹MT基因的编码序列克隆至真核表达载体pEGFP-C1上,转染A549细胞,融合表达绿色荧光蛋白GFP和MT,获得的MT蛋白为进一步深入研究其结构和功能打下了基础。
1 材料与方法
1.1 材料
1.1.1载体与细胞 含有中华绒螯蟹MT基因编码序列的质粒PET15b-MT由本实验室前期构建保存,真核表达载体pEGFP-C1 (clontech),A549细胞,大肠杆菌感受态DH5α皆由本实验室保存。PMD-19T(simple)载体购自大连宝生物有限公司。
1.1.2主要试剂 质粒提取、核酸凝胶回收试剂盒购自上海生工。DL2000,DL15000 DNA Marker,rTaq PCR试剂盒,连接酶solutionⅠ购自大连宝生物有限公司。限制性内切酶EcoRⅠ、BamHⅠ购自北京NEB有限公司。DMEN培养液、小牛血清购自Gibco;脂质体Lipofectamine 2000、蛋白marker购自thermo Fisher。ECL显色试剂盒(Beyotime),小鼠来源一抗anti-GFP(santa Cruz),HRP标记的兔抗小鼠二抗(abcam),兔源anti- a tubulin 一抗(abcam),HRP标记的羊抗兔二抗(abcam)
1.2 方法
1.2.1构建表达载体 根据NCBI上公布的中华绒螯蟹MT序列(登录号AY057396.1)设计MT基因特异性引物,利用质粒PET15b-MT作为模板,rTaq酶做PCR反应扩增得到MT基因编码序列。采用真核表达载体pEGFP-C1的原有阅读框,选择多克隆位点处的EcoRⅠ、BamHⅠ两个酶切位点插入MT基因的编码序列,使得MT基因和GFP基因融合表达。基于上述方法要求,设计引物时在上游引物MT f和下游引物MT r 5’端分别加入了EcoRⅠ、BamHⅠ酶切位点和保护碱基。引物序列分别为MT f:CCGGAATTCCATGCCTGACCCTTGCTGTAACG;MT r:CGCGGATCCTTACTAGGGGCAGCAGGAGCAAGGC
按照说明书配置50微升PCR反应体系,反应条件为94 ℃预变性3 min,98 ℃变性10 s,50℃退火30 s,72 ℃延伸40 s,30个循环,72 ℃10 min,4 ℃保藏。 PCR产物进行1.2%琼脂糖凝胶电泳鉴定(电压120伏,20 min),若有符合大小的目标条带,则用胶回收试剂盒割胶回收,定量。回收后的PCR产物做EcoRⅠ、BamHⅠ双酶切2 h,载体pEGFP-C1也做同样处理。酶切完成后对pEGFP-C1进行1.2%琼脂糖凝胶电泳鉴定并割胶回收,定量。将酶切后的PCR产物和pEGFP-C1按照连接酶试剂说明书混合,加入连接酶solution Ⅰ,16 ℃连接2 h。转化大肠杆菌感受态DH5α,涂布含有氨苄青霉素的LB平板,37 ℃培养过夜。挑选单克隆菌落做PCR,阳性者接种于LB培养液(加入氨苄青霉素)震荡培养过夜,提质粒,做双酶切鉴定。双酶切阳性者再送样到生工生物工程(上海)有限公司测序鉴定,测序正确的质粒命名为pEGFP-MT。
1.2.2pEGFP-MT转染A549细胞 转染前一天,将细胞种植于24孔细胞培养板中,用不添加抗生素的DMEN培养液于细胞培养箱中培养细胞,至细胞密度为70-80%时(一般24 h后)开始转染实验。同时做空载体转染和细胞纯培养对照。取出细胞孔板,弃培养液,用D-hanks液洗涤2次,加入0.5 mL无血清DMEN培养液,待用。 制备待转染质粒PE-GFP与脂质体混合物如下(下列数据均为每孔加入量):A液:用一无菌离心管并标记,吸取50 μL无血清DMEM培养液,加入0.8μg的pEGFP-MT质粒至管中,轻轻混匀。B液:用一无菌离心管并标记,吸取50 μL无血清DMEM培养液,加入2 μL脂质体Lipofectamine 2000至管中,轻轻混匀,室温放置5 min孵育。将A、B液轻轻混匀,室温放置20 min孵育。将混合物加入待转染细胞中,前后左右轻轻震荡培养板充分混匀,放于37 ℃的CO2培养箱培养。6 h后换成含10%小牛血清的DMEM培养液继续培养。
1.2.3荧光观察及Western Blot鉴定 转染24 h后,荧光显微镜下观察绿色荧光,以检测转染及表达效率。观察到细胞绿色荧光较强后,PBS洗涤细胞3次,加入适量去离子水,用细胞刮刮下细胞,反复冻融法裂解细胞,12 000 r/min,离心5 min,收集上清,即为细胞表达产物粗提液样品。取16微升样品加入4微升的5X蛋白上样缓冲液,沸水浴10 min,冷却上样,进行12%聚丙烯酰胺凝胶电泳(浓缩胶电压90v,分离胶电压120v)。电泳结束后将蛋白转到PVDF膜上,5%脱脂奶粉封闭2 h,加入小鼠来源的一抗(anti-GFP,1∶5000),于4 ℃孵育过夜。洗涤后加入山羊抗小鼠的二抗(1∶5000)孵育1小时,用ECL显色试剂盒显色曝光。内参选用α-Tubulin(一抗二抗都是1∶5000稀释)。
2 结 果
2.1 MT基因的PCR扩增
PCR扩增产物凝胶电泳结果(图1)显示,获得了符合分子大小的基因片段(177bp),特异性良好,初步显示MT基因PCR扩增成功。
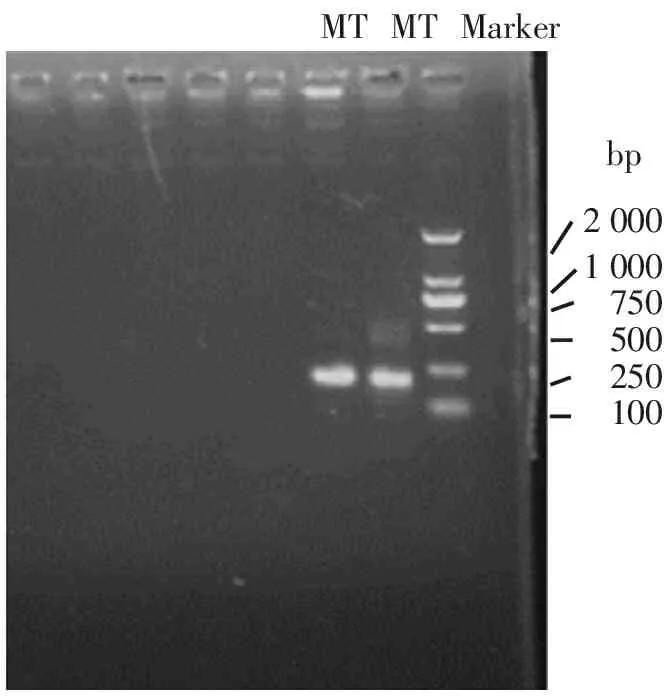
20001000750500250100bpMTMarkerMT
MT: PCR扩增MT产物;Marker:DL2000 DNA marker
图1 MT基因PCR扩增
2.2 菌落PCR及双酶切鉴定
pEGFP-MT重组质粒菌落PCR(见图2)及经EcoRⅠ、BamHⅠ双酶切凝胶电泳结果(见图3)显示,获得了符合MT分子大小的特异性目标条带(177bp),初步表明重组成功。
2.3 重组质粒的测序结果
测序结果(见图4)经序列比对分析表明与NCBI上发表中华绒螯蟹MT序列一致,同源性达到100%,证明载体构建成功。翻译成氨基酸序列见图5。
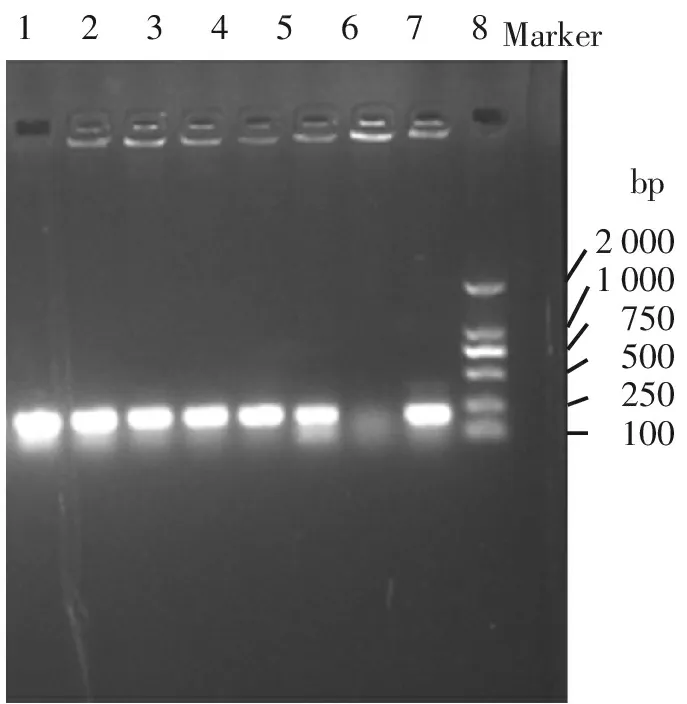
12345678Marker20001000750500250100bp
1-8:挑选的8个菌落样品;Marker:DL2000 DNA marker
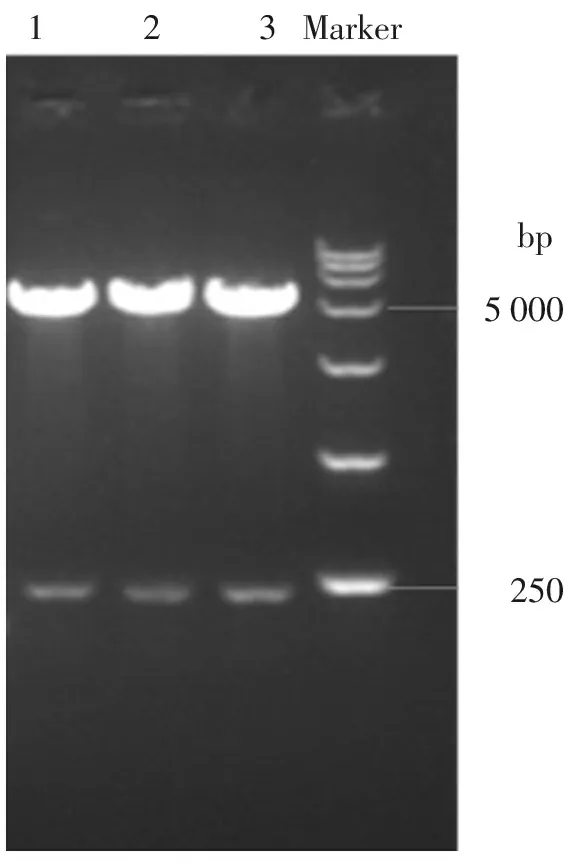
图2 pEGFP-MT菌落PCR
1-3:来自3个菌落样品的质粒;Marker: DL15000 DNA marker
图3 重组质粒双酶切鉴定
2.4 pEGFP-MT质粒转染A549细胞后的荧光观察
转染重组质粒pEGFP-MT 24小时后,A549细胞在荧光显微镜下观察到绿色荧光,细胞形态清晰可见。证明转染成功,MT融合GFP表达良好。(见图 6)
2.5 MT蛋白的Western Blot鉴定
Western Blot结果(见图7)显示,来自GFP-MT样品和空载体GFP样品在预期分子量大小(分别为34.3KD和26.9KD)位置出现了特异性条带,A549细胞纯培养作为阴性对照无条带,3个样品的内参α-tubulin条带良好,符合理论预期,证明MT融合GFP基因成功表达。
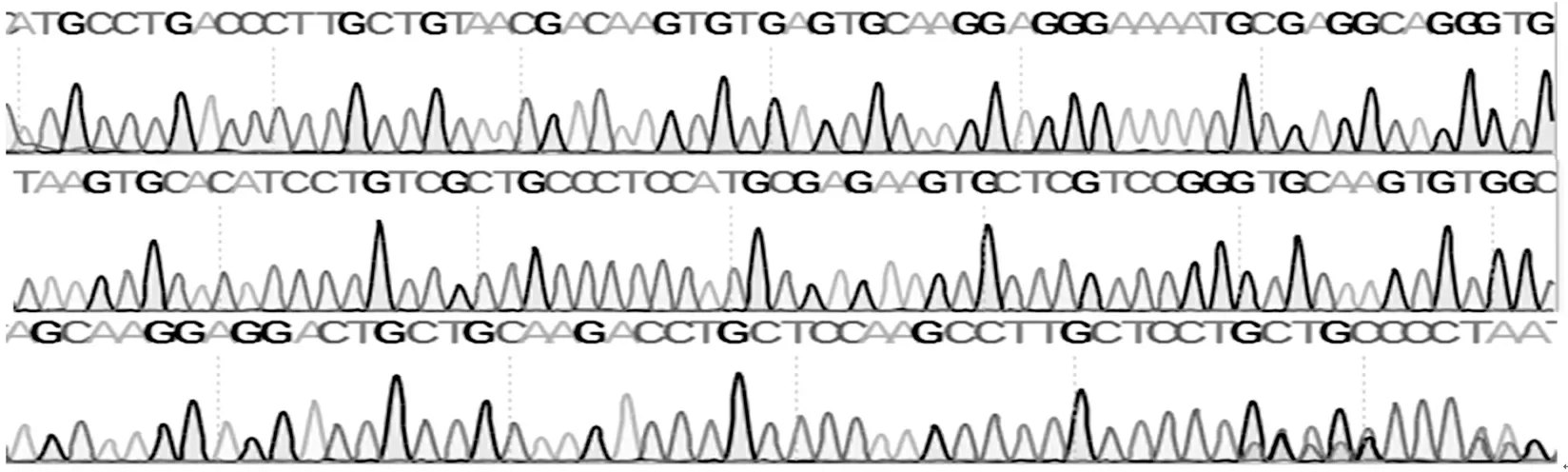
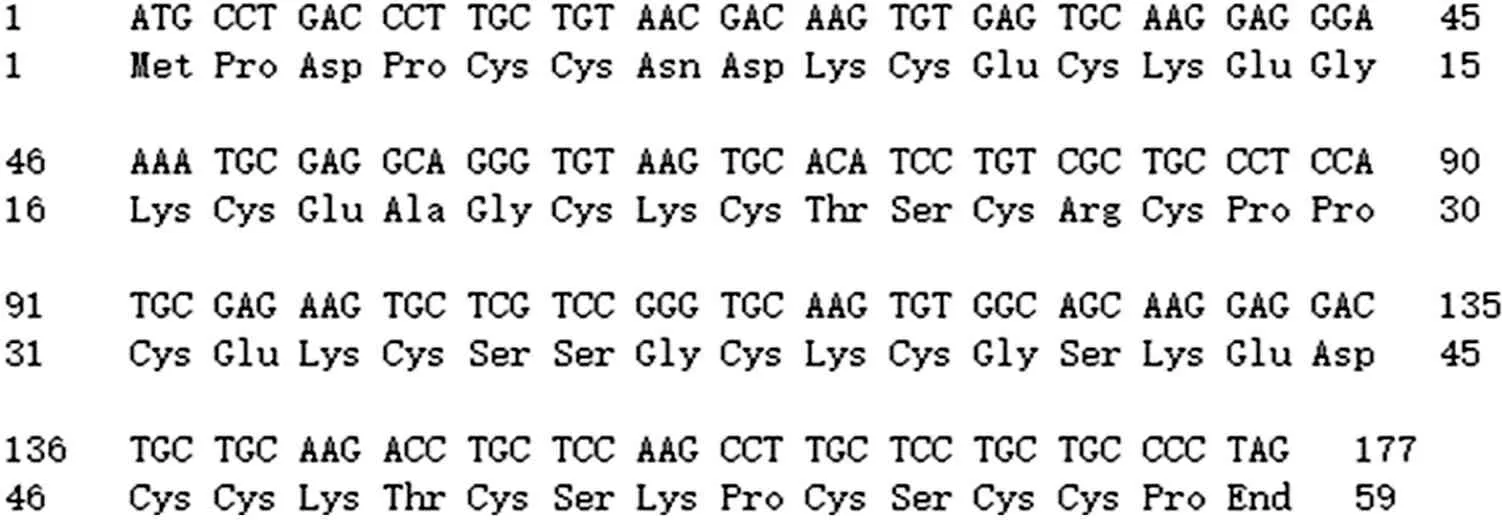
图4 重组MT质粒测序结果
MT氨基酸序列
图5 MT编码及氨基酸序列
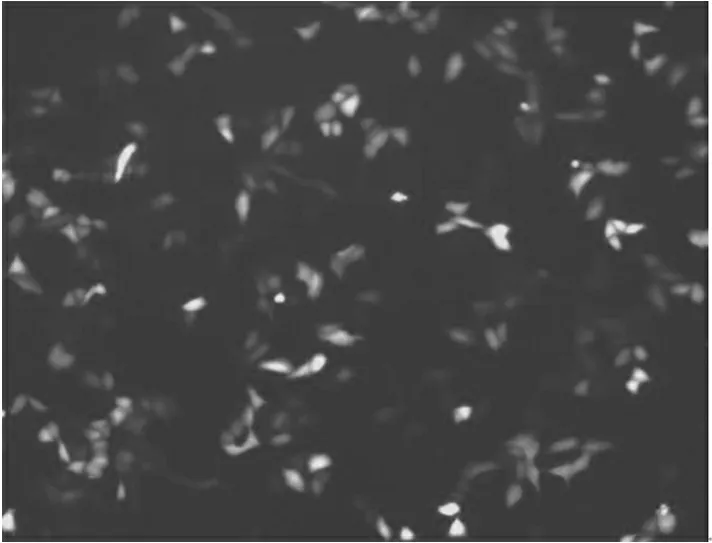
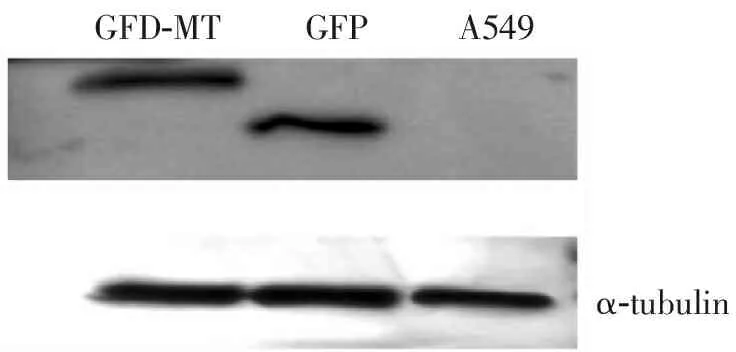
图6 细胞绿色荧光观察(100×)
A549:未转染质粒的细胞纯培养裂解样品;GFP:转染空载体pEGFP-C1的细胞裂解样品;GFP-MT:转染重组质粒pEGFP-MT的细胞裂解样品
图7 Western Blot结果
3 讨 论
金属硫蛋白(MT)具有许多重要的生理功能,主要有胞内金属代谢、储存和向其它需金属蛋白(主要指锌指蛋白和酶)提供金属离子。MT与锌铜离子可逆结合,含锌MT具有热力学稳定性和动力学不稳定性,能将锌传递给其它需金属蛋白,通过结合和释放金属离子维持生物体内金属离子的代谢平衡。MT还具有重金属解毒、抗氧化、防紫外及参与免疫反应等作用。大量研究表明MT对重金属、氧化试剂、自由基等诱导的凋亡性死亡及非凋亡性死亡具有明显的抑制作用。MT和疾病特别是肿瘤的关系成为研究热点,MT参与肿瘤细胞凋亡、增殖、肿瘤血管形成[4-7];引起化疗耐药,影响治疗和预后[8]。
大量研究揭示了MT作为生物解毒剂具有广阔的发展空间。MT能结合镉、铅等重金属,且具有较高的结合常数,镉离子能取代锌MT中的锌,形成Cd-MT,重金属离子被MT结合后对生物体的毒性降低[9],这一特性可用于重金属离子的生物解毒。Azar Shahpiri等做了利用大肠杆菌表达MT吸收砷元素而进行生物解毒的研究[10,11]。Aliya Suleman等进行了MT重组表达对镉元素的吸收研究[12]。Shahpiri等研究了重组MT对汞的吸收[13-16]。R Krishnaswamy等研究了MT对镍的吸收[17]。
中华绒螯蟹是一种经济价值较高的蟹类,关于其MT的研究报道较少,仅有的相关研究主要集中在大肠杆菌原核表达MT[18-20],构建真核表达系统获得MT尚未见文献报道。原核表达蛋白容易造成蛋白折叠错误,缺乏糖基化修饰,易形成包涵体导致蛋白活性丧失等缺点。相对于原核表达系统,真核表达系统在蛋白质分子的折叠、糖基化修饰等方面更有优势,表达的蛋白更接近于天然构象,能最大化保证蛋白的活性。本次实验我们以中华绒螯蟹为研究材料,利用真核表达载体pEGFP-C1构建了中华绒螯蟹MT基因融合绿色荧光蛋白(GFP)基因的重组表达质粒,转染至A549细胞。A549细胞是人非小细胞肺癌细胞,具有转染效率高,增殖迅速,易培养等特点,因此作为本实验的表达宿主细胞。通过荧光观察和进一步的Western Blot实验,证实了MT基因在A549细胞中成功表达,获得了融合GFP的MT。由真核表达系统表达得到的MT能够最大化的保持其天然结构和活性修饰,为进一步研究中华绒螯蟹MT的结构和功能打下了基础。
