山茱萸叶多糖的理化性质和抗氧化活性
2019-07-17李玥彤郝晓伟李小强刘文娟
李玥彤,隋 怡,郝晓伟,李小强,刘文娟,曹 蔚,3
(1 西北农林科技大学 化学与药学院,陕西 杨凌 712100;2 第四军医大学 药学系,陕西 西安 710032;3 国家中医药管理局 中药胃肠药理重点研究室,陕西 西安 710032)
中药山茱萸是山茱萸科落叶小乔木山茱萸(Fructuscorni)的干燥成熟果肉,俗名山萸肉、药枣、肉枣等。山茱萸药用记载首见于《神农本草经》,是我国常用的传统药材,应用十分广泛。传统医学认为,其味酸涩,性微温,归肝肾两经,具有补益肝肾、涩精固脱之功效[1]。现代研究发现,山茱萸具有降血糖、抗氧化、抗菌和抗炎等多种药理作用[2]。近年来,对山茱萸化学成分及其药理作用已有不少报道,其中对环烯醚萜类和有机酸类的研究较为深入[3],但对其多糖类化学成分的研究报道较少,特别是对山茱萸叶多糖更是少有关注。随着糖生物化学的发展,多糖独特的生物活性和较低毒副作用使其具有较大的药物开发潜力,人们逐渐认识到多糖及其复合物在生命活动中的重要作用。
本研究以山茱萸干燥叶为原料,通过水提醇沉法、过氧化氢除色素等步骤,得到山茱萸叶多糖(PFC);采用比色法对其多糖、糖醛酸等含量进行分析,并用由Honda等[4-5]建立的1-苯基-3-甲基-5-吡唑啉酮(PMP)柱前衍生化高效液相色谱法(HPLC)分析其单糖组成;测定PFC对1,1-二苯基-2-三硝基苯肼自由基(DPPH·)、羟自由基(·OH)的清除能力以及亚铁离子络合能力;并以H2O2诱导的人肝癌HepG2细胞为氧化损伤模型,测定不同质量浓度PFC对细胞氧化损伤的保护作用和对细胞内丙二醛(MDA)、活性氧(ROS)的影响,以期为山茱萸资源的开发利用提供依据。
1 材料与方法
1.1 材 料
1.1.1 植物材料 山茱萸叶于2016年10月采自陕西省周至县境内,经西北农林科技大学化学与药学院段琦梅副教授鉴定为山茱萸(Fructuscorni)的叶。
1.1.2 仪 器 DZTW型调温电热套(上海科恒实业发展有限公司),RE-52AA旋转蒸发仪(上海亚荣生化仪器厂),SHZ-D-Ⅲ循环水式多用真空泵(河南省豫华仪器有限公司),Dionex UltiMate 3000液相色谱仪(美国戴安公司),TDZ5-WS型离心机(湖南湘仪实验室仪器开发有限公司),AX224ZH/E电子分析天平(奥豪斯仪器有限公司),FD5-series冻干机(金西盟仪器有限公司),UV-2600紫外分光光度计(天美科学仪器有限公司),FE28-Standard酸度计(瑞士梅特勒-托利多集团),Bio-Tek多功能酶标仪(美国伯腾仪器有限公司),超纯水系统(美国Millipore公司)。
1.1.3 试 剂 人肝癌细胞株HepG2为西北农林科技大学化学与药学院陕西省天然产物化学生物学重点实验室传代保存株。葡萄糖、甘露糖、葡萄糖醛酸、咔唑(国药集团化学试剂有限公司),鼠李糖、半乳糖、半乳糖醛酸、阿拉伯糖、岩藻糖、1,1-二苯基-2-三硝基苯肼(DPPH)、2′,7′-二氢二氯荧光黄双乙酸钠(DCFH-DA)、四甲基偶氮唑蓝(MTT)(Sigma-aldrich公司),甲醇、乙腈(色谱纯,Sigma-aldrich公司),四氢呋喃(色谱纯,天津市科密欧化学试剂有限公司),丙二醛(MDA)检测试剂盒、蛋白质检测(考马斯亮蓝法)测试盒购自碧云天生物技术研究所。其他试剂均为国产分析纯。
1.2 山茱萸叶多糖(PFC)的制备
取山茱萸干燥叶500 g,用3 L体积分数90%乙醇回流脱脂3次,每次2 h;脱脂后的药材挥干乙醇,用3倍体积的水回流提取3次,每次2 h[6-7]。用纱布过滤,合并上清液,减压浓缩后于4 ℃冰箱中保存备用。取所得浓缩上清液,搅拌过程中缓慢加入上清液2倍体积的无水乙醇,4 ℃放置过夜,3 000 r/min离心10 min,收集沉淀。加入适量的蒸馏水溶解沉淀,反复冻融8次,离心收集上清液,再用Sevag法[8]除蛋白,将上清液浓缩至浸膏。按样品质量体积比1∶1.5加入体积分数30% H2O2去除色素(80 ℃,3 h)[9]。浓缩至小体积后用蒸馏水透析48 h,透析液减压浓缩、冷冻干燥后得PFC 6.797 g,置于干燥器中保存。
1.3 PFC理化性质的测定
总糖含量采用苯酚-硫酸法[10]测定,糖醛酸含量采用硫酸-咔唑法[11]测定,可溶性蛋白质含量采用考马斯亮蓝G250染色法[12]测定,硫酸根含量采用氯化钡-明胶比浊法[13]测定。分别以半乳糖、半乳糖醛酸、牛血清白蛋白和硫酸根的质量浓度为横坐标X,吸光度为纵坐标Y,绘制标准曲线,计算回归方程。以上测定重复3次。
1.4 PFC单糖组成的测定
1.4.1 1-苯基-3-甲基-5-吡唑啉酮(PMP)衍生物的制备 称取甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖和岩藻糖各5 mg,置于8个试管中,加入去离子水0.5 mL溶解。然后分别取400 μL置于8个具塞离心管中,先后加入0.3 mol/L NaOH 200 μL和0.5 mol/L PMP甲醇溶液400 μL,充分振荡,于70 ℃水浴30 min。取出冷却至室温,加入0.3 mol/L HCl中和。再依次加入2 mL去离子水和4 mL氯仿,涡旋萃取,离心分层,用注射器吸弃下层有机层,上层水相重复萃取2次[14],得标准单糖PMP衍生物。根据参考文献[15]的方法制备PFC全水解产物,吸取400 μL,再用上述方法制备PFC全水解产物的PMP衍生物。
1.4.2 色谱条件 色谱柱:AccliamTM120 C18分析柱(4.6 mm×250 mm,5 μm);流动相:100 mmol/L 乙酸铵水溶液(pH=5.0)/四氢呋喃/乙腈,三者体积比为79∶2∶19[16-17];流速:1.0 mL/min;检测波长:250 nm;进样体积:10 μL;柱温:25 ℃。
1.5 PFC的体外抗氧化活性评价
1.5.1 样品制备 取1.2节中所得PFC 0.4 g溶于10 mL去离子水中,充分溶解,用去离子水稀释至质量浓度分别为0.1,0.2,0.4,0.6,0.8,1.0,1.2 mg/mL;同时配制相同质量浓度的维生素C(VC)或乙二胺四乙酸(EDTA)水溶液作为阳性对照。
1.5.2 PFC对自由基的清除活性 (1)清除DPPH·活性。参考Li等[18]和Ren等[19]的方法,分别取4.5 mL不同质量浓度PFC溶液和VC阳性对照溶液加入试管,再取1.5 mL DPPH乙醇溶液(1.0×10-4mol/L)加入试管,混匀,室温避光静置30 min。用无水乙醇做参比,在517 nm处测定吸光度(OD1);取1.5 mL DPPH乙醇溶液和4.5 mL去离子水加入试管,混匀,在517 nm处测定吸光度(OD0);计算DPPH·清除率。采用Origin 8.5计算清除50% DPPH·时化合物的浓度(IC50),重复3次。
(2)清除·OH活性。分别取0.2 mL不同质量浓度PFC溶液和VC阳性对照溶液加入试管,加入1.2 mL含2.67 mmol/L 2-脱氧核糖和0.13 mmol/L EDTA的PBS(10 mmol/L,pH 7.4)溶液,根据Lai等[20]的方法,在532 nm处测量吸光度(OD1);以去离子水为空白,测定吸光度(OD0);计算·OH清除率,重复3次。
清除率(络合率)=[(OD0-OD1)/OD0]×100%。
式中:OD0为空白组值,OD1为试验组值。
1.5.3 亚铁离子络合活性 参考文献[21]的方法,分别取1.0 mL不同质量浓度PFC溶液和EDTA阳性对照溶液加入试管,依次加入0.1 mL FeCl2(2 mmol/L)溶液和0.2 mL菲洛嗪(5 mmol/L)溶液,混匀后于25 ℃反应10 min,在562 nm处测定吸光度(OD1);另取去离子水做空白,在562 nm处测定吸光度(OD0);计算亚铁离子络合活性,重复3次。
1.6 PFC对H2O2诱导氧化损伤细胞的影响
1.6.1 细胞培养 HepG2细胞在含体积分数10%胎牛血清、1×105U/L青霉素与链霉素的DMEM高糖培养基中,于37 ℃、体积分数5% CO2的细胞培养箱中培养,当细胞生长至80%时融合传代。
1.6.2 PFC对HepG2细胞活力的影响 采用MTT法[22]对HepG2细胞的活力进行测定,选对数生长期的HepG2细胞,以每孔100 μL(5×103个细胞)接种于96孔板,培养24 h后,再加入用DMEM培养液溶解的PFC溶液(终质量浓度为0.025,0.05,0.1,0.2,0.4,0.8 mg/mL),每处理设6个复孔,继续培养24 h。对照组以培养液代替PFC溶液。培养结束后,每孔加入10 μL 0.5 mg/mL MTT培养4 h,吸弃培养液,再加入150 μL DMSO充分溶解,用酶标仪在490 nm处测定吸光度,计算细胞相对存活率。
细胞相对存活率=[OD1/OD]×100%。
式中:OD0为对照组值;OD1为试验组值。
1.6.3 PFC对H2O2诱导的HepG2细胞活力的影响 选择对数生长期HepG2细胞,接种于96孔板中。培养24 h后,对照组不加PFC和H2O2溶液;模型组不加PFC溶液,继续培养24 h,加入终浓度为400 μmol/L H2O2后再培养4 h[23];试验组加入1.6.2节所制不同质量浓度PFC溶液,继续培养24 h,400 μmol/L H2O2处理后再培养4 h。每处理设6个复孔,培养结束后,每孔加入MTT再培养4 h,吸弃培养液后加入DMSO溶解,490 nm处测定吸光度,计算细胞相对存活率。
1.6.4 PFC对细胞内氧化水平的影响 取对数生长期的HepG2细胞,以每孔2 mL(2×106个细胞)接种于6孔板内。培养24 h后,对照组不加PFC和H2O2溶液;模型组不加PFC溶液,继续培养24 h,加入终浓度为400 μmol/L的H2O2后再培养4 h[23];试验组加入用培养液溶解的PFC溶液(终质量浓度为0.2,0.4,0.8 mg/mL),继续培养24 h,400 μmol/L H2O2处理后再培养4 h。每处理设4个复孔。
(1)丙二醛(MDA)水平检测。用PBS清洗HepG2细胞后,冰浴、超声破碎,1 600 r/min离心10 min,取上清液按照MDA检测试剂盒说明书操作。
(2)活性氧(ROS)水平检测。加入DCFH-DA(终浓度为50 μmol/L),30 min后用PBS清洗HepG2细胞,在激发波长为485 nm、发射波长为530 nm的荧光酶标仪中检测荧光强度值。
1.7 数据处理与分析
数据以“平均值±标准误”表示。先行正态性检验和方差齐性检验,若符合正态分布则组间采用t检验分析,若不符合正态分布则采用非参数检验,P<0.05代表统计学上有显著差异,P<0.01代表统计学上有极显著差异。
2 结果与分析
2.1 PFC的理化性质
比色法测定结果(表1)显示,PFC含总糖(612.76±1.72) mg/g,糖醛酸(228.03±0.54) mg/g,可溶性蛋白质(9.53±0.38) mg/g和硫酸根(25.21±0.19) mg/g。

表1 山茱萸叶多糖(PFC)的理化性质Table 1 The physicochemical properties of the polysacharide from the leaves of Fructus corni
注:X分别为半乳糖、半乳糖醛酸、牛血清白蛋白和硫酸根的质量浓度,Y为吸光度。
Notes:Xrepresentsthemassconcentrationofgalactose,galacturonicacid,bovineserumalbuminandsulfateradical,respectively;Yrepresentsabsorbance.
2.2 PFC单糖组成
甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、岩藻糖等8种标准单糖的HPLC色谱图及PFC的单糖组成色谱图见图1。

A.8种标准单糖;B.山茱萸叶多糖全水解产物1.甘露糖;2.鼠李糖;3.葡萄糖醛酸;4.半乳糖醛酸;5.葡萄糖;6.半乳糖;7.阿拉伯糖;8.岩藻糖A.8 standard monosaccharides;B.Total hydrolyzate of PFC;1.Man;2.Rah;3.GlcA;4.GalA;5.Glc;6.Gal;7.Ara;8.Fuc图1 山茱萸叶多糖单糖组成的HPLC色谱图Fig.1 HPLC chromatogram of polysaccharide from Fructus corni leaves
由图1-A可见,8个标准单糖均达到基线分离。由图1-B可见,水解后的PFC分离效果良好,PMP峰未掩盖单糖峰。以保留时间对PFC的单糖组成进行定位,其单糖组成为甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖和岩藻糖。采用标准曲线法进行定量,计算出甘露糖/鼠李糖/半乳糖醛酸/葡萄糖/半乳糖/阿拉伯糖/岩藻糖的物质的量比为1.6∶3.2∶6.2∶5.0∶13.0∶14.1∶1.0。
2.3 PFC的体外抗氧化活性
2.3.1 对自由基的清除活性 (1)DPPH·的清除活性。DPPH·是一种稳定的自由基,对它的猝灭能力可以有效地反映抗氧化剂的活性[24]。试验结果(图2)表明,PFC对DPPH·的清除作用显著,并呈现剂量依赖性,随着PFC溶液质量浓度的增加,清除率逐渐增大,IC50为0.13mg/mL;VC对DPPH·的清除能力亦呈剂量依赖性,IC50为0.15mg/mL。可见PFC对DPPH·的清除能力与VC相当,PFC质量浓度为0.2mg/mL时,对DPPH·的清除率达到60%以上,可见PFC清除DPPH·的能力显著。
(2)·OH的清除活性。·OH是一种活性氧自由基,可在细胞内与蛋白质、脂类、DNA等各种生物大分子发生反应,过量的自由基会诱导机体发生氧化损伤[24]。试验结果(图2)表明,PFC具有显著地清除·OH的作用,随着PFC溶液质量浓度的增加,清除率呈现逐渐增大趋势,IC50为0.56mg/mL,低于VC(IC50为0.76mg/mL),说明PFC清除·OH的能力强于VC。
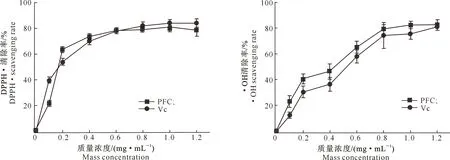
图2 山茱萸叶多糖对自由基的清除活性Fig.2 Free radical scavenging activities of PFC
2.3.2 亚铁离子的络合活性EDTA作为小分子物质与金属离子有很强的络合能力,而多糖上的羟基可作为配体与金属离子(如Fe2+、Cu2+等)络合。山茱萸叶多糖的Fe2+络合活性见图3。
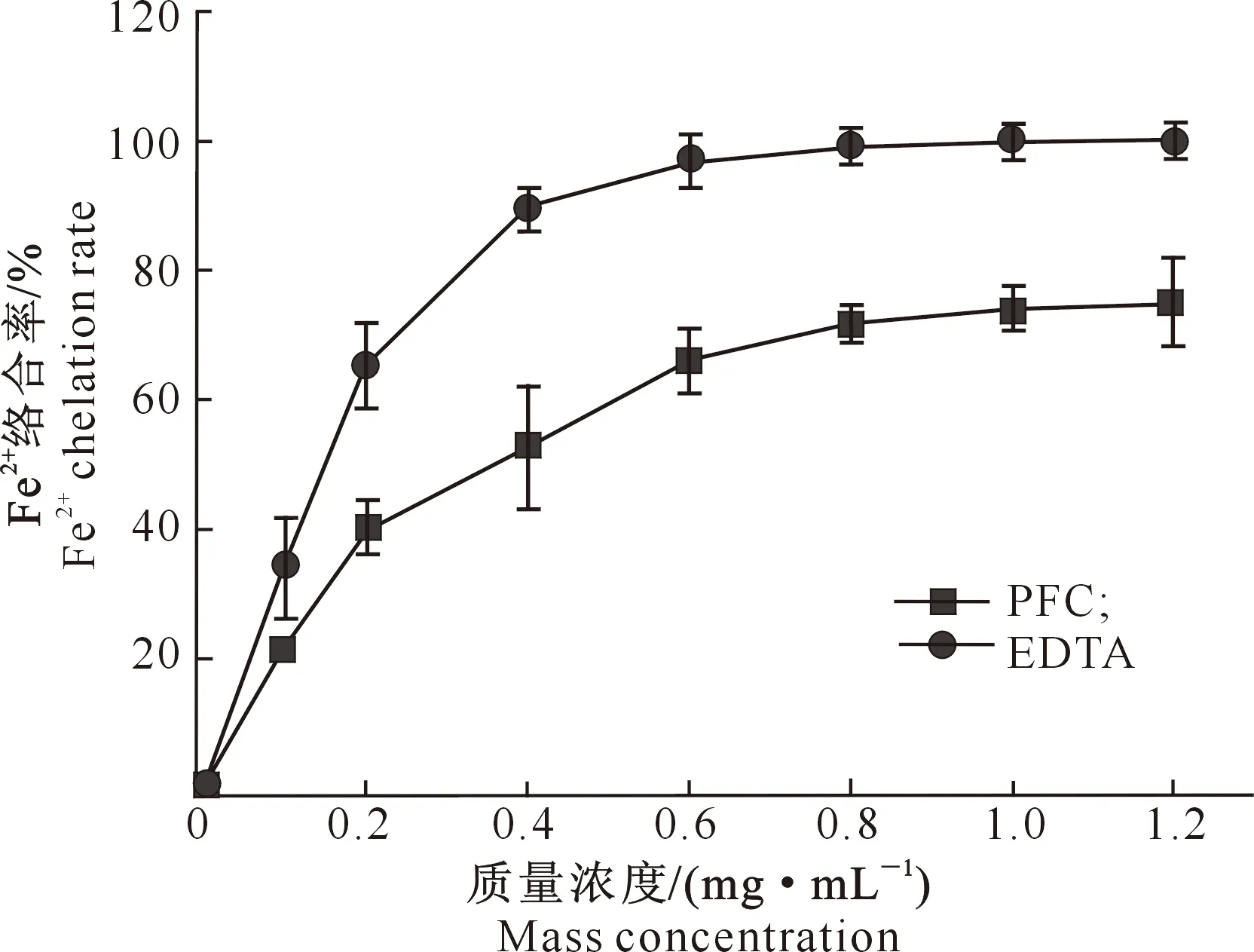
图3 山茱萸叶多糖的Fe2+络合活性Fig.3 Fe2+ chelating activities of PFC
由图3可见,随着PFC质量浓度的增大,其络合亚铁离子的能力增强,且有明显的量效关系,IC50为0.22mg/mL;但与EDTA(IC50为0.15mg/mL)相比,PFC对亚铁离子的络合活性较弱。
2.4 PFC对H2O2诱导氧化损伤HepG2细胞的影响
2.4.1 对HepG2细胞损伤的保护作用 通过MTT试验检测PFC对正常人肝癌细胞株HepG2的作用,结果(图4-A)显示,用不同质量浓度PFC溶液培养HepG2细胞24h后,细胞相对存活率均大于95%,证明PFC对正常培养状态下HepG2细胞不造成细胞毒性作用;且随着PFC质量浓度增大,细胞存活率逐渐上升;当PFC为0.8mg/mL时,与对照组相比,对细胞生长有显著的促进作用(P<0.05)。因此,0.025~0.8mg/mL的PFC溶液可以用于后续试验。
PFC对H2O2诱导的HepG2细胞损伤保护作用如图4-B所示,HepG2细胞经H2O2(400μmol/L)直接处理4h后,其细胞存活率下降至62.22%。但PFC可有效减缓H2O2对HepG2细胞的损伤, 0.2,0.4,0.8mg/mLPFC溶液均能极显著提高HepG2细胞相对存活率(P<0.01);当PFC质量浓度为0.4mg/mL时,细胞活力达最大值,相对存活率达92.75%以上。

与对照组(CK)比较,*P<0.05,**P<0.01Compared with control group (CK),*P<0.05,**P<0.01图4 山茱萸叶多糖对正常HepG2细胞(A)和H2O2诱导的HepG2 细胞(B)的作用Fig.4 Effect of PFC on normal(A)and H2O2 induced oxidative stress (B) HepG2 cells
2.4.2 对H2O2诱导的HepG2细胞内MDA和ROS水平的影响 脂质过氧化过程中发生的氧自由基氧化生物膜的过程,使细胞膜的流动性和通透性改变,导致细胞和细胞器结构损伤和功能障碍。MDA是脂质过氧化终端产物之一,可反映脂质过氧化水平,被广泛用于评价细胞氧化应激[25]。由图5-A可见,与对照组相比,HepG2细胞经H2O2(400μmol/L)直接处理4h后,532nm下细胞内的吸光度极显著增大(P<0.01),说明H2O2能引起HepG2细胞内MDA水平的升高。经不同质量浓度PFC溶液处理后,与模型组相比,HepG2细胞内MDA水平明显降低,且呈现剂量依赖性,说明PFC可以有效抑制氧化损伤细胞内脂质过氧化产物的生成。
细胞内过多的活性氧自由基会对细胞产生毒害作用,损伤生物膜、蛋白质、核酸等,导致疾病和衰老的发生,因此活性氧水平是衡量细胞氧化损伤的重要指标[25]。由图5-B可见,未用PFC的氧化损伤HepG2细胞内ROS含量比对照组高70%以上,不同质量浓度PFC溶液培养均可降低HepG2细胞内ROS含量,且呈现剂量依赖性。与模型组比较,当PFC溶液为0.4mg/mL时,胞内ROS含量显著降低(P<0.05);当用0.8mg/mLPFC溶液处理细胞时,胞内ROS含量极显著降低(P<0.01),胞内ROS含量与对照组无显著性差异(P>0.05)。

与对照组比较,*表示P<0.05,**表示P<0.01;与模型组比较,#表示P<0.05,##表示P<0.01Compared with control group,*P<0.05,**P<0.01;compared with model group,#P<0.05,##P<0.01
3 讨 论
多糖亦称多聚糖,是指由10个及以上单糖残基通过糖苷键连接而成的天然高分子化合物[26]。多糖在抗肿瘤、抗炎、抗病毒、降血糖、防衰老、抗凝血和免疫调节等方面具有重要的生物活性[27]。以多糖结构为基础,研究其在免疫调节、抗肿瘤、抗氧化等方面的生物活性功能是该领域进一步发展和应用的重点。

本研究评价了PFC对DPPH·和·OH清除能力、亚铁离子络合活性以及其对H2O2诱导HepG2细胞活力的影响,发现PFC对DPPH·的IC50为0.13mg/mL,对·OH的IC50为0.56mg/mL,其抗氧化能力与VC相当;经H2O2处理的HepG2细胞,细胞存活率下降至62.22%,胞内MDA和ROS水平上升;而不同质量浓度PFC溶液均可提高细胞相对存活率,当PFC为0.4mg/mL时,胞内MDA和ROS含量均显著降低,且细胞活力达最大值,相对存活率达92.75%以上。本研究结果可为PFC在生物药品资源、功能性食品领域的开发和应用提供参考。
