有氧运动对大鼠海马和前额叶皮层ERK/CREB/BDNF信号通路的影响
2019-07-16李艳荣兰顺领
李艳荣,兰顺领,晋 倩
(1.巢湖学院 体育学院,安徽 合肥 238000;2.广东酒店管理职业技术学院 体育与艺术系,广东 东莞 523900)
抑郁症、阿尔兹海默症(AD)、帕金森病(PD)等多种神经性疾病都伴有脑部萎缩,主要表现为神经元的逐渐凋亡、神经元细胞呈现退化趋势,记忆力衰退等[1-3].当今快节奏的社会环境中,神经退行性疾病呈现年轻化趋势、发病率逐渐升高.医学研究表明神经元退行性疾病患者脑组织神经元存在可再生性[4].
ERK/CREB/BDNF信号通路是治疗神经退行性疾病的重要途径和作用靶点之一[5].脑源性神经营养因子(brain derived neurotrophic factor,BDNF)是神经营养因子家族的一员,研究发现BDNF不仅能起到营养神经的作用,而且能够促进神经元再生,在神经退行性病变方面有很高的研究价值[6].cAMP反应元件结合蛋白(cAMP response element binding protein,CREB)是一种在大脑中广泛表达的核转录因子,近年研究发现,CREB可能是应激性损伤后细胞存活的关键因素,具有重要的抗凋亡效应[7-8].细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinase,ERK)是引起CREB磷酸化的重要激酶.有文献报道,只有磷酸化的CREB才能激活下游基因BDNF的表达[9].本研究通过观察3周无负重游泳运动后大鼠海马和前额叶皮层ERK/CREB/BDNF信号通路蛋白表达的情况,探讨运动预防神经退行性病变的机制.
1 实验材料和方法
1.1实验动物及分组
8周龄SPF级健康雄性SD大鼠20只,购于广州中医药大学实验动物中心[动物生产许可证:SCXK(粤)2013-0034],体重为 180~220 g.动物房环境温度 25±2℃,相对湿度 50%~65%.自由进食进水、自然昼夜,自然饲养一周后随机分为空白对照组(C组)和运动组(E组)两组,10只/组.C组大鼠自然饲养,自由进食进水;E组大鼠进行3周无负重游泳.
1.2主要试剂
兔抗P-ERK1/2蛋白单克隆抗体:美国Abcam公司;兔抗CREB蛋白单克隆抗体:美国Abcam公司;兔抗P-CREB蛋白单克隆抗体:美国Abcam公司;兔抗BDNF蛋白多克隆抗体:美国CST公司.
1.3 运动方案
运动组在适应性喂养结束后进行3天适应性游泳训练,每天10 min,之后进行正式运动干预;游泳运动方案采用3周无负重游泳,第一周采用递增运动负荷方式,第一天20 min,第二天25 min,第三天30 min,以后每天递增10 min,直到60 min/天.第二周、第三周6次/周,60 min/天.
1.4 组织样本的取材
在第三周实验结束后24 h,根据大鼠体重腹腔注射10%水合氯醛(0.35~0.4 ml/kg)进行麻醉,腹主动脉取血后断头取脑,清洗并分离出海马和前额叶皮层,分别用锡纸包埋立即放入液氮中,-80℃保存,待测指标.整个取脑过程在冰面上快速进行操作,取材均由同一人完成.
1.5 组织蛋白的测定
用Western Blotting方法检测海马和前额叶皮层P-ERK1/2、CREB、P-CREB、BDNF的表达量.将适量组织加入组织裂解液进行匀浆、离心、浓缩、蛋白定量后,在沸水中煮8 min使蛋白质变性.用BCA法测定蛋白浓度,与加样缓冲液混匀,加样25 ul,进行SDS-PAGE电泳分离、转膜,将转移好的PVDF膜放入10%脱脂奶粉封闭液中封闭 2 h,PBST 洗膜 5次,每次 5 min.加 P-ERK1/2抗体(1∶1 000)、CREB 抗体(1∶2 000)、P-CREB 抗体(1∶1 000)、BDNF 抗体(1∶1 000)孵育过夜,PBST 洗膜 5 次,每次 5 min.加入辣根过氧化物酶标记的二抗(1∶1 000)孵育1 h,PBST洗膜5次,每次5 min.应用ECL荧光底物混合液浸泡PVDF膜,室温孵育3~5 min后,用滤纸擦干,于暗室曝光,胶片显影、定影.
1.6 统计学分析
使用SPSS 21.0统计软件处理数据,结果均用平均数±标准差(X¯±S)表示,组间比较采用独立样本T检验,P<0.05表示差异具有显著性,P<0.01表示差异具有非常显著性.
2 实验结果
2.1 两组大鼠海马相关蛋白的表达
与 C 组相比,E组大鼠海马 P-ERK1/2、CREB、P-CREB、BDNF蛋白表达量均明显增加(P<0.01).其中P-ERK1/2约平均升高1.5倍,CREB约平均升高1.7倍,P-CREB约平均升高2.3倍,BDNF约平均升高3.4倍(见图1及表1).

图1 两组大鼠海马信号通路蛋白的表达
表1 两组大鼠海马信号通路相关蛋白的相对表达(±S)

表1 两组大鼠海马信号通路相关蛋白的相对表达(±S)
注:与 C 组相比,*代表 P<0.05 ,**代表 P<0.01,下同.
指标 P-ERK/GAPDH C 1.37±0.02 E 2.07±0.06**CREB/GAPDH 1.30±0.10 2.20±0.11**P-CREB/GAPDH 0.31±0.02 0.73±0.04**BDNF/GAPDH 0.33±0.04 1.12±0.07**
2.2 两组大鼠前额叶皮层相关蛋白的表达
与C组相比,E组大鼠前额叶皮层P-ERK1/2、CREB、P-CREB、BDNF蛋白表达量均明显增加(P<0.01).其中P-ERK1/2约平均升高1.5倍,CREB约平均升高1.6倍,P-CREB约平均升高4.1倍,BDNF约平均升高4倍(见图2及表2).
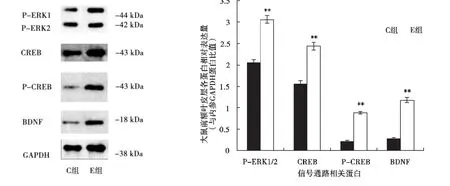
图2 两组大鼠前额叶皮层信号通路蛋白的表达
表2 两组大鼠前额叶皮层信号通路相关蛋白的相对表达(±S)

表2 两组大鼠前额叶皮层信号通路相关蛋白的相对表达(±S)
指标 P-ERK/GAPDH C 2.06±0.06 E 3.06±0.08**CREB/GAPDH 1.56±0.07 2.44±0.09**P-CREB/GAPDH 0.21±0.02 0.87±0.03**BDNF/GAPDH 0.29±0.02 1.18±0.06**
3 分析讨论
ERK1/2是MAPKs家族中的重要成员,在未受到细胞刺激时,ERK1/2分布在胞质中,被激活磷酸化后则进入细胞核调节CREB等核转录因子的活性,发挥细胞调节作用;未进入核内活化的ERK停留在胞浆,可磷酸化细胞骨架蛋白,调节细胞形态及骨架的重分布[10].
大量研究发现ERK是海马树突结构形成所必需的,与学习记忆功能密切相关.CREB参与神经元的再生过程,记忆训练活动可以促进CREB的激活,增加P-CREB基因的表达,这种现象在大脑皮质和海马区均有发生[11].通过手术切断双侧海马伞或者向大鼠海马内注入CREB的反义寡核苷酸,然后对大鼠进行学习记忆行为的训练,大鼠逃避行为减弱、记忆力衰退,这种现象伴随海马P-CREB表达的下降[12].
Roberson等用ERK拮抗剂作用于海马CA1区血小板凝集抑制剂激活的CREB,最终P-CREB表达量显著下降[13].被激活的CREB可以促进BDNF和其受体TrkB的表达,注入CREB的反义寡核苷酸可以抑制BDNF的上调[14].研究发现,BDNF的作用不仅是营养保护神经元,还参与神经损伤后的再生过程[15].李小龙研究表明,4周单纯有氧运动可以非常显著性的上调P-ERK的表达,而总蛋白表达量没有差异[16].这说明有氧运动是通过上调P-ERK的表达,起到了预防Aβ引起的海马炎症反应的作用,而不是通过ERK蛋白本身.赵燕研究表明,每天自主跑轮运动1 h,连续进行8周,可以非常显著性的促进大鼠海马P-ERK的表达[17].Shen等报道一次自愿跑轮运动可以增加大鼠海马P-CREB的表达,并发现CREB与BDNF基因CRE序列的结合增加,促进BDNF基因的转录,这次运动的效果可以持续一周[18].Vaynman等发现一周自愿运动不但可促进CREB的磷酸化水平,而且发现CREB mRNA基因表达增加[19].MJChen发现,2周的跑轮运动训练后P-CREB的水平升高约60倍,如果配合抗抑郁药物的使用,甚至可升高90倍[20].长时间运动可以提高BDNF的表达,BDNF的高表达有抗抑郁、提高应变能力的效果,还可以延缓由衰老引起的认知功能的退化.
4结语
研究结果显示3周游泳运动可以增加大鼠海马和前额叶皮层神经元ERK/CREB/BDNF信号通路蛋白的表达,增强神经元的可塑性,从而保护神经元免受损伤、参与神经元损伤后修复,有氧运动对皮层ERK/CREB/BDNF信号通路相关蛋白表达的促进作用强于海马.
